Grenzen in der Physiologie
Einführung
Arterielle Barorezeptoren dienen als Frontliniensensoren zur Erfassung von Blutdruckänderungen im Blutstrom. Änderungen des Blutdrucks stimulieren die mechanosensitiven Nervenenden, die in den Arterienwänden lokalisiert sind. Die mechanische Kraft wird an den Nervenenden in elektrische Signale umgewandelt, was zu druckabhängigen Aktionspotentialbränden in Barorezeptorneuronen führt. Die Nervensignale breiten sich dann zur Baroreflex-Regulierung des Blutdrucks zum kardiovaskulären Kontrollzentrum im Hirnstamm aus (Levy MN, 2007). Darüber hinaus spielen auch supra-medulläre Strukturen, einschließlich des keilförmigen Kerns des Mittelhirns und des ventralen medialen präfrontalen Kortex, eine hemmende Rolle bei der Baroreflex-Regulation (Verberne et al., 1997). Es gibt zwei arterielle Barorezeptoren, nämlich die Aorten-Barorezeptoren und Carotis-Barorezeptoren, die sich in der Adventitia-Schicht des Aortenbogens bzw. der Carotis-Arterien befinden. Die Aortenbarorezeptoren erfassen den Blutdruck in der Aorta. Die Zellkörper (Soma) der Aorten-Barorezeptoren befinden sich am Nodose-Ganglion (NG) (Abbildung 1). Die Nervensignale von den Nervenenden des Aorten-Barorezeptors werden über einen sensorischen Nerv namens Aorten-Depressor-Nerv (ADN) an das Nodose-Ganglion übertragen (Abbildung 1). Carotis-Barorezeptoren erfassen den Blutdruck in der Carotis-Arterie, die das Gehirn mit Blut versorgt. Die Nervenenden der Carotis-Barorezeptoren befinden sich bilateral an den Bifurkationen der Carotis-Arterie nahe der inneren Carotis-Arterie. Die Nervensignale der Karotis-Barorezeptoren wandern entlang der Karotissinusnerven (CSN) zu ihrem im Petrosalganglion (PG) lokalisierten Soma. Das Petrosalganglion ragt über das Foramen jugularis hinaus (Abbildung 1) (McDonald, 1983; Shoukas et al., 1991; Vander et al., 1998; Sato et al., 1999; Donnelly und Rigual, 2000; Weijnen et al., 2000). . Da Aorten-Barorezeptoren den Blutdruck in der Aorta erfassen, die den gesamten systemischen Kreislauf mit Blut versorgt, wird erwartet, dass diese Barorezeptoren eine wichtige funktionelle Rolle bei der Aufrechterhaltung des gesamten systemischen Blutdrucks spielen. Andererseits erfassen Karotis-Barorezeptoren den Druck des Blutes, das an das Gehirn abgegeben wird. Diese Barorezeptoren können für die Aufrechterhaltung eines stabilen zerebralen Blutdrucks und zerebralen Blutflusses wichtiger sein.
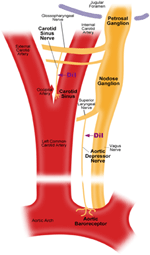
Abbildung 1. Schematische Darstellung der Aorten- und Karotis-Barorezeptor-Terminals und -Nerven. Diagramm zur Darstellung der anatomischen Positionen der Nervenenden der Aorten- und Karotis-Barorezeptoren, ihrer Nervenfasern und Somata-Regionen. Aorten-Barorezeptor-Terminals befinden sich im Aortenbogen. Seine afferente Nervenfaser ist der Nervus aorticus depressor. Das Soma befindet sich im Nodose Ganglion (NG). Der Carotis-Barorezeptor befindet sich in der A. carotis interna neben der Carotis-Bifurkation. Sein afferenter Nerv ist der Nervus carotis sinus. Das Soma befindet sich im Petrosalganglion (PG).
Es gibt widersprüchliche Berichte darüber, welche Barorezeptoren, Aortenbarorezeptoren oder Karotis Barorezeptoren reagieren empfindlicher auf Blutdruckänderungen. Einige Forscher berichteten, dass die Carotis-Barorezeptoren druckempfindlicher sind (Donald und Edis, 1971; Fadel et al., 2003), während andere glauben, dass Aorten-Barorezeptoren druckempfindlicher sind (Glick und Covell, 1968; Pickering et al., 2008) und wieder andere haben keinen Unterschied in der Druckempfindlichkeit zwischen diesen beiden Barorezeptoren berichtet (Hainswor et al., 1970; James und Daly, 1970). In fast allen dieser früheren Studien wurden jedoch nur die Baroreflex-Reaktionen (wie Herzfrequenz und Aktivität des sympathischen Nierennervs) als Endpunkte für den Barorezeptor-Sensitivitätsassay verwendet. Es gibt noch keine Studie, die die Druckempfindlichkeit von Aorten- und Karotis-Barorezeptorneuronen per se direkt aufzeichnet und vergleicht.
Hier haben wir eine Hochgeschwindigkeitsdruckklemme verwendet, um den hydrostatischen Druck innerhalb von Barorezeptorneuronen zu ändern und zu messen die entsprechenden elektrophysiologischen Reaktionen dieser Neuronen durch Ganzzell-Patch-Clamping. Wir verwendeten auch eine einachsige Dehnungskammer, um die Barorezeptorneuronen zu dehnen, und maßen die entsprechenden Änderungen des zytosolischen Ca2 + in diesen Neuronen. Zusätzlich haben wir für In-vivo-Tierstudien die druckinduzierten Aktionspotential-Brände in den Nerven des Aortendepressors und der Karotissinus gemessen, die die sensorischen Nerven der Aorten- bzw. Karotis-Barorezeptoren sind.
Materialien und Methoden
Tiere
Alle Tierversuche wurden unter der Genehmigung einer von der Regierung der Sonderverwaltungszone Hongkong ausgestellten Lizenz und mit Genehmigung der Ethikkommission für Tierversuche der chinesischen Universität von Hongkong durchgeführt.Männliche Sprague-Dawley (S / D) -Ratten (180–200 g) wurden vom Laboratory Animal Services Center der chinesischen Universität Hongkong zur Verfügung gestellt.
Primärkultur
S / D. Ratten wurden mit Pentobarbital-Natrium (100 mg / kg) anästhesiert. Der linke Halsbereich wurde durch einen Mittellinienschnitt unter sterilisierten Bedingungen freigelegt. Wie in Abbildung 1 gezeigt, wurde der Nervus aorticus depressor oder der N. carotis sinus freigelegt und 2–3 mm des Nervs durch stumpfe Dissektion vorsichtig vom umgebenden Gewebe gelöst. Fluoreszierender lipophiler Tracer 1,1-Dioctadecyl-3,3,3 ‚, 3‘-tetramethylindocarbocyanin (DiI) -Kristalle (Invitrogen) wurden um den Nerv herum angebracht und mit Kwik-Sil (World Precision Instruments, USA) bedeckt. Der Einschnitt wurde anschließend genäht. Die Ratten konnten sich 5–7 Tage erholen, damit der DiI-Farbstoff retrograd entlang des Nervus aorticus depressor oder des Nervus carotis sinus zu den Somata diffundieren konnte, die sich im Nodose-Ganglion bzw. Petrosal-Ganglion befanden.
Nodose oder Petrosal-Ganglion Neuronen wurden aus DiI-markierten Ratten isoliert und in eiskaltem EBSS in Stücke geschnitten. Sie wurden 1 h bei 37 ° C mit Trypsin (1 mg / ml) und Kollagenase IA (1 mg / ml) verdaut. Einzelne Neuronen wurden durch leichtes Verreiben mit einer Glaspasteurpipette und anschließende Zentrifugation dispergiert. Die Neuronen wurden resuspendiert und in DMEM / F-12-Medien kultiviert, die mit 5% FBS, 1% Antibiotikum-Antimykotikum und 7S NGF (100 ng / ml) ergänzt waren. Cytosin-Arabinofuranosid (Ara-C; 10 & mgr; M) wurde in das Kulturmedium aufgenommen, um das Wachstum sich teilender Zellen zu hemmen. Die Neuronen wurden vor den Experimenten mindestens 3 Tage lang kultiviert. Zur Aufzeichnung des Aktionspotentials wurden die Neuronen frisch isoliert und mindestens 30 Minuten vor den Experimenten in F12 inkubiert. Für alle Experimente wurden die Zellen auf mit 0,1 mg / ml Poly-L-Lysin vorbeschichteten Objektträgern inkubiert, mit Ausnahme der Zelldehnungsexperimente, bei denen die Silikonkammern mit 2% Gelatine vorbeschichtet waren h3> Patch Clamp
Die Aufzeichnung der Stromzange für ganze Zellen wurde mit einem EPC7-Patch Clamp-Verstärker (HEKA, Deutschland) erreicht. Patch-Pipetten mit einem Widerstand von 3–5 MΩ wurden mit Pipettenlösung (in mM) gefüllt: 130 K-Gluconat, 10 KCl, 2 MgCl 2, 2 Na 2 ATP, 0,4 Tris GTP, 1 EGTA, 10 HEPES, pH 7,25–7,3 durch KOH. Die Zellen wurden in der künstlichen Cerebrospinalflüssigkeit (ACSF) (in mM) gebadet: 120 NaCl, 2 KCl, 1,2 MgSO 4 · 7H 2 O, 1,2 KH 2 PO 4, 26 NaHCO 3, 2,5 CaCl 2, 11 Glucose, äquilibriert mit Carbogen (95% O 2 und 5) % CO2). Bei der aktuellen Clamp-Aufzeichnung wurden die Zellen auf ihrem Ruhepotential gehalten. Ein Hochgeschwindigkeits-Druckklemmsystem (HSPC-1, ALA Scientific Instruments, USA) wurde verwendet, um der Zelle über eine Mikropipette einen Überdruck zu verleihen. Die Aufzeichnungen wurden bei 50 kHz abgetastet und bei 5 kHz gefiltert. Die Daten wurden mit PulseFit (HEKA) analysiert. Alle Experimente wurden bei Raumtemperatur durchgeführt.
Calcium Imaging
Die zytosolische Ca2 + -Messung wurde wie an anderer Stelle beschrieben durchgeführt (Wong et al., 2010). Kurz gesagt wurden die Zellen 40 Minuten lang mit 5 & mgr; M Fluo-4 / AM beladen. Die zytosolische Ca 2+ -Messung wurde mit HEPES-gepufferter Lösung (in mM) durchgeführt: 140 NaCl, 2,5 KCl, 1 MgCl 2, 1 CaCl 2, 10 HEPES, 10 Glucose, pH 7,4 durch NaOH. Die zytosolische Ca2 + -Änderung als Reaktion auf einachsige Dehnung wurde mit dem STREX Cell Stretching System (ST-150, B-Bridge International, Inc.) durchgeführt. Die Zellen wurden 1 s lang durch 10, 20 oder 30% der unidirektionalen Dehnung stimuliert. Die zytosolische Ca2 + -Reaktion wurde bei Raumtemperatur gemessen. Die Fluo-4-Fluoreszenz wurde aufgezeichnet und mit dem konfokalen Laserscanning-Bildgebungssystem FV1000 analysiert. Die Änderung der cytosolischen Ca2 + -Fluoreszenzantwort wurde als Verhältnis (Fx / F0) der Echtzeitfluoreszenz ausgedrückt, wobei Fx das Echtzeit-Fluo-4 / AM-Signal und F0 das Basis-Fluo-4 / AM-Signal vor der Dehnung ist / p>
Aufzeichnung der Nervenaktivität
Ratten wurden mit 100 mg / kg Pentobarbital-Natrium anästhesiert. Der zervikale Bereich wurde durch Mittellinienschnitt freigelegt. Die rechte Halsschlagader wurde isoliert und mit einem Katheter kanüliert, der zur Blutdruckaufzeichnung mit dem Druckwandler (ML221, ADInstruments, USA) verbunden war. Die linke Oberschenkelvene wurde für die Phenylephrin- und SNP-Injektion kanüliert. Der linke Nervus aorticus depressor oder der Nervus carotis sinus wurde mit einer bipolaren Silberelektrode verbunden, gefolgt von einem Verstärker (Differential-Wechselstromverstärker Modell 1700, A-M Systems Inc., USA). Sowohl der Blutdruck als auch die Nervenaktivität wurden kontinuierlich in Tabelle 5.0 (AD Instruments) aufgezeichnet. Die Nervenaktivität wurde 10.000-mal verstärkt und bei einem Bandpass von 100–5000 Hz gefiltert. Die Werte des mittleren arteriellen Drucks, der Herzfrequenz und der Spitzenfrequenz als Reaktion auf Phenylephrin wurden mit der Software in Tabelle 5.0 analysiert. Die Änderung der Spitzenfrequenz (Spitzenfrequenz nach Phenylephrin – Spitzenfrequenz vor Phenylephrin) als Reaktion auf die maximale Blutdruckänderung (mittlerer arterieller Blutdruck nach Phenylephrin – mittlerer arterieller Blutdruck vor Phenylephrin) nach Phenylephrininjektion wurde berechnet (Lau et al., 2016). .
Statistische Analyse
Repräsentative Spuren wurden als Zeitverlaufsspuren aufgezeichnet. Die Daten aller Experimente wurden in einem Balkendiagramm zusammengefasst, das als Mittelwert ± Sem der einzelnen Experimente ausgedrückt wurde. Der t-Test des Schülers wurde zur statistischen Analyse verwendet. Gegebenenfalls wurde ein paarweiser t-Test verwendet.
Ergebnisse
Eigenschaften von Aortendepressorneuronen und Karotissinusneuronen
Dil wurde entweder auf den Nervus aorticus depressor oder den Nervus carotis sinus angewendet. Daher umfassten Dil-markierte Neuronen im Nodose-Ganglion die Barorezeptorneuronen, die den Aortenbogen innervieren, und die Chemorezeptorneuronen, die den Aortenkörper innervieren. Andererseits Dil-markierte Neuronen in Das Petrosalganglion umfasste die Barorezeptorneuronen, die den Karotissinus innervierten, und die Chemorezeptorneuronen, die den Karotiskörper innervierten. Wir untersuchten zunächst die grundlegenden Eigenschaften dieser Dil-markierten Neuronen. DiI-markierte Neuronen in Nodose und Petrosalganglion wurden getrennt kultiviert und einem depolarisierenden elektrischen Strom ausgesetzt Es wurden zwei Arten von Reaktionen aufgezeichnet, eine mit einem einzigen Aktionspotential und die andere mit kontinuierlichen Aktionspotentialen nach dem Depolarisationsstrom (Abbildung) 2) (Belmonte und Gallego, 1983). Diese Neuronen wurden anschließend einem hydrostatischen Druckprotokoll unterzogen, um ihre Empfindlichkeit gegenüber Änderungen des hydrostatischen Drucks zu testen. Eine positive hydrostatische Druckrampe wurde intrazellulär durch eine Glasmikropipette durch das Hochgeschwindigkeitsdruckklemmsystem (HSPC-1, ALA Scientific Instruments, USA) angelegt, bis Aktionspotentiale hervorgerufen wurden. Die Ergebnisse zeigten, dass 45% der Aorten-Barorezeptorneuronen als Reaktion auf den depolarisierenden elektrischen Strom kontinuierliche Aktionspotentiale abfeuerten (Tabelle 1A). Unter ihnen reagierten 91% (41% / 45%) auch auf die hydrostatische Druckänderung und zeigten druckabhängige Aktionspotentialbrände (Tabelle 1A). Die verbleibenden 55% der Aorten-Barorezeptor-Neuronen feuerten nur ein einziges Aktionspotential als Reaktion auf den Depolarisationsstrom ab (Tabelle 1A), und unter ihnen konnten 40% (22% / 55%) auf die Druckänderung reagieren (Tabelle 1A). Für die Carotis-Barorezeptor-Neuronen gaben 45% der Zellen kontinuierliche Aktionspotentiale, wenn sie durch den Depolarisationsstrom stimuliert wurden (Tabelle 1B). Unter ihnen waren 82% (37% / 45%) auch empfindlich gegenüber der Druckänderung (Tabelle 1B). Zusätzlich könnten unter den Carotis-Barorezeptor-Neuronen, die nur ein einziges Aktionspotential als Reaktion auf den depolarisierenden Strom abfeuerten, 24% (13% / 55%) auf die Druckänderung reagieren (Tabelle 1B).
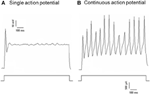
Abbildung 2. Aufzeichnung des Aktionspotentials von kultivierten Aortendepressor- und Karotissinusneuronen. Dargestellt sind die Spuren von Aktionspotentialen, die von zwei repräsentativen Aortendepressor / Karotissinus-Neuronen bei einem depolarisierenden Strom aufgezeichnet wurden. (A) Ein repräsentatives Neuron, das bei der aktuellen Stimulation nur ein einziges Aktionspotential abfeuert; (B) Repräsentative Neuronen, die bei der aktuellen Stimulation nur kontinuierliche Aktionspotentiale auslösen. Unteres Feld: Protokoll für die Strominjektion. Maßstabsbalken, horizontal, 100 ms, vertikal, 10 mV (obere Spuren) und 500 pA (untere Spuren). n = 27 und n = 38 für Aortendepressor- bzw. Karotissinusneuronen.

Tabelle 1. Eigenschaften von Aortendepressor- und Karotissinusneuronen.
Unabhängig davon, ob sie ein einzelnes Aktionspotential oder ein kontinuierliches Aktionspotential abfeuerten, wurde festgestellt, dass 63% der Dil-markierten Aorten-Barorezeptor-Neuronen empfindlich auf die Druckänderung reagieren, während nur 50% der Dil-markierten Carotis-Barorezeptor-Neuronen empfindlich auf das reagieren Druckänderung (Tabelle 1).
Dehnungsempfindlichkeit von Aorten- und Karotis-Barorezeptorneuronen
Die Druckschwelle für die Entladung des Aktionspotentials wurde analysiert. Wie in 3 gezeigt, hatten Aorten-Barorezeptor-Neuronen eine niedrigere Druckschwelle (24 ± 4 mmHg) als die der Carotis-Barorezeptor-Neuronen (39 ± 4 mmHg).

Abbildung 3. Empfindlichkeit von Aorten- und Karotis-Barorezeptorneuronen gegenüber hydrostatischem Druck. (A, B) Oberes Feld, repräsentative Zeitverlaufsspuren, die die druckabhängigen Aktionspotential-Brände in Barorezeptorneuronen der Aorta (A) und der Karotis (B) veranschaulichen. Die Druckrampe (untere Platte) wurde durch eine Mikropipette unter Verwendung eines Hochgeschwindigkeits-Druckklemmsystems (HSPC) auf das Innere der Zellen aufgebracht. Maßstab horizontal, 1 s, vertikal, 20 mV und 20 mmHg. (C) Zusammenfassung, die die Druckschwelle zeigt, die die Aktionspotentialfeuerungen in Aorten- und Karotis-Barorezeptorneuronen auslöst. n = 13 für Aorten-Barorezeptor-Neuronen und n = 15 für Carotis-Barorezeptor-Neuronen. *** p < 0,01 nach dem Student-t-Test.
Dehnungsinduzierte Ca2 + -Reaktion in Barorezeptorneuronen
Kultivierte Aortendepressor- oder Karotissinusneuronen wurden ausgesetzt 10, 20 oder 30% der einachsigen Dehnung durch das STREX Cell Stretching System, wobei versucht wird, die Dehnung des Blutgefäßes unter Blutdruck nachzuahmen. Die Ergebnisse zeigten, dass eine einachsige Dehnung von 20% einen deutlichen Anstieg der zytosolischen Ca2 + -Fluoreszenz in Barorezeptorneuronen der Aorta, nicht jedoch in Barorezeptorneuronen der Karotis induzierte (Abbildungen 4A – C). Darüber hinaus war die Stärke des Ca2 + -Fluoreszenzanstiegs als Reaktion auf eine uniaxiale Dehnung von 30% in Aorten-Barorezeptorneuronen viel höher als in Karotis-Barorezeptorneuronen (4A – C).
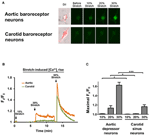
Abbildung 4. Empfindlichkeit von Aortendepressor- und Karotissinusneuronen gegenüber uniaxialer Dehnung. Die Zellen wurden mit Ca 2+ -empfindlichem Fluoreszenzfarbstoff Fluo-4 / AM beladen. Dargestellt sind repräsentative Bilder (A) und Zeitverlaufsspuren (B) des relativen zytosolischen Ca2 + -Anstiegs als Reaktion auf eine uniaxiale Dehnung von 10, 20 und 30% der Zelllänge in Neuronen des Aortendepressors und der Karotissinus. (C) Zusammenfassung des maximalen zytosolischen Ca2 + -Anstiegs als Reaktion auf unterschiedliche Dehnungsgrade. Die Änderung des cytosolischen Ca2 + wurde als Fx / F0 ausgedrückt, wobei Fx das Echtzeit-Fluo-4 / AM-Signal und F0 das Basis-Fluo-4 / AM-Signal vor dem Strecken ist. Mittelwert ± s.e.m. (n = 5). * p < 0,05, *** p < 0,01 im Vergleich zur entsprechenden Kontrolle durch paarweisen t-Test.
Barorezeptor-Nervenaktivität in vivo
Die Nervenaktivität der beiden Barorezeptoren wurde in vivo untersucht. Phenylephrin wurde intravenös injiziert. Die Änderungen des Blutdrucks bei der Anwendung von Phenylephrin sind in der oberen Tafel der 5A, B gezeigt. Die Subsequenzänderungen der Barorezeptornervenaktivität sind im unteren Feld gezeigt (5A, B). Die druckinduzierte Nervenaktivität war im Nervus aorticus depressor viel höher als im Nervus carotis sinus (5A, B). Die Änderung der Spitzenfrequenz pro mmHg-Anstieg ist in 5C zusammengefasst. Das Ergebnis zeigte, dass die Aorten-Barorezeptoren in vivo empfindlicher auf hydrostatischen Druck reagieren als die Carotis-Barorezeptoren.
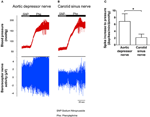
Abbildung 5. Barorezeptornervenaktivität bei Ratten in vivo. (A, B) Repräsentative Spuren, die die Veränderung der Aktivität des Nervus aorticus depressor (A) und des Nervus carotis sinus (B) bei Blutdruckerhöhung zeigen. In beiden (A, B) war das obere Feld die Änderung des Blutdrucks vor und nach der Phe-Anwendung, wie durch die horizontalen Balken angezeigt. Das untere Feld war die entsprechende Änderung der Nervenaktivität. (C) Zusammengefasste Daten, die die Änderung der Nervenaktivität pro Einheit der Blutdruckänderung zeigen. Mittelwert ± s.e.m. (n = 8). * p < 0,05 im Vergleich zur Kontrolle in Aortenbarorezeptoren durch paarweisen t-Test.
Expression von TRP-Kanälen
Es wurde berichtet, dass mehrere TRP-Kanäle mechanosensitiv sind, einschließlich TRPC1, -C3, -C5, -C6, -V1, -V4, -P2 (O. „Neil und Heller, 2005; Christensen und Corey, 2007; Pedersen und Nilius, 2007; Patel et al., 2010; Lau et al., 2016). Hier untersuchten wir die mögliche Rolle dieser mechanosensitiven TRP-Kanäle in Bezug auf die Aorta und Carotis-Barorezeptor-Empfindlichkeit. Die mRNA-Expression dieser Kanäle in Nodose und Petrosal-Ganglion wurde verglichen. Es wurde gefunden, dass die Expression von TRPV4 und TRPC6 im Nodose-Ganglion im Vergleich zu Petrosal-Ganglion höher war (6). Es ist möglich, dass die höhere Die Expression mechanosensitiver Kanäle im Nodose-Ganglion kann zur höheren Empfindlichkeit beitragen.
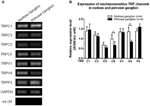
Abbildung 6. Expression von mechanosensitive TRP-Kanäle in Nodose und Petrosalganglion. (A) Repräsentative Gelbilder, die das mRNA-Expressionsniveau von mechanosensitiven TRP-Kanälen (TRPC1, -C3, -C5, -C6, -V1, -V4, -P2) zwischen Nodose- und Petrosalganglionneuronen vergleichen. Eine semiquantitative RT-PCR-Analyse wurde verwendet, um die mRNA-Expressionsniveaus mehrerer TRP-Kanäle relativ zur GAPDH-mRNA-Expression zu vergleichen. Die Ergebnisse von 9 Experimenten wurden in (B) zusammengefasst. Die Werte waren im Mittelwert ± Sem. * p < 0,05 durch paarweisen t-Test.
Diskussion
In der vorliegenden Studie wurden die mechanosensitiven Eigenschaften von Aorten- und Carotis-Barorezeptoren verglichen. Ganzzellige Patch-Clamp-Studien zeigten, dass im Vergleich zu den Carotis-Sinus-Neuronen ein höherer Prozentsatz der Aortendruckor-Neuronen streckenempfindlich war. Darüber hinaus wurde festgestellt, dass die Druckschwelle, die Aktionspotential-Zündungen auslösen könnte, in den Aorten-Barorezeptor-Neuronen niedriger ist als in den Karotis-Barorezeptor-Neuronen. Der durch einachsige Dehnung induzierte zytosolische Ca2 + -Anstieg wurde auch zwischen dem Aortendepressor und den Karotissinusneuronen verglichen.Das Ausmaß des zytosolischen Ca2 + -Anstiegs als Reaktion auf die uniaxiale Dehnung war in Aorten-Barorezeptor-Neuronen viel höher als in Carotis-Barorezeptor-Neuronen. Aorten-Barorezeptor-Neuronen zeigten auch eine niedrigere Schwelle der zytosolischen Ca2 + -Reaktionen auf uniaxiale Dehnung. In einer anderen Reihe von Experimenten fanden wir heraus, dass der druckinduzierte Anstieg des Aktionspotentials beim Nervus aorticus depressor höher war als beim Nervus carotis sinus. Zusammengenommen liefern unsere Daten starke Beweise dafür, dass die Aorten-Barorezeptoren gegenüber Blutdruck empfindlicher sind als die Carotis-Barorezeptoren.
Bisher wurden große Anstrengungen unternommen, um den Unterschied in der Empfindlichkeit zwischen den beiden Barorezeptoren zu verstehen. Die Ergebnisse sind jedoch umstritten. Einige Berichte kamen zu dem Schluss, dass die Aorten-Barorezeptoren empfindlicher auf Druckänderungen reagieren (Glick und Covell, 1968; Fan et al., 1996; Pickering et al., 2008), während andere angaben, dass die Carotis-Barorezeptoren empfindlicher auf Druckänderungen reagieren (Donald und Edis, 1971; Fadel et al., 2003). Fast alle dieser früheren Studien umfassten jedoch hochkomplizierte chirurgische Eingriffe und verwendeten letztendlich Baroreflex-Reaktionen wie Herzfrequenz und sympathische Nierenleistung als Endpunkte für den Barorezeptor-Sensitivitätsassay. Komplizierte chirurgische Eingriffe können zu experimentellen Fehlern führen, die zu kontroversen Schlussfolgerungen führen können. Darüber hinaus ist auch eine tierartenabhängige Variation der Barorezeptorempfindlichkeit möglich. Darüber hinaus wird die Baroreflex-Reaktion nicht nur von der Barorezeptorempfindlichkeit beeinflusst, sondern auch von mehreren anderen Faktoren, einschließlich Nervenleitung, zentraler Mediation, Kontraktilität der Blutgefäße und Herzfunktion. Daher sind die Beweise aus früheren Studien indirekt und kaum ideal. Bis heute fehlen direkte Studien zum Vergleich der Druckempfindlichkeit von Aorten- und Karotis-Barorezeptorneuronen. In dieser Studie wurde die Mechanosensitivität direkt in Barorezeptorneuronen untersucht. Die Daten legen nahe, dass die Aortenbarorezeptoren druckempfindlicher sind als die Karotisbarorezeptoren. Diese Informationen können eine wichtige physiologische Relevanz für die Blutdruckregulation haben.
Es ist unklar, welche Mechanismen dem Unterschied in der Druckempfindlichkeit zwischen Aorten- und Karotis-Barorezeptoren zugrunde liegen. Wir verglichen das Expressionsniveau mehrerer mechanosensitiver TRP-Kanäle (6) (O Neil und Heller, 2005; Christensen und Corey, 2007; Pedersen und Nilius, 2007; Patel et al., 2010). Unsere Ergebnisse zeigten, dass Aorten-Barorezeptor-Neuronen haben eine höhere Expression mehrerer mechanosensitiver TRP-Kanäle, einschließlich TRPV4 und TRPC6. Es ist möglich, dass eine höhere Expression von TRPV4 und / oder TRPC6 zur hohen Druckempfindlichkeit von Aorten-Barorezeptoren beiträgt. Weitere Studien sind erforderlich, um die Rolle dieser Ionenkanäle zu verifizieren.
Es wurde bereits berichtet, dass Nodose-Ganglion und Petrosal-Ganglion zwei verschiedene Arten von Neuronen enthalten (Belmonte und Gallego, 1983). Einer von ihnen gibt bei elektrischer Stimulation kontinuierliche Aktionspotentiale, während der andere nur eine einzige Aktion liefert Die Autoren wiesen die ersteren als druckempfindliche Neuronen und die letzteren als chemosensitive Neuronen zu. Unsere Ergebnisse deuten darauf hin, dass dies möglicherweise nicht angemessen ist te, um die druckempfindlichen Neuronen und druckunempfindlichen Neuronen nur basierend darauf zuzuordnen, ob sie als Reaktion auf den depolarisierenden Strom ein einzelnes Aktionspotential oder kontinuierliche Aktionspotentiale auslösen. Tatsächlich ist ein großer Prozentsatz der Zellen, die als Reaktion auf eine elektrische Stimulation ein einzelnes Aktionspotential auslösen, auch druckempfindlich und gehören daher zu druckempfindlichen Barorezeptorneuronen (Abbildung 2 und Tabelle 1).
Zusammenfassend liefert die vorliegende Studie Hinweise darauf, dass die Aorten-Barorezeptoren druckempfindlicher sind als die Carotis-Barorezeptoren und fügt dem Verständnis der grundlegenden Physiologie neue Informationen hinzu.
Autorenbeiträge
EL und XY entwerfen die Experimente und entwerfen das Manuskript. EL, CL und YY führen die Experimente durch. XY, YH, AM und LJ haben das Manuskript überarbeitet. Alle Autoren genehmigten die endgültige Fassung des Manuskripts.
Finanzierung
Diese Arbeit wurde durch Zuschüsse des Hong Kong Research Grant Committee CUHK478710, CUHK478413, AoE / M-05/12, unterstützt. TBRS / T13-706 / 11, Zuschuss 31470912 der China National Science Foundation und gemeinsamer Zuschuss N_CUHK439 / 13 von RGC und NSFC.
Interessenkonflikterklärung
Die Autoren erklären, dass die Forschung durchgeführt wurde in Ermangelung kommerzieller oder finanzieller Beziehungen, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
James, JEA, und Daly, MDB (1970). Vergleich der vasomotorischen Reflexreaktionen auf die getrennte und kombinierte Stimulation von Barorezeptoren der Karotissinus und des Aortenbogens durch pulsierende und nicht pulsierende Drücke beim Hund. J. Physiol. 209, 257–293. doi: 10.1113 / jphysiol.1970.sp009165
PubMed Abstract | CrossRef Volltext | Google Scholar
Levy MN, P. A. (2007). Herz-Kreislauf-Physiologie. Philadelphia, PA: Mosby Elsevier.
Vander, A. J., Sherman, J. H. und Luciano, D. S. (1998). Humanphysiologie: der Mechanismus der Körperfunktion. Boston, MA: WCB McGraw-Hill.