A farmakológia határai
Bevezetés
A homoktövis az Elaeagnaceae tagja. Jelenleg termelési méretben termesztik, elsősorban Oroszországban és Kínában, és egyre több fajtában szerte a világon (azaz Finnországban, Németországban és Észtországban).
In vitro, valamint emberi és állati eredetű A homoktövis in vivo vizsgálatai során számos bioaktív vegyi anyagot találtak leveleiben, gyökereiben, magjaiban és bogyóiban, tengeri áfonyának vagy szibériai ananásznak, valamint a belőlük kivont olajnak; ezek a vegyületek sokféle gyulladásgátló, rákellenes, antioxidáns és atherosclerotikus aktivitást mutatnak (Zeb, 2006; Basu és mtsai, 2007; Kumar és mtsai, 2011; Suryakumar és Gupta, 2011; Xu és mtsai, 2011; Christaki, 2012; Teleszko et al., 2015; Olas, 2016; Ulanowska et al., Sajtóban). A bogyókban található több nyomelem és vitamin (különösen A, C és E), lipidek, karotinoidok, aminosavak, telítetlen zsírsavak és fenolos vegyületek az 1. táblázatban találhatók (Olas, 2016; Gradt et al., 2017; Ulanowska et al., Sajtóban). A bogyókban való koncentrációjuk az éghajlattól, a növény méretétől, érettségétől, valamint a növényi anyag feldolgozásához és tárolásához használt eljárástól függ (Fatima et al., 2012; Malinowska és Olas, 2016). Gao és mtsai. (2000) az érlelés során a homoktövis bogyók antioxidáns tulajdonságainak, valamint más típusú biológiai aktivitás változásairól számolnak be, amelyek szoros összefüggésben voltak az összes fenolos vegyület és az aszkorbinsav tartalmával. Ezenkívül a lipofil kivonat antioxidáns aktivitása jelentősen megnőtt, és megfelelt az összes karotinoid tartalom növekedésének.
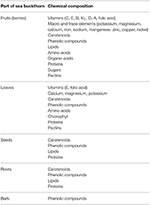
1. táblázat: A homoktövis egyes részeinek kémiai összetétele (44; módosítva).
Számos egészséges összetevő megtalálható nemcsak a nyers gyümölcsökben, hanem különféle készítményekben is, például lekvárokban, gyümölcslevekben, lekvárokban vagy tinktúrákban. A homoktövis bogyókból piték és likőrök is készíthetők (Li és Hu, 2015). Hu (2005) jelentése szerint a homoktövis magjából olaj, a levelekből pedig tea készülhet. Míg a magvakból készült teák hashajtó tulajdonságokkal rendelkeznek és segítenek a fogyásban, a levelek infúziói hasmenés ellenes tulajdonságokkal rendelkeznek; emellett a gyümölcs teák erősítik az immunrendszert, és aktivitást mutatnak a bőrbetegségek ellen (Frohne, 2010; Sarwa, 2001).
A homoktövis pozitív és egyedülálló tulajdonságai legalább a VII. Kr. E. (Suryakumar és Gupta, 2011; Li és Hu, 2015). A növényt nemcsak a természetgyógyászatban, hanem az állatgyógyászatban is alkalmazták a helminthiasis enyhítésére a lovaknál, és nagyobb tömegű, valamint gyönyörű, fényes szőrzetet nyújtottak számukra. Jelenleg termékeit számos iparágban használják, különösen a gyógyszeriparban, a kozmetikai és az élelmiszeriparban, de díszítő elemként, tűzifaként, vagy akár a degradált területek rehabilitációjának eszközeként is. A történelmi feljegyzések szerint a homoktököt először Kínában használták kábítószerként, és a modernebb időkben a növényt 1977-ben hivatalosan is felsorolták a Kínai Gyógyszerkönyvben (The State of Pharmacopoeia Commission of PR China, 1977).
A modern vizsgálatok kimutatták, hogy a homoktövis részei természetes gyógymódként szolgálhatnak a szív- és érrendszeri megbetegedések, valamint a bőr, a máj és a gyomor betegségei ellen. Bioaktív vegyületeinek terápiás potenciálját a 2. táblázat mutatja be. Ez az áttekintő cikk összefoglalja a homoktövis különböző szerveivel kapcsolatos jelenlegi ismereteket, és megvitatja, hogy ezek jelenthetnek-e “arany középutat” a rák kezelésében. Fontos megjegyezni hogy a cikk forrásinformációi nemcsak in vitro modellekből, hanem in vivo modellekből is származnak.
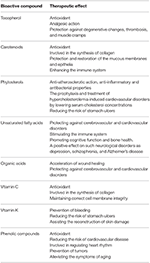
2. táblázat: A homoktövis bioaktív vegyületek és terápiás hatásaik (44; módosítva).
A homoktövis rákellenes aktivitása
Számos fitofarmakon, különösen olyan fenolos vegyületek, mint a proantocianidinek, a kurkumin és a resveratrol, megállapították, hogy jelentős előnyökkel járnak a rák kemoprevenciójában (Barrett, 1993; Bagchi és Preuss, 2004; Bagchi és mtsai, 2014; Shanmugam és mtsai, 2015; Ko és mtsai, 2017) és sugárterápia (Cetin és mtsai, 2008). Jól dokumen azt állította, hogy a fenolos vegyületek, különösen a procianidinek és a flavonoidok magasabb étrendi bevitele alacsonyabb rákkockázattal jár (Barrett, 1993; Bagchi és Preuss, 2004; Duthie és mtsai, 2006; Zafra-Stone és mtsai, 2007; Cetin és mtsai, 2008; Seeram, 2008; Bagchi és mtsai, 2014; Chen és mtsai, 2014; Wang és mtsai, 2014; Giampieri és mtsai, 2016; Kristo és mtsai., 2016).A homoktövis számos biológiai és farmakológiai aktivitással rendelkezik, beleértve a rákellenes tulajdonságokat is. Noha az mögöttük lévő molekuláris mechanizmusok továbbra sem tisztázottak, ezek a vegyületek ismertek a különböző szervekben és termékeikben, különösen a gyümölcslében és az olajban (Xu et al., 2011). A homoktövis daganatellenes aktivitása az antioxidáns vegyületeknek tulajdonítható, különösen a fenolos vegyületeknek, például a flavonoidoknak, beleértve a kaempferolt, a kvercetint és az izorhamnetint; ezek megvédik a sejteket az oxidatív károsodásoktól, amelyek genetikai mutációhoz és rákhoz vezethetnek (Christaki, 2012).
In vitro vizsgálatok
Különböző in vitro vizsgálatok kimutatták, hogy a homoktövis rákellenes hatású . Például Zhang és mtsai. (2005) a homoktövis magjából származó flavonoidok által kiváltott változásokat vizsgálták az apoptózissal kapcsolatos gének expressziójában az emberi emlőrák Bcap-37 sejtvonalában. Bioinformatikai elemzésük megállapította, hogy 32 elemzett gén, köztük a CTNNB1, IGFBP4, GADD34 és a kaszpáz 3 expresszióját, amelyek a Bcap-37 sejtek apoptózisához kapcsolódnak, flavonoid kezelés befolyásolta.
Teng et al. (2006) megállapította, hogy az izorhamnetin (3′-metoxi-3,4′5,7-tetra-hidroxil-flavon; a homoktövisből izolált flavonoid) citotoxikus hatást fejt ki humán hepatocelluláris carcinoma sejtekkel (BEL-7402), IC50-értéke kb. 75 μg / ml 72 órás kezelés után. Li és mtsai. (2015) azt is megállapította, hogy az izorhamnetinnek in vitro proliferációgátló hatása van a tüdőrák sejtjeire, ha 10 és 320 μg / ml közötti koncentrációban alkalmazzák, és in vivo C57BL / 6 egerekben, ha orálisan adják be (50 mg / kg / nap). 7 napig. A szerzők szerint az izorhamnetin hatásmechanizmusa magában foglalhatja a sejtek apoptózisát, amelyet az onkogének downregulációja és az apoptotikus gének upregulációja indukál. Más megfigyelések azt mutatták, hogy az izorhamnetin elnyomja a sejtek proliferációját az emberi kolorektális rákos sejtvonalakból (HT-29, HCT 116 és SW480), a sejtciklus leállását indukálja a G2 / M fázisban, és a PI3K-Akt gátlásával elnyomja a sejtek proliferációját. -mTOR útvonal. Ezenkívül az izorhamnetin csökkentette az Akt (Ser473), a foszf-p70S6 kináz és a foszf-4E-BP1 (t37 / 46) fehérje foszforilációs szintjét, és fokozta a ciklin B1 fehérje expresszióját 20 és 40 μM koncentrációban (Li et al., 2014).
Az MDA-MB-231 emberi mellráksejteken végzett tanulmányban Wang és mtsai. (2014) megállapította, hogy a magokból izolált homoktövis-procianidinek gátló hatást gyakorolnak a zsírsav-szintázra (FAS): a de novo hosszú láncú zsírsav-bioszintézis kulcsfontosságú enzime, amelynek magas szintje a rákos sejtekben található meg. Ez a gátlás dózisfüggő volt 0 és 0,14 μg / ml közötti koncentrációknál. 0,087 μg / ml koncentráció gátolta a FAS aktivitás 50% -át. Ezenkívül a sejtek növekedését a homoktövis procianidinekkel történő kezelés 10-60 μg / ml közötti koncentrációban elnyomta. Ezenkívül megállapították, hogy a tesztelt procianidinek dózisfüggő módon indukálják a sejtek apoptózisát. A szerzők azt sugallják, hogy ezek a procianidinek az intracelluláris FAS aktivitás gátlásával indukálhatják az MDA-MB-231 sejtek apoptózisát.
Olsson és mtsai. (2004) összehasonlította 10 különböző gyümölcs- és bogyókivonat, köztük a homoktövis bogyók hatását a HT29 félig-vastagbél rákos sejtek és az MCF-7 emlőrák sejtjeinek szaporodására. Megfigyelték, hogy a homoktövisnek volt a legnagyobb gátló hatása a HT29 és MCF-7 sejtek szaporodására a két legmagasabb beadott koncentrációnál (0,25 és 0,5%). A szerzők szerint a rákos sejtek szaporodásának gátlása összefüggésben volt a karotinoidok és a C-vitamin koncentrációjával. Sőt, a karotinoidok, a C-vitamin és az antocianinok közötti szinergikus hatás jelenlétét javasolják. Emellett McDougall et al. (2008) megjegyzi, hogy a homoktövis bogyókivonat enyhén antiproliferatív hatást fejtett ki az in vitro nőtt méhnyak és egy vastagbél rákos sejtekkel szemben.
Boivin és mtsai. (2007) 13 bogyófajta, köztük a homoktövis, 10-50 μg / ml koncentrációjú levének antiproliferatív aktivitását határozta meg in vitro öt rákos sejtvonallal szemben: AGS – gyomor adenokarcinóma, ACF-7 – emlőmirigy adenokarcinóma, PC-3 – prosztata adenocarcinoma, Caco-2 – colorectalis adenocarcinoma és MDA-MB-231 – emlőmirigy adenocarcinoma. Megállapították, hogy a homoktövis bogyólé, mint a szeder és a fekete arábia leve, antiproliferatív tulajdonságokkal rendelkezik. Nem találtak összefüggést a bogyós gyümölcslevek antiproliferatív tulajdonságai és antioxidáns kapacitása között, és a rákos sejtek proliferációjának lé általi gátlása nem tartalmazott kaszpázfüggő apoptózist. Ennek ellenére megfigyelték a tumor nekrózis faktor (TNF) által kiváltott aktiválódását az aktivált B sejtek magfaktor kappa-könnyűlánc-fokozójának (NFκB).
Nemrégiben Guo és mtsai.(2017) a homoktövis négy különböző alfajának bogyóinak fitokémiai összetételét, valamint antioxidáns és antiproliferatív tulajdonságait vizsgálta HepG2 humán májrák sejtekkel szemben in vitro: H. rhamnoides L. subsp. sinensis (Sinensis), H. rhamnoides L. subsp. yunnanensis (Yunnanensis), H. rhamnoides L. subsp. mongolica (Mongolica) és a H. rhamnoides L. subsp. turkestanica (Turkestanica). Ezen alfajok közül a H. rhamnoides L. subsp. A sinensis a legnagyobb összes fenoltartalmat és a megfelelő összes antioxidáns aktivitást mutatta, míg a legnagyobb sejtes antioxidáns és antiproliferatív tulajdonságokat a H. rhamnoides L. subsp. yunnanensis. Ezeket a tulajdonságokat a fenolsavak és a flavonoid aglikonok hatásának tulajdonították.
Zhamanbaeva et al. (2014) a homoktövis levelekből származó etanol kivonat hatásait tanulmányozta az emberi akut mieloid leukémia sejtek (KG-1a, HL60 és U937) növekedésére és differenciálódására. Noha egy növényi kivonatról kiderült, hogy gátolja a sejtnövekedést a sejt törzse és az extraktum dózisa szerint, a tanulmány nem azonosítja a vizsgált kivonat kémiai tartalmát. A kivonat három koncentrációját használták: 25, 50 és 100 μg / ml. Az eredmények arra utalnak, hogy a homoktövis kivonat akut myeloid leukémia sejtekre gyakorolt antiproliferatív hatását részben az S fázis ellenőrzőpont aktiválása határozta meg, ami valószínűleg a sejtciklus lassulásához és az apoptózis indukciójához vezetett.
Máshol, Zhamanbayeva et al. (2016) különféle növényi kivonatok (10–100 μg / ml) antiproliferatív és differenciálódást fokozó aktivitását tanulmányozta, beleértve a homoktövis leveleiből származó víz-etanol kivonatot is: kiderült, hogy a teljes polifenol-tartalma körülbelül 46 mg GA ekvivalens / g szárított kivonat, teljes flavonoidtartalom körülbelül 23 mg kvercetin-egyenérték / g szárított kivonat. A szerzők megfigyelték, hogy a vizsgált kivonatok, köztük a homoktövis kivonat, csökkentették az akut mieloid leukémia sejtek növekedését és életképességét; ezenkívül nem citotoxikus dózisok mellett a sejttípustól függően potencírozták az 1α, 25-dihidroxi-D3-vitamin alacsony koncentrációja által kiváltott sejtdifferenciálódást is. Sőt, a vizsgált kivonatok erősen gátolták a mikroszómális lipidperoxidációt, és megvédték a normál vörösvértesteket a hipo-ozmotikus sokktól.
Kim és mtsai. (2017) azt javasolja, hogy a homoktövis levélkivonat, amely körülbelül 70 mg / g összes fenolvegyületet és körülbelül 460 μg / g katechint tartalmaz, gátolhatja a patkány C6 glioma sejtjeinek gyors szaporodását, ha 0,62, 6,2 és 62 μg / ml dózisban adják be, valószínűleg az apoptózis korai eseményeinek kiváltásával. A szerzők azt is javasolják, hogy a C6 glioma sejtproliferációjának és életképességének csökkenése a növényi kivonat beadását követően a reaktív oxigénfajták termelésének csökkenésével járt, amelyek kritikus fontosságúak a tumorsejtek szaporodása szempontjából. Ezenkívül a homoktövis nemcsak szabályozta a pro-apoptotikus Bcl-2-asszociált X (Bax) fehérje expresszióját, hanem elősegítette annak lokalizálódását a sejtmagban.
Különböző tanulmányok szerint a homoktövis olaj is rendelkezik daganatellenes tulajdonságok. Ez az olaj beépíthető kapszulákba, zselatinba és orális folyadékokba (Yang és Kallio, 2002). Ezenkívül a toxicitási vizsgálatok nem jelentenek káros hatást a homoktövis olajjal kezelt alanyokban (Upadhyay et al., 2009). Kumar és mtsai. (2011) szerint a homoktövis olaj fontos szerepet játszik a rákterápiában, beleértve a kemoterápiát és a sugárterápiát, és hogy a homoktövis olaj szedése számos mellékhatást vagy kezelést ellensúlyozhat, helyreállíthatja a vese- és májműködést, növelheti az étvágyat, és általában a betegeket jó egészség. Wang és mtsai. (1989) megfigyelte, hogy a magolaj 3–50% -kal késlelteti a tumor növekedését. Zhang és mtsai. (Zhang, 1989) kimutatták, hogy a magolaj injekciója (1,59 g / testtömeg-kg) jelentősen gátolta az átültetett melanoma (B16) és a szarkóma (S180) daganatok növekedési sebességét egerekben. Wu és mtsai. (1989) a homoktövismagolaj méhnyakrák elleni védőhatását az A- és E-vitamin jelenlétének tulajdonítja. Végül Sun és mtsai. (2003) megjegyzi, hogy a homoktövis magjaiból kivont olajból származó flavonoidok gátló hatást fejtenek ki a májrák BEL-7402 sejtvonalán az apoptózis kiváltásával.
A homoktövis magjai és bogyós pépje számos egyéb bioaktív vegyületet tartalmaz , beleértve a telítetlen zsírsavakat és a fitoszterineket. Ismeretes, hogy a telítetlen zsírsavak sokirányú hatást gyakorolnak az emberi egészségre, például az immunrendszer stimulálásával. Ezenkívül a fitoszterinek rákellenes tulajdonságokkal rendelkeznek (Sajfratova és mtsai., 2010; Dulf, 2012). A homoktövis olaj összetételéről és hasznos egészségügyi szempontjairól további részleteket Olas (2018) ad. A homoktövis ráksejtekre gyakorolt hatását a különböző in vitro modellekben a 3. táblázat ismerteti.

3. táblázat.A homoktövis hatása a rákos sejtekre in vitro modellekben.
In vivo vizsgálatok
Homoktövis rákellenes tulajdonságokkal rendelkeznek mind állatkísérleti, mind in vitro és in vivo vizsgálatok során. A homoktövis gyümölcs kemoprevenciós hatásának vizsgálata Padmavathi és mtsai. (2005) azt találták, hogy gátolják a dimetil-benzenoantracen által kiváltott bőr papillomagenesisét egerekben. A szerzők szerint a karcinogenezis gátlása a II. Fázisú enzimek, azaz a glutation-S-transzferáz, a glutation-peroxidáz, a kataláz, a szuperoxid-diszmutáz és a glutation-reduktáz egyidejű indukciójának tulajdonítható az egér májában. Ezenkívül a szerzők azt is javasolják, hogy a homoktövis gyümölcs rákellenes hatása az interferon-1-es szabályozó faktor (IRF-1) DNS-kötő aktivitásának fokozásán alapulhat, amely egy ismert antionkogén transzkripciós faktor, amely növekedéscsökkentést és apoptózist okoz. / p>
Nersesyan és Muradyan (2004) szerint a homoktövis lé megvédi az egereket a ciszplatin genotoxikus hatása ellen: ez egy jól ismert rákellenes gyógyszer, amely szintén nagyon mérgező a normális sejtekre. Az ex-tempore előállított homoktövislét (300 ml) 5 vagy 10 napos időtartamra szántuk át egereknek. 3 órával az utolsó szoptatás után az egerek ciszplatint kaptak 1,2 vagy 2,4 mg / kg koncentrációban. Yasukawa és mtsai. (2009) a homoktövis ágak 70% -os etanol-kivonatának (1 mg növényi kivonat / egér) tumorellenes tulajdonságokkal rendelkezik egy in vivo kétlépcsős karcinogenezis tesztben, két 15 egércsoporttal; 7,12-dimetilbenzantracén indikátorként és 12-O-tetracecanoil-forbol-13-acetát promóterként. A három fenolos vegyület (katechin, gallokatechin és epigallokatechin) és az extraktumból izolált triterpenoid ursolsav, az epigallokatechin és az ursolsav közül a legaktívabbnak találták.
Wang és mtsai. (2015) megállapította, hogy nemcsak a homoktövis fenolos vegyületeinek vagy fenolkivonatainak / frakcióinak van rákellenes tulajdonságai: HRWP-A, vízoldható homogén poliszacharid, ismétlődő egységekben (1 → 4) -β-D-galaktopiranoziluronsavak, amelynek 85,2% -a metilcsoportokkal észterezett, szintén in vivo rákellenes és immunstimuláló aktivitást mutat. Daganatellenes aktivitási vizsgálat kimutatta, hogy a HRWP-A jelentősen gátolhatja a Lewis tüdő karcinóma (LLC) növekedését daganatot hordozó egerekben. Ezenkívül ez a vegyület fokozta a limfociták szaporodását, fokozta a makrofágaktivitásokat és elősegítette a természetes gyilkos sejtaktivitást daganatot hordozó egerekben. A szerzők három különböző dózisú poliszacharidot (50, 100 és 200 mg / kg) használtak, amelyeket intragasztrikusan adtak be minden nap 14 napig.
A homoktövis sugárvédő képessége
Due a biológiailag aktív vegyületek és antioxidánsok magas tartalma miatt a homoktövis sugárvédő aktivitása miatt bekerül a rákterápiába, amelyet Goel és munkatársai számos tanulmányban bizonyítottak. (2002, 2003a, b, 2004, 2005). Agrawala és Goel (2002) a friss tengeri homoktövis bogyók teljes kivonatának védő tulajdonságokkal rendelkezik (H. rhamnoides – RH-3; 25–35 mg / testtömeg-kg), különösen az egér csontvelő sugárzás által kiváltott mikrotagjai esetében. Emellett Goel és mtsai. (2002) megállapította, hogy az RH-3 in vitro gátolta a Fenton reakciót és a hidroxilgyökök sugárzás által közvetített termelését.
Kumar és mtsai. (2002) jelentése szerint az RH-3 gátolta a sugárzás és a tercier butil-hidroperoxid által kiváltott DNS-szál töréseket dózisfüggő módon, amint azt a Comet-teszt kimutatta. Megállapítják továbbá, hogy a kromatin 100 és 120 pg / ml RH-3 vagy annál nagyobb koncentrációban fordul elő, amely az atomokat sugárzással szemben ellenállóvá tette, még 1000 Gy dózisban is. Goel és mtsai. (2003a) beszámolnak a jejunális kripták RH-3 általi védelméről az egész test halálos gamma besugárzása (10 Gy) ellen, és hogy a kaszpáz-3 aktivitás szintén szignifikánsan alacsonyabb volt azoknál az egereknél, akiket RH-3-val kezeltek a besugárzás előtt, a besugárzott kontrollokhoz képest. Érdekes módon az RH-3 sugárvédő dózisa (30 mg / testtömeg-kg) szignifikáns DNS-fragmentációt indukált (spektrofluorimetriásan vizsgálták) a timocitákban egerekben in vivo. Ezenkívül a besugárzás előtti homoktövis kezelésről kiderült, hogy fokozza a sugárzás által kiváltott apoptózist in vivo (Goel és mtsai, 2004). Goel és mtsai. (2005) azt is sugallják, hogy az egerek 30 mg / kg homoktövis bogyó kivonattal történő előkezelésével végzett védelem megvédi a mitokondrium funkcionális integritását a sugárzás okozta oxidatív stressztől. Ezek a kísérletek az oxidatív stressz különféle biomarkereinek szintjét vizsgálták, ideértve a szuperoxid-aniont, a lipidperoxidációt és a fehérjeoxidációt. Érdekes módon az RH-3 immunstimuláló tulajdonságokkal rendelkezik, amelyek fontos szerepet játszhatnak radioprotektív hatékonyságában (Prakash et al., 2005).
Következtetés
Bár számos tanulmány megerősítette a homoktövis rákellenes aktivitását, gyógyászati és profilaktikus dózisa továbbra sem ismert, és még nem végeztek klinikai vizsgálatokat: csak in vitro vagy in vivo kísérleti állatok bevonásával végzett vizsgálatok. Ismeretes, hogy a homoktövis részt vehet a rák megelőzésében és kezelésében; emellett az immunrendszer teljesítményének jelentős javításával és a hematológiai károsodások enyhítésével felgyorsítja a kemoterápiában részesülő betegek egészségének visszatérését. Az 1. ábrán a homoktövis különböző részein található bioaktív anyagok számos tulajdonsággal rendelkeznek, beleértve az antioxidáns, gyulladáscsökkentő és proliferatív hatásokat; apoptózist is kiváltanak és erősítik az immunrendszert; a molekuláris mechanizmusok azonban továbbra sem tisztázottak. Ezért, mielőtt a homoktövis a rákos megbetegedések kezelésének “arany középpontjának” tekinthető, további tanulmányokat igényel egy sor kiváló minőségű tanulmányban.
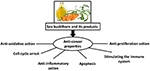
1. ábra: Hipotetikus hatásmechanizmusok, amelyek révén a homoktövis kemoterápiás és terápiás reakciókat válthat ki a rák ellen.
Szerzői közreműködés
Minden felsorolt szerző (BO, BS, KU) jelentős, közvetlen és szellemi hozzájárulást adott a munkához, és jóváhagyta publikáció.
Összeférhetetlenségi nyilatkozat
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
A bíráló BW és a kezelő szerkesztő bejelentette megosztott hovatartozását.
Köszönetnyilvánítás
Ezt a munkát a Lengyel Nemzeti Tudományos Központ támogatta 2015/19 / B / NZ9 / 03164 .
Abbreviatio ns
Bagchi, D. és Preuss, H. G. (2004). Phytopharmaceuuticals in Cancer Chemoprevention, 1. kiadás. Bocca Raton, FL: CRC Press.
Frohne, D. (2010). Leksykon Roślin Leczniczych MedPharm. Wroclaw, 276.
Google Tudós
Hu, S. (2005). “Hippophae rhamnoides L. – homoktövis, shaji” a Food Food Plants of China-ban (The Chinese University Press), 572.
Sarwa , A. (2001). Wielki Leksykon Roślin Leczniczych. Warszawa: Książka i Wiedza.
A PR Kínai Gyógyszerkönyv Állami Bizottsága ( Pharmacopeia of the People’s Republic of China 1997, Peking.
Zeb, A. (2006). A hippophaákból származó lipidek rákellenes hatása – bizonyíték a legújabb irodalomból. Ázsiai Pac. J. Cancer Prev. 7, 32–34.
PubMed Abstract | Google Tudós
Zhang, P. (1989). A homoktövismagolaj rákellenes tevékenységei és hatása az immunszervek súlyára A homoktövis 2, 31–34.