A fiziológia határai
Bevezetés
Az artériás baroreceptorok frontvonal-érzékelőként szolgálnak a véráramlás vérnyomás-változásainak észlelésére. A vérnyomás változása stimulálja a artéria falain lokalizált mechanoszenzitív idegvégződéseket. A mechanikai erő az idegterminálokon elektromos jelekké alakul át, ami nyomásfüggő akciós potenciál-lőést eredményez a baroreceptor neuronokban. Az idegjelek ezután továbbjutnak az agytörzs szív- és érrendszeri központjába a vérnyomás baroreflexes szabályozásához (Levy MN, 2007). Ezenkívül a szupra-medulláris struktúráknak, köztük a középagy agyi ékírásos magjának és a ventrális mediális prefrontális kéregnek, szintén gátló szerepük van a baroreflex szabályozásában (Verberne et al., 1997).
Két artériás baroreceptor létezik, nevezetesen: az aorta baroreceptorok és a carotis baroreceptorok, amelyek az aortaív és az carotis artéria adventitia rétegében helyezkednek el. Az aorta baroreceptorok érzékelik a vérnyomást az aortában. Az aorta baroreceptorok sejttestei (soma) a nodózus ganglionnál (NG) helyezkednek el (1. ábra). Az aorta baroreceptor idegtermináljairól érkező idegjeleket az aortadepresszor idegnek (ADN) nevezett szenzoros idegen keresztül továbbítják a nodózus ganglionba (1. ábra). A carotis baroreceptorok észlelik a carotis vérnyomását, amely vért juttat az agyba. A carotis baroreceptorok idegtermináljai kétoldalt helyezkednek el a carotis carotis bifurkációinál, közel a belső carotis artériához. A carotis baroreceptoroktól érkező idegi jelek a carotis sinus idegek (CSN) mentén a petrosalis ganglionban (PG) lokalizált szómájukig jutnak. A petrosalis ganglion a nyaki foramen túl nyúlik ki (1. ábra) (McDonald, 1983; Shoukas és mtsai, 1991; Vander és mtsai, 1998; Sato és mtsai, 1999; Donnelly és Rigual, 2000; Weijnen és mtsai, 2000) . Mivel az aorta baroreceptorok érzékelik a vérnyomást az aortában, amely a vért juttatja az egész szisztémás keringéshez, várhatóan ezek a baroreceptorok fontos funkcionális szerepet játszanak az általános szisztémás vérnyomás fenntartásában. Másrészt a carotis baroreceptorok érzékelik az agyba juttatott vér nyomását. Ezek a baroreceptorok fontosabbak lehetnek a stabil agyi vérnyomás és az agyi véráramlás fenntartása érdekében.
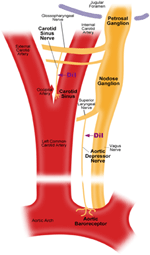
1. ábra: Az aorta és a carotis baroreceptor termináljainak és idegeinek sematikus ábrája. Az aorta és a carotis baroreceptorok idegtermináljainak, idegszálaiknak és somata régióinak anatómiai helyzetét szemléltető ábra. Az aorta baroreceptor termináljai az aorta boltívében helyezkednek el. Afferens idegrostja az aorta depresszor idege. A szóma a nodózus ganglionban (NG) van. A carotis baroreceptor a belső carotis artériában helyezkedik el a carotis bifurkáció mellett. Afferens idege a carotis sinus ideg. A szóma a petrosalis ganglionban (PG) található.
Ellentmondó jelentések vannak arról, hogy mely baroreceptorok, aorta baroreceptorok vagy carotis baroreceptorok, érzékenyebbek a vérnyomás változására. Egyes kutatók arról számoltak be, hogy a carotis baroreceptorok érzékenyebbek a nyomásra (Donald és Edis, 1971; Fadel et al., 2003), míg mások úgy vélik, hogy az aorta baroreceptorok érzékenyebbek a nyomásra (Glick és Covell, 1968; Pickering et al., 2008), és mások még nem számoltak be különbségről a nyomásérzékenységben e két baroreceptor között (Hainswor et al., 1970; James és Daly, 1970). Azonban ezeknek a korábbi vizsgálatoknak szinte mindegyike csak a baroreflex válaszokat (például a pulzusszámot és a vese szimpatikus idegaktivitását) használta a baroreceptor érzékenységi vizsgálat végpontjaként. Még mindig nincs olyan tanulmány, amely közvetlenül rögzítené és összehasonlítaná az aorta és a carotis baroreceptor neuronok nyomásérzékenységét önmagában.
Itt nagysebességű nyomásbilincset használtunk a baroreceptor neuronok belső hidrosztatikus nyomásának megváltoztatására, és mértük ezen idegsejtek megfelelő elektrofiziológiai válaszai teljes sejt tapasz befogásával. A baroreceptor idegsejtek nyújtásához egytengelyű nyújtókamrát is használtunk, és megmértük a citoszolos Ca2 + megfelelő változásait ezekben az idegsejtekben. Ezenkívül az in vivo állatkísérletekhez megmértük az aorta depresszor és a carotis sinus idegek nyomás által kiváltott akciós potenciálját, amelyek az aorta és a carotis baroreceptorok érzékszervi idegei.
Anyagok és módszerek
Állatok
Valamennyi állatkísérletet a hongkongi tartományi kormány által kiadott engedély engedélyével és a Hongkongi Kínai Egyetem állatkísérleti etikai bizottságának jóváhagyásával hajtották végre.Hím Sprague-Dawley (S / D) patkányokat (180–200 g) a Hongkongi Kínai Egyetem laboratóriumi állat-egészségügyi központja biztosított.
Elsődleges kultúra
S / D patkányokat pentobarbitál-nátriummal (100 mg / kg) altattunk. A bal nyaki területet középvonalbeli bemetszéssel sterilizált állapotban tettük ki. Amint az az 1. ábrán látható, az aorta depressziós ideg vagy a carotis sinus ideg láthatóvá vált, és az ideg 2-3 mm-ét tompa disszekcióval gondosan leválasztották a környező szövetekről. Fluoreszcens lipofil nyomjelzőt, 1,1-dioktadecil-3,3,3 ‘, 3’-tetrametil-indokarbocianin (DiI) kristályokat (Invitrogen) alkalmaztunk az ideg körül, és Kwik-Sil-lel (World Precision Instruments, USA) borítottuk be. A metszést utána varrták. A patkányokat 5-7 napig hagytuk felépülni, hogy a DiI festék retrográd módon diffundáljon az aorta depresszor ideg vagy a carotis sinus ideg mentén a nodózus ganglionban vagy a petrosalis ganglionban elhelyezkedő somatáig.
Nodose vagy petrosalis ganglion idegsejteket izoláltunk DiI-jelölt patkányokból, és jéghideg EBSS-ben darabokra vágtuk. 1 órán át 37 ° C-on tripszinnel (1 mg / ml) és kollagénáz IA-val (1 mg / ml) emésztettük őket. Az egyes idegsejteket gyengéd eldörzsöléssel, Glass Pasteur pipettával diszpergáljuk, majd centrifugálással. Az idegsejteket újraszuszpendáltuk és 5% FBS-sel, 1% antibiotikum-antimikotikummal és 7S NGF-del (100 ng / ml) kiegészített DMEM / F-12 táptalajban tenyésztettük. Citozin-arabinofuranozidot (Ara-C; 10 μM) adtunk a táptalajba az osztódó sejtek növekedésének gátlására. Az idegsejteket a kísérletek előtt legalább 3 napig tenyésztettük. Az akciós potenciál rögzítéséhez az idegsejteket frissen izoláltuk és F12-ben inkubáltuk legalább 30 perccel a kísérletek előtt. Az összes kísérlethez a sejteket 0,1 mg / ml poli-L-lizinnel előzetesen bevont üveglemezeken inkubáltuk, kivéve azokat a sejtfeszítési kísérleteket, amelyek során a szilikonkamrákat 2% zselatinnal előzetesen bevonták.
Patch Clamp
A teljes cellás áram rögzítő rögzítését egy EPC7 patch clamp erősítővel (HEKA, Németország) sikerült elérni. A 3-5 MΩ ellenállású tapasz pipettákat pipettaoldattal (mM-ben) töltöttük meg: 130 K-glükonát, 10 KCl, 2 MgCl2, 2 Na2ATP, 0,4 Tris GTP, 1 EGTA, 10 HEPES, pH 7,25-7,3 KOH-val. A sejteket mesterséges agy-gerincvelői folyadékban (mS) fürdettük: 120 NaCl, 2 KCl, 1,2 MgSO4 · 7H2O, 1,2 KH2PO4, 26 NaHCO3, 2,5 CaCl2, 11 glükóz, egyensúlyban volt karbogénnel (95% O2 és 5 % CO2). A jelenlegi rögzítő felvétel során a sejteket nyugalmi membránpotenciáljukon tartottuk. Nagysebességű nyomásbilincs-rendszert (HSPC-1, ALA Scientific Instruments, USA) alkalmaztunk a sejt pozitív nyomásának mikropipettán keresztül történő biztosítására. A felvételeket 50 kHz-en vettük mintába, és 5 kHz-en szűrtük. Az adatokat PulseFit (HEKA) alkalmazásával elemeztük. Az összes kísérletet szobahőmérsékleten végeztük.
Kalcium képalkotás
A citoszolos Ca2 + mérést a máshol leírtak szerint végeztük (Wong és mtsai., 2010). Röviden: a sejteket 5 μM Fluo-4 / AM-vel töltöttük 40 percig. A citoszolos Ca2 + mérését HEPES-pufferolt oldattal (mM-ban) végeztük: 140 NaCl, 2,5 KCl, 1 MgCl2, 1 CaCl2,10 HEPES, 10 glükóz, pH 7,4 NaOH-val. Az uniaxiális nyúlásra adott válaszként citoszolos Ca2 + -változást STREX sejt-nyújtó rendszerrel (ST-150, B-Bridge International, Inc.) végeztünk. A sejteket egyirányú 10, 20 vagy 30% -os stimulációval stimuláltuk 1 másodpercig. A citoszolos Ca2 + választ szobahőmérsékleten mértük. A Fluo-4 fluoreszcenciát az FV1000 lézeres pásztázó konfokális képalkotó rendszerrel rögzítettük és elemeztük. A citoszolos Ca2 + fluoreszcencia válasz változását a valós idejű fluoreszcencia arányában (Fx / F0) fejeztük ki, ahol Fx a valós idejű fluo-4 / AM jel és F0 az alapvonalbeli fluo-4 / AM jel nyújtás előtt. / p>
Idegaktivitás rögzítése
A patkányokat 100 mg / kg pentobarbitál-nátriummal altattuk. A nyaki területet középvonalbeli metszéssel tettük láthatóvá. A jobb nyaki artériát izoláltuk és egy katéterrel kanüláltuk, amelyet a nyomásmérőhöz (ML221, ADInstruments, USA) csatlakoztattunk a vérnyomás rögzítéséhez. A bal combcsont vénáját kanilizáltuk fenilefrin és SNP injekció céljából. A baloldali aortadepresszor ideget vagy a carotis sinus ideget egy bipoláris ezüst elektródához, majd egy erősítőhöz (1700-as modell Differenciális AC erősítő, A-M Systems Inc., USA) csatlakoztattuk. A vérnyomást és az idegaktivitást folyamatosan rögzítette az 5.0 ábra (AD Instruments). Az idegaktivitást 10 000-szer felerősítettük, és 100–5000 Hz sávszélességgel leszűrtük. Az átlagos artériás nyomás, a pulzus és a tüske gyakoriságának értékeit a fenilefrinre adott válaszként az 5.0 ábra szoftverével elemeztük. A tüske gyakoriságának változását (a tüske gyakorisága a fenilefrin után – a tüske gyakorisága a fenilefrin előtt) a fenilefrin injekció után a maximális vérnyomás változásra (átlagos artériás vérnyomás a fenilefrin után – az átlagos artériás vérnyomás a fenilefrin után) reagálva kiszámolták (Lau et al., 2016) .
Statisztikai elemzés
A reprezentatív nyomokat időbeli nyomként ábrázoltuk. Az összes kísérlet adatait oszlopdiagramba foglaltuk össze, amelyet az egyes kísérletek átlag ± félértékében fejeztünk ki. A statisztikai elemzéshez Student t-próbáját használtuk. A páros t-próbát adott esetben alkalmaztuk.
Eredmények
Aorta depressziós neuronok és carotis sinus neuronok tulajdonságai
Dil-t alkalmaztunk az aorta depressziós idegre vagy a carotis sinus idegre. Ezért a nodos ganglionban Dil-jelölt neuronok közé tartoztak az aorta ívet innerváló baroreceptor neuronok és az aorta testet innerváló kemoreceptor neuronok. Másrészt Dil-jelölt neuronok petrosalis ganglionba tartoztak a carotis sinust innerváló baroreceptor neuronok és a carotis testet innerváló chemoreceptor neuronok. Először ezen Dil-jelű neuronok alapvető tulajdonságait vizsgáltuk. A nodi és petrosalis ganglionban lévő DiI-jelölt neuronokat külön tenyésztettük és depolarizáló elektromos áramnak vetettük alá A 2. ábrán kétféle reakciót rögzítettünk, az egyik egyetlen akciós, a másik a depolarizáló áram után folyamatos akciós potenciállal reagált (ábra 2) (Belmonte és Gallego, 1983). Ezeket az idegsejteket ezután hidrosztatikus nyomásnak vetették alá, hogy teszteljék érzékenységüket a hidrosztatikus nyomás változásaira. Pozitív hidrosztatikus nyomású rámpát alkalmaztunk intracellulárisan egy üveg mikropipettán keresztül a nagysebességű nyomású bilincsrendszerrel (HSPC-1, ALA Scientific Instruments, USA) mindaddig, amíg az akciós potenciálok fel nem váltak. Az eredmények azt mutatták, hogy az aorta baroreceptor neuronok 45% -a folyamatos akciós potenciált adott a depolarizáló elektromos áramra válaszul (1A. Táblázat). Közülük 91% (41% / 45%) válaszolt a hidrosztatikus nyomásváltozásra is, és nyomásfüggő akciós potenciálú tüzeket mutatott (1A. Táblázat). Az aorta baroreceptor neuronok fennmaradó 55% -a csak egyetlen akciós potenciált adott le válaszként a depolarizáló áramra (1A. Táblázat), és közülük 40% (22% / 55%) tudott reagálni a nyomásváltozásra (1A. Táblázat). A carotis baroreceptor neuronok esetében a sejtek 45% -a adott folyamatos akciós potenciált, amikor a depolarizáló áram stimulálta őket (1B. Táblázat). Közülük 82% (37% / 45%) is érzékeny volt a nyomásváltozásra (1B. Táblázat). Ezenkívül a carotis baroreceptoros neuronok közül, amelyek csak egyetlen akciós potenciált lőttek a depolarizáló áramra válaszul, 24% (13% / 55%) válaszolhatott a nyomás változására (1B. Táblázat).
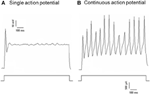
2. ábra A tenyésztett aorta depresszor és a carotis sinus neuronok akciópotenciáljának rögzítése. Megjelennek azok a cselekvési potenciálok nyomai, amelyeket két reprezentatív aorta depresszor / carotis sinus neuron rögzített depolarizáló áramra. (A) Reprezentatív neuronok, amelyek csak egyetlen akciós potenciált indítanak az aktuális stimulációra; (B) Reprezentatív neuronok, amelyek csak folyamatos akciós potenciálokat indítanak az aktuális stimulációra. Alsó panel: az áram befecskendezésének protokollja. Skála, vízszintes, 100 ms, függőleges, 10 mV (felső nyomok) és 500 pA (alsó nyomok). n = 27 és n = 38 aorta depresszor és carotis sinus neuronok esetén.

1. táblázat: Az aorta depresszor és a carotis sinus neuronok tulajdonságai.
Függetlenül attól, hogy egyetlen akciópotenciált vagy folyamatos akciós potenciált indítottak-e el, a Dil-jelölt aorta baroreceptor neuronok 63% -ánál érzékenyek voltak a nyomásváltozásra, míg a Dil-jelölt carotis baroreceptor-neuronok csak 50% -ára voltak érzékenyek. nyomásváltozás (1. táblázat).
Az aorta és a carotis baroreceptor neuronok nyújtási érzékenysége
Az akciós potenciál kisülésének nyomásküszöbét elemeztük. Amint a 3. ábra mutatja, az aorta baroreceptor neuronok alacsonyabb nyomásküszöbbel (24 ± 4 Hgmm) rendelkeztek, mint a carotis baroreceptor neuronoké (39 ± 4 Hgmm).

3. ábra: Az aorta és a carotis baroreceptor neuronok érzékenysége a hidrosztatikus nyomásra. (A, B) Felső panel, reprezentatív időbeli lefutási nyomok, amelyek szemléltetik az aorta (A) és a carotis (B) baroreceptor neuronok nyomásfüggő akciós potenciálját. A nyomás rámpát (az alsó panelt) egy mikropipetta segítségével a cellák belsejére alkalmaztuk nagysebességű nyomásbilincs-rendszer (HSPC) segítségével. A méretarány vízszintes, 1 s, függőleges, 20 mV és 20 Hgmm. (C) Összefoglaló, amely bemutatja az aorta és a carotis baroreceptor neuronokban az akciós potenciál tüzelését kiváltó nyomásküszöböt. n = 13 az aorta baroreceptor neuronoknál és n = 15 a carotis baroreceptor neuronoknál. *** p < 0,01, Student t-tesztjével.
Stretch által kiváltott Ca2 + válasz baroreceptoros neuronokban
A tenyésztett aortadepresszor vagy carotis sinus idegsejteket 10, 20 vagy 30% -os egytengelyű nyújtás a STREX Sejtnyújtó Rendszer segítségével, megkísérelve utánozni a vérnyomás alatt húzódó ereket. Az eredmények azt mutatták, hogy egy 20% -os egyiaxiális szakasz a citoszolos Ca2 + fluoreszcencia jelentős növekedését indukálta az aorta baroreceptor neuronokban, de a carotis baroreceptor neuronokban nem (4A – C. Ábra). Továbbá a Ca2 + fluoreszcencia nagysága a 30% -os uniaxiális szakaszra reagálva sokkal nagyobb volt az aorta baroreceptor neuronokban, mint a carotis baroreceptor neuronokban (4A – C. Ábra).
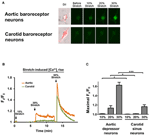
4. ábra: Az aorta depresszor és a carotis sinus idegsejtjeinek érzékenysége az egytengelyű szakaszra. A sejteket Ca2 + -érzékeny Fluo-4 / AM fluoreszcens festékkel töltöttük be. A reprezentatív képek (A) és a relatív citoszolos Ca2 + időbeli lefutásának nyomai (B) emelkednek az aorta depresszor és a carotis sinus neuronok 10, 20 és 30% -os egyiaxiális szakaszának hatására. (C) A maximális citoszolos Ca2 + emelkedés összefoglalása különböző fokú nyújtásokra adott válaszként. A citoszolos Ca2 + változását Fx / F0-ként fejeztük ki, ahol Fx az a valós idejű fluo-4 / AM jel és F0 az alapvonalbeli fluo-4 / AM jel a nyújtás előtt. Átlagos ± s.e.m. (n = 5). * p < 0.05, *** p < 0.01 a megfelelő kontrollhoz képest, páros t-teszttel.
Baroreceptor idegaktivitás in vivo
A két baroreceptor idegaktivitását in vivo vizsgálták. A fenilefrint intravénásán injektálták. A fenilefrin alkalmazásakor a vérnyomásban bekövetkezett változásokat az 5A, B ábrák felső paneljén mutatjuk be. A baroreceptor idegaktivitásának szekvenciális változásai az alsó panelen láthatók (5A., B. Ábra). A nyomás által kiváltott idegaktivitás sokkal nagyobb volt az aorta depressziós idegben, mint a carotis sinus idegben (5A, B ábra). A tüske-frekvencia / Hgmm növekedés változását az 5C. Ábra foglalja össze. Az eredmény azt mutatta, hogy az aorta baroreceptorok in vivo érzékenyebbek a hidrosztatikus nyomásra, mint a carotis baroreceptorok.
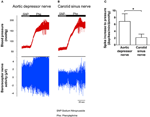
5. ábra: Baroreceptor idegaktivitás patkányokban in vivo. (A, B) Reprezentatív nyomok, amelyek az aorta depresszor ideg (A) és a carotis sinus ideg (B) aktivitásának változását mutatják a vérnyomás emelkedése esetén. Mindkét esetben (A, B) a felső panel a vérnyomás változását jelentette a Phe alkalmazása előtt és után, amelyet a vízszintes sávok jeleznek. Az alsó panel volt az idegaktivitás megfelelő változása. (C) Összefoglalt adatok, amelyek az idegaktivitás változását mutatják a vérnyomás-változás egységére vonatkoztatva. Átlagos ± s.e.m. (n = 8). * p < 0,05 az aorta baroreceptorok kontrolljához képest, páros t-teszttel.
TRP csatornák kifejezése
Számos TRP csatorna mechano-érzékeny, köztük a TRPC1, -C3, -C5, -C6, -V1, -V4, -P2 (O “Neil és Heller, 2005; Christensen és Corey, 2007; Pedersen és Nilius, 2007; Patel és mtsai, 2010; Lau és mtsai, 2016). Itt megvizsgáltuk ezen mechanoszenzitív TRP csatornák lehetséges szerepét az aortával kapcsolatban és carotis baroreceptor érzékenység. Összehasonlítottuk ezen csatornák mRNS expresszióját nodózisban és petrosalis ganglionban. Megállapítottuk, hogy a TRPV4 és a TRPC6 expressziója magasabb volt nodózus ganglionban, mint a petrosalis ganglionban (6. ábra). Lehetséges, hogy minél magasabb A mechanoszenzitív csatornák expressziója nodózus ganglionban hozzájárulhat a nagyobb érzékenységhez.
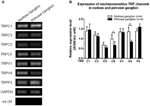
6. ábra mechanoszenzitív TRP csatornák a nodózisban és a petrosalis ganglionban. (A) Reprezentatív gélképek, összehasonlítva a mechanoszenzitív TRP csatornák (TRPC1, -C3, -C5, -C6, -V1, -V4, -P2) mRNS expressziós szintjét a nodózisos és a petrosalis ganglion neuronok között. Félkvantitatív RT-PCR analízist alkalmaztunk több TRP csatorna mRNS expressziós szintjének összehasonlításához a GAPDH mRNS expresszióhoz. 9 kísérlet eredményét a (B) részben foglaltuk össze. Az értékek átlag ± sem voltak. * p < 0,05, páros t-teszttel.
Megbeszélés
Jelen tanulmányban összehasonlítottuk az aorta és a carotis baroreceptorok mechanoszenzitív tulajdonságait. Az egész sejtes patch clamp vizsgálatok azt mutatták, hogy a carotis sinus neuronokhoz képest az aorta depresszor neuronok nagyobb százaléka volt stretch-szenzitív. Ezenkívül azt találták, hogy az aorta baroreceptor neuronokban alacsonyabb a nyomásküszöb, amely akciópotenciális tüzeket indíthat el, mint a carotis baroreceptor neuronokban. Az uniaxiális, stretch által kiváltott citoszolos Ca2 + emelkedést az aorta depresszor és a carotis sinus neuronok között is összehasonlítottuk.A citoszolos Ca2 + emelkedés nagysága az uniaxiális szakaszra reagálva sokkal nagyobb volt az aorta baroreceptor neuronokban, mint a carotis baroreceptor neuronokban. Az aorta baroreceptoros neuronok alacsonyabb küszöbértéket mutattak a citoszolos Ca2 + -válaszok iránt az egyiaxiális szakaszon. Egy másik kísérletsorozatban azt tapasztaltuk, hogy a nyomás által kiváltott akciós potenciál növekedése nagyobb volt az aorta depresszor idegében, mint a carotis sinus idegben. Adataink együttvéve erős bizonyítékot szolgáltatnak arra vonatkozóan, hogy az aorta baroreceptorok érzékenyebbek a vérnyomásra, mint a carotis baroreceptorok.
Korábban sok erőfeszítést megtettek annak érdekében, hogy megértsék a két baroreceptor érzékenységének különbségét. Az eredmények azonban ellentmondásosak. Egyes jelentések arra a következtetésre jutottak, hogy az aorta baroreceptorok érzékenyebbek a nyomásváltozásra (Glick és Covell, 1968; Fan és mtsai, 1996; Pickering és mtsai, 2008), míg mások szerint a carotis baroreceptorok érzékenyebbek a nyomásváltozásra (Donald és Edis, 1971; Fadel et al., 2003). Azonban ezeknek a korábbi vizsgálatoknak szinte mindegyike rendkívül bonyolult műtéti eljárásokat tartalmazott, és végül baroreflex válaszokat, például pulzusszámot és vese szimpatikus kimenetet használtak fel a baroreceptor érzékenységi vizsgálat végpontjaként. A bonyolult műtéti eljárások hajlamosak kísérleti hibák bevezetésére, amelyek ellentmondásos következtetéseket vonhatnak le. Ezenkívül lehetséges a baroreceptor érzékenységének állatfajtától függő változása is. Ezenkívül a baroreflex választ nemcsak a baroreceptor érzékenysége, hanem számos más tényező is befolyásolja, beleértve az idegvezetést, a központi mediációt, az erek kontraktilitását és a szívműködést. Ezért a korábbi vizsgálatok bizonyítékai közvetettek és alig ideálisak. A mai napig hiányoznak az aorta és a carotis baroreceptor neuronok nyomásérzékenységét összehasonlító közvetlen vizsgálatok. Ebben a tanulmányban a mechanoszenzitivitást közvetlenül baroreceptoros neuronokban vizsgálták. Az adatok határozottan arra utalnak, hogy az aorta baroreceptorok érzékenyebbek a nyomásra, mint a carotis baroreceptorok. Ennek az információnak fontos élettani jelentősége lehet a vérnyomás szabályozásában.
Nem világos, hogy milyen mechanizmusok alapozzák az aorta és a carotis baroreceptorok közötti nyomásérzékenység különbségét. Összehasonlítottuk több mechanoszenzitív TRP csatorna expressziós szintjét (6. ábra) (O “Neil és Heller, 2005; Christensen és Corey, 2007; Pedersen és Nilius, 2007; Patel és mtsai, 2010). Eredményeink azt mutatták, hogy az aorta baroreceptor neuronok több mechanoszenzitív TRP-csatorna expressziója magasabb, beleértve a TRPV4-et és a TRPC6-ot is. Lehetséges, hogy a TRPV4 és / vagy TRPC6 magasabb expressziója hozzájárulhat az aorta baroreceptorok magas nyomásérzékenységéhez. További vizsgálatokra van szükség ezen ioncsatornák szerepének igazolásához.
Korábban arról számoltak be, hogy a nodózus ganglion és a petrosalis ganglion két különböző típusú neuront tartalmaz (Belmonte és Gallego, 1983). Az egyikük folyamatos akciós potenciált ad az elektromos stimuláció során, míg a másik csak egyetlen akciót ad A szerzők az előbbit nyomásérzékeny neuronnak, az utóbbit pedig kemoérzékeny neuronnak rendelték. Eredményeink azt mutatják, hogy ez nem megfelelő A nyomásérzékeny idegsejteket és a nyomásérzékeny neuronokat csak annak alapján kell kijelölni, hogy a depolarizáló áramra adott válaszként egyetlen vagy folyamatos akciós potenciált indítanak-e. Valójában az elektromos stimulációra adott válaszként egyetlen akciós potenciált kibocsátó sejtek nagy százaléka szintén érzékeny a nyomásra, és így nyomásérzékelő baroreceptor neuronokhoz tartozik (2. ábra és 1. táblázat).
Összefoglalva, a jelen tanulmány bizonyítékot szolgáltat arra vonatkozóan, hogy az aorta baroreceptorok érzékenyebbek a nyomásra, mint a carotis baroreceptorok, és új információkkal egészíti ki az alapvető fiziológia megértését.
A szerző közreműködése
EL XY megtervezi a kísérleteket és elkészíti a kéziratot. EL, CL és YY végzik a kísérleteket. XY, YH, AM és LJ átdolgozták a kéziratot. Minden szerző jóváhagyta a kézirat végleges változatát.
Finanszírozás
Ezt a munkát a hongkongi kutatási ösztöndíj bizottság CUHK478710, CUHK478413, AoE / M-05/12, TBRS / T13-706 / 11, a China National Science Foundation 31470912 támogatás és az RGC-NSFC N_CUHK439 / 13 támogatás.
Összeférhetetlenségi nyilatkozat
A szerzők kijelentik, hogy a kutatást elvégezték bármilyen kereskedelmi vagy pénzügyi kapcsolat hiányában, amely potenciális összeférhetetlenségként értelmezhető.
James, a JEA és Daly, MDB (1970). Reflex vazomotoros válaszok összehasonlítása a carotis sinus és az aortaív baroreceptorainak külön és kombinált stimulációján pulzáló és nem pulzáló nyomással kutyában. J. Physiol. 209, 257–293. doi: 10.1113 / jphysiol.1970.sp009165
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
Levy MN, P. A. (2007). Kardiovaszkuláris élettan. Philadelphia, PA: Mosby Elsevier.
Vander, A. J., Sherman, J. H. és Luciano, D. S. (1998). Az emberi élettan: a test működésének mechanizmusa. Boston, MA: WCB McGraw-Hill.