ATP-molekula
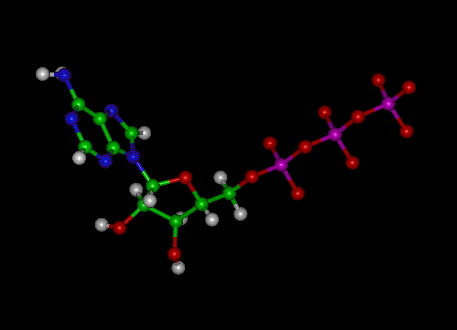
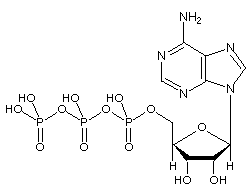
Az adenozin-trifoszfát (ATP) molekula az ismert nukleotid a biokémiában az intracelluláris energiaátadás “molekuláris pénznemeként”; vagyis az ATP képes kémiai energiát tárolni és szállítani a sejtekben. Az ATP a nukleinsavak szintézisében is fontos szerepet játszik.
A kép 3D-s felépítéséhez a JsmolClick használatával kattintson ide
Kép: Az ATP molekuláris szerkezete
Az energiát a harmadik foszfátcsoport hidrolízise szabadítja fel. Miután ez a harmadik foszfátcsoport felszabadult, a keletkező ADP (adenozin-difoszfát) képes energiát felvenni és visszanyerni a csoportot, így regenerálva egy ATP-molekulát; ez lehetővé teszi az ATP számára, hogy újratölthető akkumulátorokként tárolja az energiát.
Foszforil-pozíciók
Az AMP-vel kezdődő foszforilcsoportokat alfa-, béta- és gamma-foszfátoknak nevezzük.
Fizikai és kémiai tulajdonságok
Az ATP adenozinból áll – amely egy adeninkarikából és egy ribózcukorból áll – és három foszfátcsoportból (trifoszfát). A foszforilcsoportokat a ribózhoz legközelebb eső csoporttól kezdve alfa (a), béta (p) és gamma (y) foszfátoknak nevezzük. Következésképpen szorosan kapcsolódik az adenin nukleotidhoz, az RNS monomerjéhez. Az ATP vízben nagyon jól oldódik, és a pH 6,8 és 7,4 közötti oldatokban meglehetősen stabil, de extrém pH mellett gyorsan hidrolizálódik. Következésképpen az ATP vízmentes sóként tárolható a legjobban.
Az ATP instabil molekula a pufferolatlan vízben, amelyben ADP-vel és foszfáttá hidrolizál. Ennek oka, hogy az ATP foszfátcsoportjai közötti kötések szilárdsága kisebb, mint a hidrogénkötések (hidratációs kötések), termékei (ADP és foszfát) és a víz erőssége. Így, ha az ATP és az ADP kémiai egyensúlyban van a vízben, az ATP majdnem teljes egészében átalakul ADP-vé. Az egyensúlytól távol álló rendszer Gibbs szabad energiát tartalmaz, és képes munkát végezni. Az élő sejtek az egyensúlyi helyzetből tíz nagyságrenddel megtartják az ATP és az ADP arányát, az ATP-koncentrációk ötször nagyobbak, mint az ADP-koncentráció. Ez az egyensúlyi helyzetből való elmozdulás azt jelenti, hogy az ATP hidrolízise a sejtben nagy mennyiségű szabad energiát szabadít fel.
Két foszfoanhidrid-kötés (olyan, amely összekapcsolja a szomszédos foszfátokat) egy ATP-molekulában felelős a magas energiatartalomért ez a molekula. A biokémiai reakciók összefüggésében ezeket az anhidrid kötéseket gyakran – és néha ellentmondásos módon – nagy energiájú kötéseknek nevezik (annak ellenére, hogy a kötések megszakításához energiára van szükség). Az ATP-ben tárolt energia felszabadulhat az anhidridkötések hidrolízisével. Az ATP-molekula elsődleges foszfátcsoportja, amely hidrolizálódik, ha energiára van szükség az anabolikus reakciók elindításához, a γ-foszfátcsoport. A ribózcukortól legtávolabbi helyen található hidrolízis energiája magasabb, mint az α- vagy a β-foszfáté. A hidrolízis vagy a maradék ATP általi foszforilezése után keletkező kötések energiája alacsonyabb, mint az ATP foszfoanhidrid kötései. Az ATP enzim általi katalizált hidrolízise vagy az ATP általi foszforilezése során a rendelkezésre álló szabad energiát egy élő rendszer felhasználhatja a munka elvégzéséhez. energiát, ha a sejt koncentrációját távol tartja a reakció egyensúlyi pontjától. Azonban, mint a legtöbb polimer biomolekulánál, az RNS, a DNS és az ATP egyszerűbb monomerekké bomlását mind az energia-felszabadulás, mind az entrópia-növekedés szempontjai vezérlik, mind a standard koncentrációkban, mind pedig a sejten belüli koncentrációkban.
Az ATP hidrolíziséből felszabaduló normál energiamennyiség kiszámítható a nem természetes (normál) körülmények közötti energiaváltozásokból, majd korrigálva a biológiai koncentrációkra. A hőenergia (entalpia) nettó változása standard hőmérsékleten és nyomáson az ATP hidratált ADP-re és hidratált szervetlen foszfátra bomlásakor –30,5 kJ / mol, a szabad energia változásával 3,4 kJ / mol. A foszfát (Pi) vagy a pirofoszfát (PPi) egységnek az ATP-ből 1 M standard állapotban történő lehasításával felszabaduló energia:
ATP + H
2O → ADP + Pi ΔG ° = −30,5 kJ / mol (−7,3 kcal / mol)
ATP + H
2O → AMP + PPi ΔG ° = −45,6 kJ / mol (−10,9 kcal / mol)
Ezek az értékek az élettani körülmények közötti energia változásának és a sejt ATP / ADP arányának kiszámításához használatos. Azonban egyre inkább egy reprezentatívabb értéket vesznek figyelembe (amely az AMP-t figyelembe veszi), az úgynevezett energia díjat. A reakció Gibbs-szabad energiájára adott értékek számos tényezőtől függenek, ideértve az általános ionerősséget és az alkáliföldfém-ionok, például az Mg2 +
és a Ca2 +
jelenlétét.Tipikus sejtes körülmények között az ΔG körülbelül -57 kJ / mol (−14 kcal / mol).
Szintézis
Az ATP-t különféle sejtes folyamatokkal lehet előállítani, jellemzően mitokondriumokban oxidatív foszforilezés az ATP-szintáz katalitikus hatása alatt vagy kloroplasztikus növények esetében fotoszintézissel.
Az ATP-szintézis fő tüzelőanyagai a glükóz és a zsírsavak. Kezdetben a glükóz a citoszolban piruvátra bomlik. Minden glükózmolekulához két ATP-molekula keletkezik. Az ATP-szintézis végső szakaszait a mitokondriumban hajtják végre, és akár 34 ATP-t is képesek generálni.
ATP az emberi testben
Az ATP teljes mennyisége az emberi testben kb. 0,1 mol. A felnőttek által naponta felhasznált energia 200-300 mol ATP hidrolízisét igényli. Ez azt jelenti, hogy minden egyes ATP-molekulát 2000–3000-szer kell újrafeldolgozni a nap folyamán. Az ATP nem tárolható, ezért szintézisének szorosan követnie kell a fogyasztását.
Más trifoszfátok
Az élő sejtekben más “nagy energiájú” nukleozid-trifoszfátok is vannak, például a guanintrifoszfát. Közöttük és az ATP között az energia könnyen átvihető olyan reakciókkal, mint amilyeneket a nukleozid-difoszfokináz katalizál: Az energia felszabadul, ha a foszfát-foszfát kötések hidrolízisét végezzük. Ezt az energiát különféle enzimek, motorfehérjék és transzportfehérjék felhasználhatják a sejt munkájának elvégzésére. Ezenkívül a hidrolízis szabad szervetlen foszfátot és adenozin-difoszfátot eredményez, amelyek tovább bonthatók egy másik foszfát-ionra és adenozin-monofoszfátra. Az ATP közvetlenül adenozin-monofoszfáttá is bontható pirofoszfát képződésével. Ennek az utolsó reakciónak az az előnye, hogy hatékonyan irreverzibilis folyamat vizes oldatban.
ADP reakciója GTP-vel
ADP + GTP > ATP + GDP