Az immunológia határai
Bevezetés
A preeclampsia egy terhesség-specifikus betegség, amely az összes terhesség 3-5% -át érinti (1, 2). 20 hetes terhesség és proteinuria után újonnan megjelenő magas vérnyomás jelentkezik. A placenta központi szerepet játszik a betegség patogenezisében azáltal, hogy az anyát összekapcsolja a magzattal (3). Az anyai-magzati határfelület az a zóna, ahol genetikailag különböző, magzati eredetű szövet találkozik az anyai keringéssel, az endotheliummal és az immunrendszerrel. Gyakran elméletek betegségének nevezik, az egyik általánosan elfogadott felismerés az, hogy a preeclampsia az anya endotheliumát érinti, zavart okozva az endothelium működésében, ami magas vérnyomáshoz és proteinuriahoz vezet (2). Súlyos formájában a preeclampsia a magzat növekedésének retardációjához, koraszülöttségéhez vezethet, és az anya számára a vese és a máj szervi elégtelenségét, valamint az eklampsiát okozhatja. Ezenkívül a preeclampsia hosszú távon káros kardiovaszkuláris következményekkel járhat az anya és az újszülött számára (4). A méhlepény kialakulását kifejezetten az anyai spirális artéria átalakulásának folyamatában tartják elégtelennek, amikor a trofoblaszt sejtek az anyai oldalt deciduákká invázálják, az artériákat pedig alacsony ellenállású vezetékekké alakítják, helyettesítve az anyai endotheliumot is (5–7). Tipikusan a méhartériák ilyen átalakulása hiányzik vagy hiányos, különösen súlyos preeclampsia esetén. A szűkült méhartériákban a nagy ellenállás turbulens véráramlást okoz a placenta intervillus térében, ami oxidatív stresszt és mechanikus károsodást okoz a placenta villous fáin. Az eredő károsodás megnöveli a mikrorészecskék és a gyulladásos mediátorok placentás leadását, ami általános endothel aktivációt és diszfunkciót eredményez (8, 9). Ezek a szekvenciális események az anya-magzat interfészen az anya magas vérnyomásához és egyéb, a fentiekben leírt tünetekhez vezetnek.
A HELLP-szindrómát először Weinstein jellemezte 1982-ben, mint különálló szindrómát, amely gyakran a preeclampsia mellett jelent, de önmagában is (10, 11). A HELLP szindrómát a hemolízis, a megemelkedett májenzimek és alacsony vérlemezkeszám jellemzi. Gyakran intenzív ellátási szintű megfigyelést és tüneti terápiát igényel. A szindróma patogenezise még mindig árnyékban van. A HELLP-szindróma közös jellemzőkkel rendelkezik a trombotikus mikroangiopátiákkal (TMA), például a trombotikus trombocitopéniás purpurával (TTP) és a hemolitikus urémiás szindrómával (HUS). A TMA-k a betegségek különféle csoportjában vannak, a mikroangiopátiás hemolízis, a trombocitopénia és a mikrotrombusokból eredő szervkárosodások közös jellemzőivel. A TTP-ben az 1. típusú trombospondin motívummal (ADAMTS13), az aktivált von Willebrand-faktort (vWF) hasító enzim, szétesett és metalloproteináz elleni autoantitestek genetikai hibája – vagy az esetek túlnyomó többségében – szokatlanul nagy képződést okoz aktivált vWF multimerek az endothelsejteken, ami thrombocyta trombushoz vezetnek a kis erekben és hemolízis. A tipikus HUS-t a Shiga-toxint termelő bakteriális fertőzés (különösen az Escherichia coli) okozza, míg az atipikus HUS (aHUS) a TMA típusára utal, amelyben a komplement rendszer alternatív útjának szabályozóiban genetikai hiányosságok állnak, amelyek egy kiváltó tényező okozhatja a klinikai betegséget (12, 13). Az FDA által az aHUS által jóváhagyott kezelés a C5 komplement antagonista eculizumab infúziója, amely megakadályozza a membrán támadási komplex (MAC) kialakulását (1. ábra). Klinikailag a HELLP ugyanazokkal a tünetekkel rendelkezik, mint a klasszikus TMA-k: hemolízis, thrombocytopenia és a májban észlelt szervi rendellenességek. Az alkalmazott TMA besorolástól függően a HELLP-szindrómát általában másodlagos vagy megszerzett TMA-k részeként kategorizálják (1. táblázat).
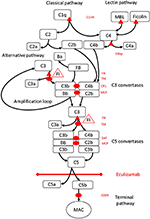
1. ábra. Az eculizumab gátolja a komplement aktiváció terminális útját. A komplement aktiválást három aktiválási útvonalon keresztül lehet elindítani, amelyek mind olyan C5 konvertázok kialakulásához vezetnek, amelyek képesek aktiválni a terminális utat, ami a MAC kialakulásához vezet a célfelületen. A komplementrendszer ezen sematikus ábrája mutatja a legrelevánsabb aktivátorokat (fekete betűvel) és inhibitorokat (piros színnel). Az aktivátorok lehetnek membránhoz kötöttek (oválisak) vagy oldhatóak (háromszögek). Az alternatív út spontán aktiválódik minden olyan felületen, amely nem teszi lehetővé az oldható H szabályozó faktor (FH) gátlását. Az FH kofaktorként működik a C3b és az iC3b inaktiválásában az I (FI) faktor által. A trombomodulin (TM) fokozza az FH kofaktor aktivitását. A hasított B faktor (FB) a C3b aktivátorral együtt alkotja az alternatív útkonvertázt, amely képes C3 hasítására C3b-be, létrehozva egy alternatív útaktivációs amplifikációs hurkot.A komplement aktiválás klasszikus útját meg lehet indítani például az immun komplexek C1q-hez való kötésével, míg a lektin útját a mannózokhoz kötődő lektin (MBL) vagy a fikolinek aktiválják, például a mikrobák szénhidrátmintáihoz kötődve. A lektin út aktiválása azt eredményezi, hogy az 1. és a 2. mannózzal társított szerin proteázok (MASP-1 és MASP-2, a képen nem látható) hasítják a C4 és C2 komplementkomponenseket a klasszikus útvonal-konverzió C4bC2b képződéséhez. A C1 inhibitor (C1inh) és a C4bp a klasszikus út oldható szabályozói, míg a membrán kofaktor fehérje (MCP) és az 1. komplement receptor (CR1) a korai komplement útvonalak membránhoz kötött szabályozói. A C5 konvertázok képződése megindítja a komplement aktiválás és a C5 hasításának terminális útját a felülethez kötött szabályozók bomlást gyorsító tényezője (DAF) és MCP hiányában. A MAC összeállítását a felülethez kötött CD59 szabályozó (protektin) szabályozza. A C3 hasítása a korai útvonalakban és a C5 a terminális útvonalban felszabadítja a C3a és C5a anafilatoxinokat, és gyulladást eredményez. Az eculizumab egy humanizált rekombináns antitest a C5 komplement fehérjével szemben, amely gátolja a C5 hasítását a C5 konvertázok által, ezáltal szabályozza a komplement aktiváció protrombotikus és gyulladásos hatásait. Az ebben az esettanulmányban leírt beteget genetikai mutációkkal tesztelték a H faktort (CFH), FHR5 és MCP, CFI, CFB, THBD és ADAMTS13 (ADAMTS13) kódoló génekben, amelyek a koagulációs kaszkád vWF útvonalának szabályozói (nem Látható). A genetikai teszt eredménye negatív volt.

1. táblázat: HELLP és aHUS diagnosztikai kritériumok.
Ebben az esettanulmányban egy bonyolult terhesség által kiváltott TMA-ban szenvedő beteg és a sikeres kezelés.
Esetismertetés
Huszonkilenc éves primigravidát 34 + 2 terhességi korban utaltak a Helsinki Egyetem kórházába ambuláns rendelőintézet felső hasi fájdalommal. Kezdetben a vérnyomása szerényen megemelkedett (133/91 Hgmm), és a vizelet szintmérője pozitív volt a fehérje szempontjából. Az eredetileg jelentett felső hasi fájdalom fokozatosan javult. Az ultrahang vizsgálat során a magzat normális biofizikai profilú (BPP) volt, a súly becslése a -2 SD növekedési görbén volt. A kardiotokográfia (CTG) normális volt. A vér hemoglobin (Hb) értéke 115 g / L, a vérlemezkék 158 E9 / L (normális tartomány 150-360 E9 / L), az alanin-aminotranszferáz (ALT) normális (23 U / L). A vizeletszintmérő pálca pozitív volt a fehérje szempontjából (+2), és a számított proteinuria 1,6 g / 24 óra volt. Döntés született a kortizon kezelés megkezdéséről a csecsemő tüdő érésének megkönnyítése érdekében. A beteget azzal a tervvel bocsátották ki, hogy másnap visszatérjen a kontrollvizsgálatra és a kortizon második adagjára. A tervek szerint a 34 + 4-es terhességi héten jött kontrollra. A vérnyomás 147/87 Hgmm, ALT 23, 177 vérlemezke, CTG volt, és a magzat BPP-je normál volt. Kiengedték, és újabb ellenőrzést terveztek. Ugyanezen nap délutánján a felső gyomorfájdalom visszatért és estére folyamatosan súlyosbodott. Hajnali 2 óra 20 perckor tért vissza a kórházba. Feszes felső hasi fájdalmat, nyugtalanságot tapasztalt, kétszer hányt és remegést érzett. A vérnyomás egyértelműen megemelkedett 170/94 Hgmm-nél, a vizeletfehérje-mérőpálca erősen pozitív volt, az ALT 159-nél, Hb 122-nél és a vérlemezkéknél 172-nél magasabb volt. Felvették a prenatális osztályra. Hajnali 4 órakor fejfájást szenvedett. Megkezdték a vérnyomáscsökkentő gyógyszeres kezelést (Labetalol 100 mg háromszor). A vizeletfehérje-kiválasztás az éjszakában tetőzött, 13 g / 24 óra volt. Ezt követően hányni kezdett, felső hasi fájdalmai, fejfájása volt, és a CTG monitorozása lassulásokat mutatott. A beteget reggel 7.11-kor szállították át a szülőosztályra, és mivel a méhnyak három centiméterrel tágult, a magzat membránját mesterségesen eltörték a vajúdás kiváltása érdekében. Ugyanakkor a laboratóriumi vizsgálatokat Hb 122-gyel, 172-es vérlemezkékkel fejezték be. A laktát-dehidrogenáz (LD) azonban ebben az időben egyértelműen megemelkedett 1231 U / L-nél. A CTG-ben a lassítások folytatódtak, és ahogy a bradycardia folytatódott, sürgősségi császármetszést hajtottak végre. Hím csecsemő (1960 g, -2 SD) reggel 7.25-kor született, a köldökartér pH-értéke 7,05, BE -6,80, Apgar 1/6/8. A műtét során a vérveszteség 400 ml volt.
A császármetszés után 9 órakor az anya vérlemezkéje 49-nél alacsony volt, a Hb értéke 102 volt. Délutánra az ALT 1800-ra emelkedett, LD 3570 , a szérum kreatininszint 153 (μmol / L) volt, míg a vérlemezkék 33-ra csökkentek. Alacsony fibrinogénszint (1,1 g / l, referenciaértékek 2–4 g / l) és magas D a fibrin dimere (30,2 mg / l, < 0,5 mg / l). A császármetszéses sebből vérzés következett be, amelybe további varratok kerültek.Ekkor nyolc egység vérlemezkét adtak be. A káliumszint 4,7-ről 5,6-ra (mmol / l) emelkedett. A hemolízist egyértelműen megfigyelték. Coombs-teszt negatív volt. A vizelet kiválasztása csak 10 ml / h volt. A laboratóriumi vizsgálat egyértelműen súlyos betegséget mutatott, a vesék és a máj károsodásának jeleivel. Ezen túlmenően a koagulációs rendszerben jelentős a véralvadás és a markáns fibrinolízis egyidejű zavarai voltak. A magnézium-szulfát infúziót a hyperreflexia miatt kezdték el, amelyet a görcsök prediktív jeleinek tekintenek, ami a preeclampsia súlyos szövődménye. 10 mg intravénás dexametazont kezdtek el, és a beteget az intenzív osztályra (ICU) vitték át.
Továbbá laboratóriumi vizsgálatokat is kiadtak más orvosi vészhelyzetek differenciáldiagnosztikai céljaira (2. táblázat). Az ADAMTS13 aktivitása normális volt 62% (40–130%), ami kizárja a TTP-t. A szérum komplement-C3 (0,52 g / L, 0,71–1,41 g / L) és a C4 (0,07 g / L, 0,12–0,34 g / L) szint alacsony volt. A komplement komplex oldható terminális komplexének szintje (C5b-9, 971 ng / ml, < 366 ng / ml) emelkedett az első szülés utáni napon. Antifoszfolipid antitesteket nem mutattak ki, a hepatitis B és C fertőzés szerológiai vizsgálata, valamint a HIV negatív volt. A székletmintából a tipikus HUS-t okozó kórokozók negatívnak bizonyultak.

2. táblázat: A betegség diagnosztizálásának és kezelésének ütemterve.
A beteget a szülés utáni első és második napon plazmacsere-kezeléssel kezelték. és háromszor hemodializálták a kezelése során (a szülés utáni 2., 4. és 6. napon).
A szülés utáni harmadik napon a beteg stabil volt, és visszahelyezték a női kórház helyreállítási szobájába. és a tüneti terápiát folytatták. A magas vérnyomást naponta kétszer 10 mg amlodipinnel és naponta háromszor 200 mg labetalollal kezelték. A negyedik szülés utáni napon a vérlemezkék száma folyamatosan csökkent, és a beteget aHUS diagnosztizálták. Gyakran a differenciáldiagnózis HELLP szindrómával és Az aHUS a HELLP betegek spontán gyógyulásában rejlik, általában a szülés utáni harmadik napon.Ekulizumabbal kezdték a kezelést (900 mg IV.) pneumococcus elleni védőoltást kaptak, és profilaktikus antibiotikumot (penicillint) kezdtek el. A beteg összesen négy heti eculizumab-adagot (900 mg) kapott, és gyorsan gyógyulni kezdett. A hatodik szülés utáni harmadik hemodialízis után nem volt szükség további hemodialízisre (2. ábra). A vese funkciója fokozatosan korrigálódott, a vérlemezkeszám emelkedett és a hemolízis megoldódott. Négy héttel a szülés után a C3 és C4 plazmaszintje normalizálódott.
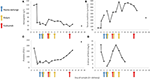
2. ábra: A betegség korai szakaszában megfigyelt kiválasztott laboratóriumi értékek, valamint a plazma csere, a hemodialízis és az eculizumab beadásának időzítése. Az (A) panelen a vér hemoglobin mérésének alakulása, a (B) panelen a szérum kreatinin szint, a (C) panelen a vérlemezkék száma és a (D) panel a fibrin értékek D-dimerje a 17 nap alatt követési időszak.
A genetikai tesztelés során nem ismertek ismert génpolimorfizmusokat. H-faktor (CFH), a H-hez kapcsolódó fehérje 5 (FHR5) és a membrán ko-faktor fehérje (MCP) mutációit tesztelték, alternatív útvonal-inaktivátor faktor I (CFI), alternatív út-aktivátor B faktor (CFB) ), és a koagulációs kaszkád következő komponensei: ADAMTS13, trombomodulin (THBD) és egy intracelluláris enzim, a diacilglicerin-kináz E (DGKE), amelynek mutációi az aHUS ismert okai (14). Ezenkívül a H faktor elleni antitesteket sem mutatták ki. C4 hiányt nem sikerült kimutatni. Bár az aHUS genetikai vizsgálata negatív maradt, a betegség klinikai lefolyása (különösen súlyos akut vesekárosodás) és a kezelésre adott válasz (különösen az eculizumab) arra utal, hogy betegünk terhesség okozta aHUS volt.
Megbeszélés
A fent leírt primigravidát súlyos preeclampsia, HELLP szindróma és terhesség okozta aHUS diagnosztizálták. Nem ismertek olyan génmutációkat, amelyek hajlamosak lehetnek az aHUS-ra. Fontos a differenciáldiagnózis a TMA, TTP, HUS / aHUS és másodlagos TMA típusok között. Különösen a TTP-t kell korán azonosítani, mivel a betegséget gyors napi plazmacserével kezelik a remisszióig (15).
Jelenleg az aHUS-t potenciálisan kiváltó genetikai mutációk tesztelésére szolgáló laboratóriumi analitikai módszerek mutációt csak az aHUS esetek 40–60% -a, megengedve a hamis negatív esetek lehetőségét. Ezért a mutációk negatív vizsgálati eredménye nem zárja ki a valódi aHUS-t (16).Ritkán az aHUS-t indukálták terhesség és szülés után. Ezekben az esetekben a következő három évben ~ 50% -ban krónikus vesebetegség (CKD), egyesek még a végstádiumú vesebetegség (ESKD) is kialakult. Amikor genetikai mutációkat figyeltek meg, akár 85% -nál is kialakulhat CKD vagy ESKD (17).
Általánosan elfogadott, hogy a terhesség magas vérnyomású rendellenességeiben a placenta gyulladása endothel diszfunkciót eredményez. Ha az endothelium integritását megzavarják, ez a komplement aktiválódását és koagulációját eredményezi (18). Feltételezik, hogy a megzavart anyai endothelium hozzájárulhat a súlyos preeclampsia és más magas vérnyomású terhességi rendellenességek társuló későbbi életében bekövetkező anyai morbiditáshoz (2, 19). Kimutatták, hogy a sérült endothelium még a kezdeti diagnosztikai tünetek enyhülése után is rendellenesen működik (20–23).
A HELLP betegek akár 46% -ában is leírtak génmutációkat az alternatív út szabályozóiban a komplementrendszer (24, 25). A terhesség korai szakaszában, amikor a méhlepény fejlődik, a komplement rendszer aktiválása a szérum Bb-szintjének emelkedésében figyelhető meg azoknál a betegeknél, akiknél később preeclampsia alakult ki (26). A komplementrendszer aktiválódását figyelték meg súlyos preeclampsia és HELLP szindróma esetén, és a súlyos preeclampsiaban szenvedő betegek vizeletében emelkedett terminális komplexszintet (C5b-9) detektáltak. HELLP-szindrómás betegeknél a komplementrendszer fokozott aktiválódását funkcionális teszt, valamint a CD55 és CD59 expressziójának hiányosságai mutatták ki, ami a szabályozás csökkenéséhez és a komplementrendszer aktivációjának súlyosbodásához vezetett (27–29).
A HELLP-szindróma és az aHUS között sok hasonlóság van. Mindkét esetben egyértelműen érintett az endothelium zavar, majd a komplement és a koaguláció aktiválása következik be. Súlyos preeclampsia és HELLP-szindróma esetén a súlyos betegség és a TMA korai tüneteinél adott eculizumab hasznos lehet a vesék és az anyai endothelium védelmében (30). Az endothel integritásának megőrzése potenciálisan megvédheti a beteget a hosszú távú egészségügyi kockázatoktól, például a szív- és érrendszeri betegségektől. Jellemzően a terhességgel összefüggő TMA-kban a hemolízis és a trombocitopénia klinikai eredményei ~ 3 nap alatt megszűnnek. Ha a betegség aktivitása hosszabb ideig tart, akkor folytatni kell a differenciáldiagnosztikát, és csak ezután mérlegeljük az alternatív kezelést (pl. Eculizumab). Az eculizumab-kezelés korábbi bevezetése a nők számára előnyös lenne, ha megakadályoznák a vesekárosodást és minimalizálnák az endothelium turbulenciáját és a szisztémás gyulladást. Az eculizumab elég korán és egy vagy két dózisban adva elegendő lehet a turbulencia megállításához, és elegendő az események kaszkádjának megállításához (31). Egyrészt az eculizumab nagyon drága gyógyszer, másrészt az intenzív terápiás kezelés, a plazmacsere, a hemodialízis, az esetleges veseátültetés költségei, nem beszélve az anyák és a családok érzelmi következményeiről, továbbra is felbecsülhetetlenek.
Összefoglalásként elmondható, hogy betegünk súlyos betegségben szenvedett, hemolízist, az alvadási rendellenességet, májkárosodást és veseelégtelenséget szenvedett, ezért be kellett lépni az ICU-ra és a hemodialízisre. Lehetséges, hogy az eculizumab, ha korábban, a HELLP-szindróma első jeleinél kezdődik, hasznos lehet a betegség későbbi lefolyása során, potenciálisan enyhítheti a vesekárosodást, és így megakadályozhatja a hemodialízis és a későbbi CKD szükségességét. Ezért a modern immunológiai orvoslás ezen korszakában tehetnénk-e többet az anyák és a családok érdekében, mint hogy csak várjunk és reméljük a legjobbat?
Etikai nyilatkozat
Az etikai felülvizsgálat és jóváhagyás nem volt szükséges a résztvevők emberi vizsgálatához a helyi jogszabályoknak és az intézményi követelményeknek megfelelően. A betegek / résztvevők írásos beleegyezésüket adták a részvételhez ebben a tanulmányban.
Szerzői közreműködés
Az AL és a JH-E kidolgozta az ötletet a kézirat számára, és megírta a kéziratot. A JH-E és az MH részt vett a beteg diagnosztikai és terápiás ellátásában. Minden szerző átnézte és szerkesztette a kéziratot, és jóváhagyta annak végleges változatát közzétételre.
Összeférhetetlenség
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhető.
4. Hauspurg A, Ying W, Hubel CA, Michos ED, Ouyang P. Kedvezőtlen terhességi kimenetel és jövőbeni anyai szív- és érrendszeri betegségek. Clin Cardiol. (2018) 41: 239–46. doi: 10.1002 / clc.22887
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
5. Brosens I, Pijnenborg R, Vercruysse L, Romero R. The ” nagy szülészeti szindrómák “a mély placentáció rendellenességeivel társulnak. Am J Obstet Gynecol. (2011) 204: 193–201. doi: 10.1016 / j.ajog.2010.08.009
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
8. Germain SJ, Sacks GP, Soorana SR, Sargent IL, Redman CW . Szisztémás gyulladásos primer normál terhesség és preeclampsia esetén: a keringő syncytiotrophoblast mikrorészecskék szerepe. J Immunol. (2007) 178: 5949–56. doi: 10.4049 / jimmunol.178.9.5949
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
9. Tannetta D, Masliukaite I, Vatish M, Redman C, Sargent I A syncytiotrophoblast eredetű extracelluláris vezikulák frissítése normál terhesség és preeclampsia esetén. J Reprod Immunol. (2017) 119: 98–106. doi: 10.1016 / j.jri.2016.08.008
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
10. Weinstein L. hemolízis szindróma, megemelkedett májenzimek és alacsony vérlemezke szám: a terhesség magas vérnyomásának súlyos következménye. Am J Obstet Gynecol. (1982) 142: 159–67. doi: 10.1016 / S0002-9378 (16) 32330-4
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
15. Pourrat O, Coudroy R, Pierre F. A súlyos HELLP-szindróma megkülönböztetése és a trombotikus mikroangiopathia, a trombotikus thrombocytopeniás purpura és más utánzók. Eur J Obstet Gynecol Reprod Biol. (2015) 189: 68–72. doi: 10.1016 / j.ejogrb.2015.03.017
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
20. Agatisa PK, Ness RB, Roberts JM, Costantino JP, Kuller LH , McLaughlin MK. Preothlampsia kórtörténetében szenvedő nők endotheliális funkciójának károsodása: a kardiovaszkuláris kockázat mutatója. Am J Physiol Hear Circ Physiol. (2004) 286: 1–3. doi: 10.1152 / ajpheart.00298.2003
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
22. Kvehaugen AS, Dechend R, Ramstad HB, Troisi R, Fugelseth D , Személyzet AC. A preeclampsia után nőknél és gyermekeknél zavart az endoteliális funkció és a keringő biomarkerek. Magas vérnyomás. (2011) 58: 63–9. doi: 10.1161 / HYPERTENSIONAHA.111.172387
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
23. Stanhewicz AE. Maradt vaszkuláris diszfunkció olyan nőknél, akiknek kórtörténetében preeclampsia volt. Am J Physiol Regul Integr Comp Physiol. (2018) 315: R1062 – R71. doi: 10.1152 / ajpregu.00204.2018
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
25. Vaught AJ, Braunstein EM, Jasem J, Yuan X, Makhlin I , Eloundou S, et al. A komplement alternatív útvonalában a germin mutációk hajlamosak a HELLP szindrómára. JCI betekintés. (2018) 3: 0–13. doi: 10.1172 / jci.insight.99128
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
31. Elabd H, Elkholi M, Steinberg L, Acharya A. Eculizumab, a preeclampsia / HELLP szindrómával járó akut vesekárosodás újszerű kezelési módja. BMJ Case Rep. (2019) 12: e228709. doi: 10.1136 / bcr-2018-228709
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós