Ciklohexán molekula
A ciklohexán egy C6H12 molekulaképletű cikloalkán. A ciklohexánt nem vegyi oldószerként használják a vegyiparban, valamint nyersanyagként adipinsav és kaprolaktám ipari előállításához, amelyek mindkettő intermedierek a nylon gyártásában. Ipari méretekben a ciklohexánt úgy állítják elő, hogy a benzolt hidrogénnel reagáltatják. Egyedülálló kémiai és konformációs tulajdonságai miatt a ciklohexánt a laboratóriumokban elemzésként és standardként is használják.
Ciklohexán molekula a Jsmol segítségével lásd – 3D szerkezetekhez
A ciklohexán szerkezete Molekula
A 6 csúcsú gyűrű nem felel meg a tökéletes hatszög alakjának. A lapos 2D sík hatszög konformációja jelentős szögfeszültséggel rendelkezik, mivel kötései nem 109,5 fokosak; a torziós igénybevétel is jelentős lenne az összes elhomályosult kötődés miatt. Ezért a torziós igénybevétel csökkentése érdekében a ciklohexán háromdimenziós szerkezetet alkalmaz, amelyet székkonformációnak neveznek. Az új konformáció a széneket 109,5 ° -os szögbe helyezi. A hidrogének fele a gyűrű síkjában van (ekvatoriális), míg a másik fele merőleges a síkra (axiális). Ez a konformáció lehetővé teszi a ciklohexán legstabilabb szerkezetét. Van még egy ciklohexán konformáció, hajó konformáció néven ismert, de ez átalakul a kissé stabilabb szék formációvá. Ha a ciklohexán monoszubsztituált egy nagy szubsztituenssel, akkor a szubsztituens valószínűleg egyenlítői helyzetben található, mivel ez a kissé stabilabb konformáció.
A ciklohexán szöge és torziós alakváltozása a legalacsonyabb. az összes cikloalkán, ennek eredményeként a ciklohexánt 0-nak tekintik a teljes gyűrűtörzsnek, amely a szög és a torziós alakváltozás kombinációja. Ez a ciklohexánt is a cikloalkánok közül a legstabilabbá teszi, ezért égetve a legkevesebb hőt termeli a többi cikloalkánnal összehasonlítva.
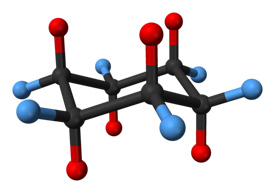
Ciklohexán molekula a szék kialakításában. Az axiális helyzetben lévő hidrogénatomok piros színnel, míg az egyenlítői helyzetűek kék színnel jelennek meg.
Reakciók ciklohexánnal
A tiszta ciklohexán önmagában meglehetősen nem reagál, mivel nem poláros, hidrofób szénhidrogén. Nagyon erős savakkal képes reagálni, például a HF + SbF5 szupersavrendszerrel, amely erőltetett protonációt és “szénhidrogén-repedést” okoz. A helyettesített ciklohexánok azonban különböző körülmények között reaktívak lehetnek, amelyek közül sok fontos a szerves kémia szempontjából. A ciklohexán fokozottan tűzveszélyes.
Ciklohexán-származékok
A funkcionális csoportok speciális elrendezése a ciklohexán-származékokban, sőt a legtöbb cikloalkán-molekulában rendkívül fontos a kémiai reakciókban, különösen a nukleofileket érintő reakciókban. A gyűrű szubsztituenseinek tengelyirányú képződésben kell lenniük, hogy reagálni tudjanak más molekulákkal. Például a bróm-ciklohexán és egy közönséges nukleofil, egy hidroxid-anion reakciója ciklohexént eredményez. az axiális képződésben, szemben egy másik axiális H atom reakciójával. Feltételezve, hogy a bróm-ciklohexán megfelelő reakcióban van, az E2 reakció ilyen formában kezdődik:
- A C-Br közötti elektronpár-kötés Br felé halad, Br’-t alkotva és beállítva. ciklohexántól mentes
- A nukleofil (-OH) elektronpárt ad a szomszédos axiális H-nak, H-t szabaddá téve és kötődve hozza létre a H2O-t
- Az elektronpár kötődik a szomszédos között az axiális H a két CC közötti kötésre mozog, így C = C
Megjegyzés: Mindhárom lépés egyidejűleg történik, jellemző az összes E2 reakcióra.
A fenti reakció többnyire E2 reakciókat generál, és ennek eredményeként a termék többnyire (~ 70%) ciklohexén lesz. A százalék azonban a körülményektől függően változik, és általában két különböző reakció (E2 és Sn2) versenyez. A fenti reakcióban egy Sn2 reakció helyettesíti a brómot egy hidroxil (OH-) csoporttal, de a Br-nek ismét axiálisnak kell lennie a reakcióhoz. Amint az SN2 szubsztitúció befejeződött, az újonnan helyettesített OH csoport gyorsan (~ 1 milliszekundum) visszalendül a stabilabb egyenlítői helyzetbe. Használat
Kereskedelmi szempontból az előállított ciklohexán nagy része katalitikus úton átalakul ciklohexanon-ciklohexanol keverékké oxidáció. A KA olajat ezután az adipinsav és a kaprolaktám nyersanyagaként használják. Gyakorlatilag, ha a KA-olaj ciklohexanoltartalma magasabb, mint a ciklohexanon, akkor valószínűbb (gazdaságosabb) átalakulni adipinsavvá, és fordított esetben a kaprolaktám-termelés valószínűbb. A KA olaj ilyen arányát megfelelő oxidációs katalizátorok kiválasztásával lehet szabályozni. A ciklohexán egy részét szerves oldószerként használják.
Ciklohexán a kutatásban
Bár erről a ciklikus szénhidrogénről már sok minden ismert, a ciklohexán és benzol keverékein, valamint a szilárd fázisú ciklohexánon még mindig folynak kutatások a keverék hidrogénhozamának meghatározására besugárzással 195 ° C-on.
Előzmények
Az olyan vegyületekkel ellentétben, mint a benzol, a ciklohexán nem könnyen nyerhető olyan természeti erőforrásokból, mint a szén. A 19. század vége felé a korai kémiai kutatóknak a szerves szintézistől kellett függeniük. 30 évbe tellett a részletek kidolgozása. 1867-ben Marcellin Berthelot magas hőmérsékleten jódhidrogén-savval redukálta a benzolt. Helytelenül határozta meg a reakcióterméket n-hexánnak, nem csak a forráspont (69 ° C) megfelelő illeszkedése miatt, hanem azért is, mert nem gondolta, hogy a benzol ciklikus molekula (például korabeli August Kekule), hanem valamiféle asszociáció acetilén. 1870-ben egyik szkeptikusa, Adolf von Baeyer megismételte a reakciót, és kimondta ugyanazt a reakcióterméket, hexahidrobenzolt, és 1890-ben Vladimir Markovnikov úgy gondolta, hogy képes ugyanazt a vegyületet desztillálni a kaukázusi ásványolajból, főzetét hexanaphténnek nevezve.
1894-ben Baeyer szintetizált ciklohexán a pimelsav Dieckmann-kondenzációjával kezdve, majd többszörös redukcióval. és ugyanabban az évben E. Haworth és W.H. Perkin Jr. (1860 – 1929) ugyanezt tette az 1,6-dibromohexán Wurtz-reakciójában. Meglepő módon ciklohexánjaik 10 ° C-kal magasabb hőmérsékleten forrtak, mint a hexahidrobenzol vagy a hexanaftein, de ezt a rejtvényt 1895-ben Markovnikov, NM Kishner és Nikolay oldotta meg. Zelinsky amikor a hexahidrobenzolt és a hexanaftént metilciklopentánként diagnosztizálták, ami egy váratlan átrendeződés eredménye.