Fizikai geológia
A Föld kérgének kőzeteit alkotó ásványok döntő többsége szilikátásvány. Ide tartoznak az olyan ásványi anyagok, mint a kvarc, a földpát, a csillám, az amfibol, a piroxén, az olivin és a sokféle agyagásvány. Mindezen ásványok építőköve a szilícium-dioxid-tetraéder, négy oxigénatom és egy szilícium atom kombinációja. Ezek úgy vannak elrendezve, hogy az oxigénatomokon keresztül húzott síkok tetraédert képeznek (2.6. Ábra). Mivel a szilíciumion töltése +4, és mind a négy oxigénion töltése –2, a szilícium-dioxid-tetraéder nettó töltése –4.
A szilikát ásványokban ezek a tetraéderek el vannak rendezve. és különféle módon kapcsolódnak egymáshoz, az egyes egységektől a komplex keretekig (2.9. ábra). A legegyszerűbb szilikátszerkezet, az ásványi olivin szerkezete, izolált tetraéderekből áll, amelyek vas- és / vagy magnéziumionokhoz vannak kötve. Az olivinben az egyes szilícium-dioxid-tetraéderek –4 töltését két kétértékű (azaz +2) vas- vagy magnézium-kation kiegyensúlyozza. Az olivin lehet Mg2SiO4 vagy Fe2SiO4, vagy a kettő valamilyen kombinációja (Mg, Fe) 2SiO4. A magnézium és a vas kétértékű kationjai sugara meglehetősen közel van (0,73 versus 0,62 angström). E méret-hasonlóság miatt, és mivel mindkettő kétértékű kation (mindkettő töltése +2), a vas és a magnézium könnyen helyettesítheti egymást az olivinben és számos más ásványi anyagban.
| Tetraéder konfiguráció | Példa ásványok | |
|---|---|---|
 |
Elszigetelt (nemszilikátok) | Olivin, gránát, cirkon, kianit |
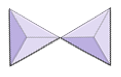 |
Párok (szoroszilikátok) | Epidote, zoizit |
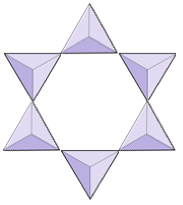 |
Gyűrűk (cikloszilikátok) | Turmalin |
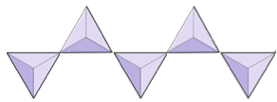 |
Egyetlen lánc (inzilikátok) | Piroxének, wollastonit |
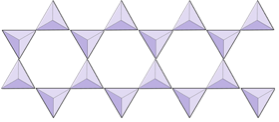 |
Kettős láncok (inzilikátok) | Amfibolák |
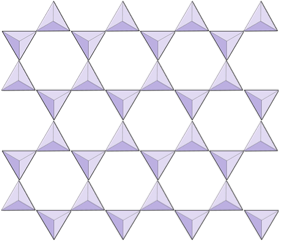 |
Lapok (filoszilikátok) | Micák, agyagásványok, szerpentin, klorit |
| 3-dimenziós felépítés | Keret (tektoszilikátok) | Pillangók, kvarc, zeolit |
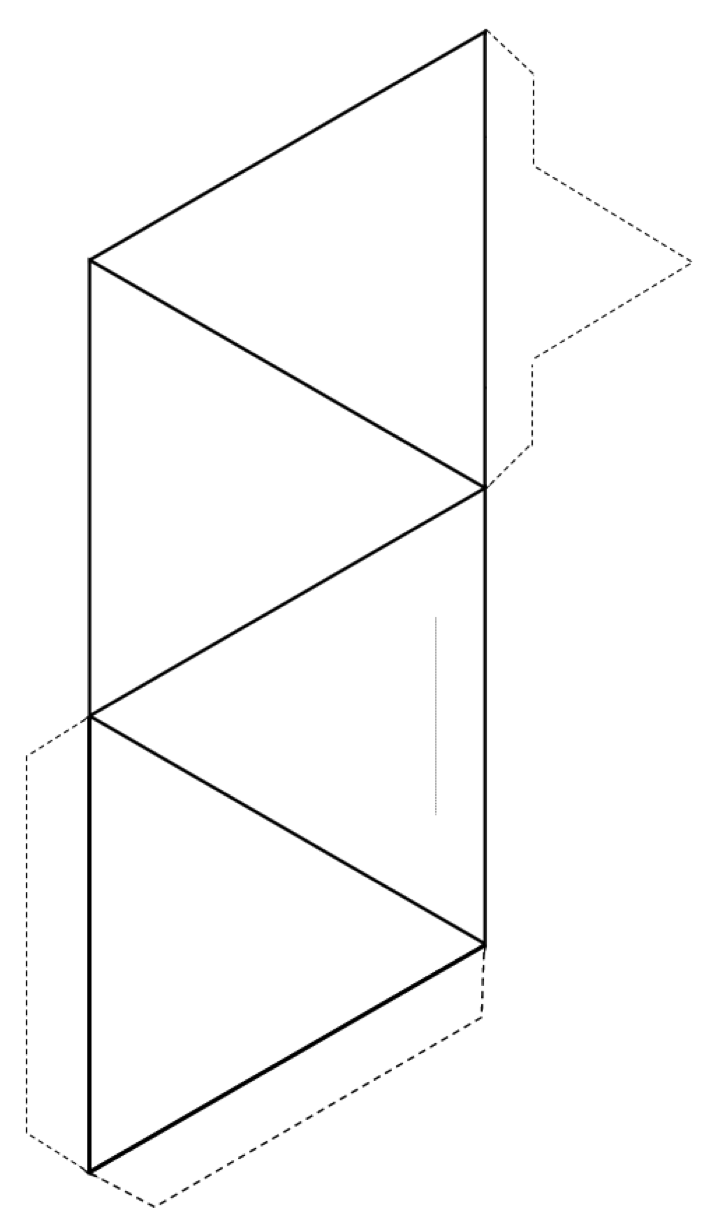
2.3. gyakorlat Tetrahedron készítése
Vágja körbe az alak külsejét (folytonos vonalak és szaggatott vonalak), majd hajtsa végre a folytonos vonalak mentén egy tetraédert.
Ha ragasztó vagy szalag van, rögzítse a fülek a tetraéderhez, hogy összetartsa. Ha nincs ragasztója vagy ragasztószalagja, készítsen egy szeletet a vékony szürke vonal mentén, és helyezze be a hegyes fület a résbe.
Ha ezt egy osztályteremben végzi, próbálja meg egyesíteni a tetraéderét másokkal párok, gyűrűk, egy- és kettős láncok, lapok, sőt háromdimenziós keretek is.
Az olivinben a legtöbb szilikátásványtól eltérően a szilícium-dioxid-tetraéderek nincsenek egymáshoz kötve. Egyéb. A 2.10. Ábrán látható módon azonban a vashoz és / vagy a magnéziumhoz vannak kötve.
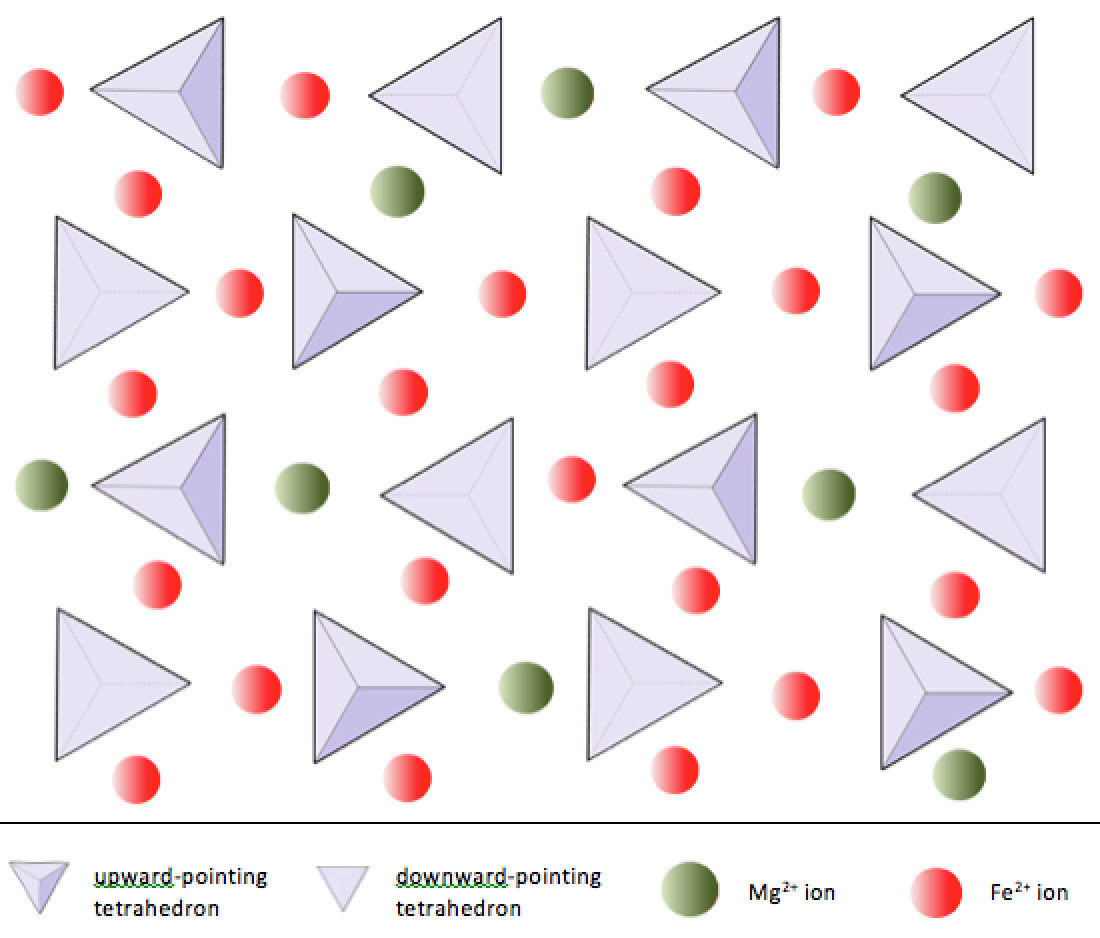
Amint azt már említettük, a vas és a magnézium +2 ionja hasonló méretű (bár nem teljesen azonos). Ez lehetővé teszi számukra, hogy helyettesítsék egymást néhány szilikát-ásványban. Valójában a szilikát-ásványokban a közös ionok mérete széles skálán mozog, amint azt a 2.11. Ábra mutatja. A bemutatott ionok mindegyike kation, kivéve az oxigént. Ne feledje, hogy a vas létezhet mind +2 ionként (ha az ionizálás során két elektron veszít), mind a +3 ionként (ha hármat veszít). A Fe2 + vasvas néven ismert. A Fe3 + vasvas néven ismert. Az ionsugarak kritikus fontosságúak a szilikátásványok összetétele szempontjából, ezért ismét erre a diagramra hivatkozunk.

Az egyláncú szerkezet a szilikát-piroxén a 2.12. és 2.13. ábrán látható. A piroxénben a szilícium-dioxid-tetraéderek egyetlen láncban kapcsolódnak egymáshoz, ahol minden tetraéder egy-egy oxigénionja megoszlik a szomszédos tetraéderekkel, ennélfogva kevesebb oxigén van a szerkezetben.Ennek eredményeként az oxigén / szilícium arány alacsonyabb, mint az olivinéban (4: 1 helyett 3: 1), és a szilíciumatomra jutó nettó töltés kisebb (–2 helyett –4), mivel kevesebb kationra van szükség hogy kiegyenlítse ezt a töltetet. A piroxén készítmények MgSiO3, FeSiO3 és CaSiO3 típusúak vagy ezek valamilyen kombinációi. A piroxén (Mg, Fe, Ca) SiO3 néven is írható, ahol a zárójelben lévő elemek bármilyen arányban jelen lehetnek. Más szavakkal, a piroxén mindegyik szilícium-dioxid-tetraéderhez (pl. MgSiO3) egy kationt tartalmaz, míg az olivinnek kettő (például Mg2SiO4). Mivel minden szilíciumion +4, és minden oxigénion –2, a három oxigén (–6) és az egy szilícium (+4) nettó -2 töltetet ad a szilícium-dioxid-tetraéderek egyetlen láncára. A piroxénben az egy kétértékű kation (2+) tetraéderenként kiegyenlíti a –2 töltést. Az olivinben két kétértékű kationra van szükség az elkülönített tetraéder –4 töltésének kiegyensúlyozásához. elférnek benne. Ezért lehetnek a piroxének vas- (0,63 Å sugár) vagy magnézium (0,72 Å sugár) vagy kalcium (1,00 Å sugár) kationok. id = “9424416ed6”>
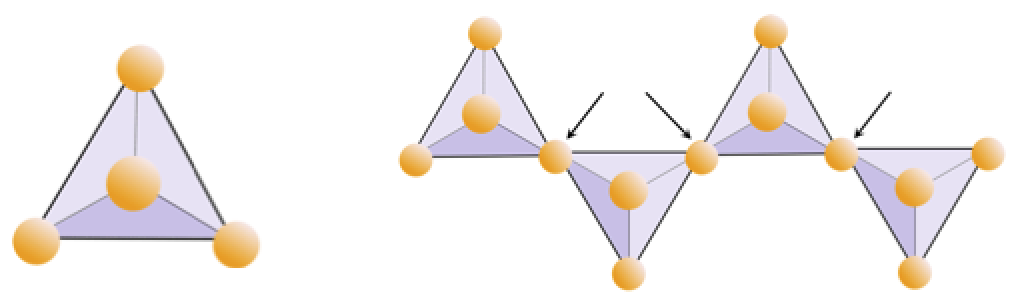
Az alábbi ábra kettős láncot mutat egy szilikát ásványban. Ismét számoljuk meg a tetraéderek számát az oxigénionok számával szemben. Ennek meg kell adnia a Si és O arányát a kettős láncú szilikátokban (pl. Amfibol).
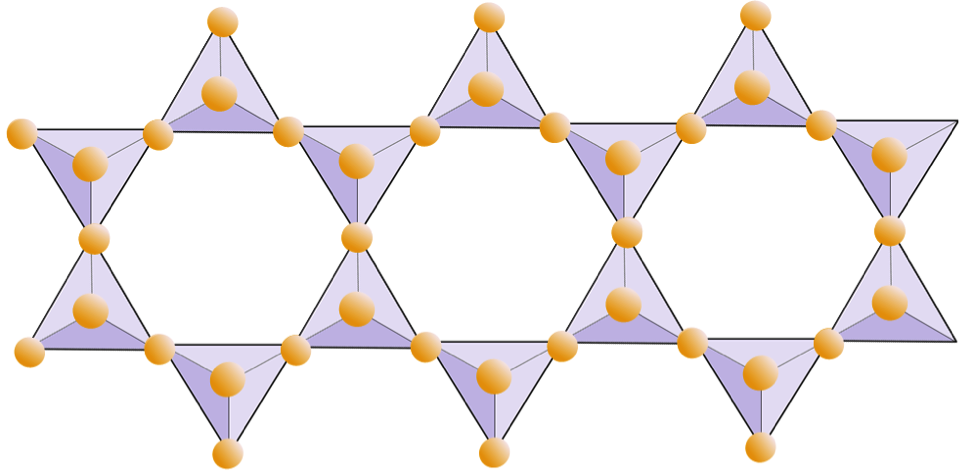
Az amfibol szerkezetekben a szilícium-dioxid-tetraéderek kettős láncban kapcsolódnak, amelynek oxigén / szilícium aránya alacsonyabb, mint a piroxéné, és ezért még kevesebb kationra van szükség a töltés kiegyensúlyozásához. Az amfibol még megengedőbb, mint a piroxén, és összetétele nagyon összetett lehet. A Hornblende tartalmazhat például nátriumot, káliumot, kalciumot, magnéziumot, vasat, alumíniumot, szilíciumot, oxigént, fluort és hidroxil-iont (OH–).
Csillámszerkezetekben a szilícium-dioxid-tetraéderek folyamatos lapokban vannak elrendezve, ahol minden tetraéder három oxigénanionon osztozik a szomszédos tetraéderekkel. Még nagyobb az oxigének megoszlása a szomszédos tetraéderek között, ezért kevesebb töltéskiegyenlítő kationra van szükség a szilikátlemez ásványokhoz. A lapok közötti kötés viszonylag gyenge, és ez a jól fejlett egyirányú hasítást eredményezi (2.14. Ábra). A biotit csillámban lehet vas és / vagy magnézium, és ez ferromágneses szilikát ásványi anyagot (például olivint, piroxént és amfibolt) tesz. A klorit egy másik hasonló ásvány, amely általában magnéziumot tartalmaz. A muszkovit csillámban csak az alumínium és a kálium van jelen; ezért nem ferromágneses szilikátásvány.

A muszkoviton, a biotiton és a kloriton kívül sok más lap-szilikát (vagy filoszilikát) található, amelyek általában agyag méretű töredékekként léteznek (azaz kevesebb, mint 0,004 mm). Ide tartoznak a kaolinit, az illit és a szmektit agyagásványai, és bár nagyon kicsi a méretük miatt nehéz őket tanulmányozni, a kőzetek és különösen a talaj rendkívül fontos alkotóelemei.
Az összes lapszilikát az ásványi anyagok szerkezetében is van víz.
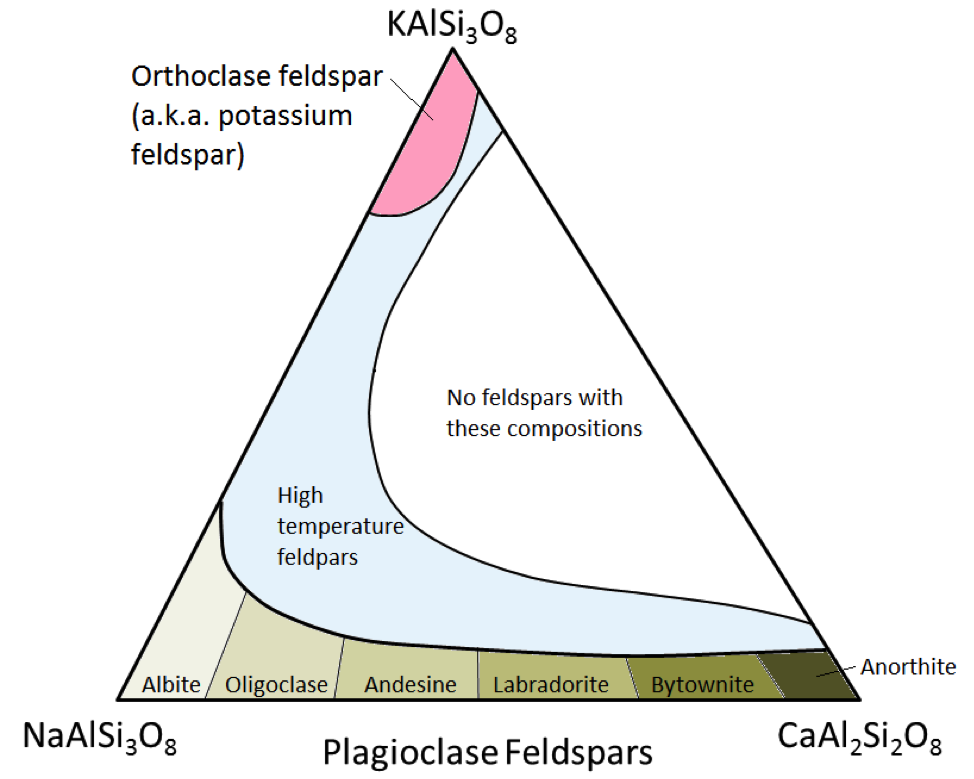
A szilícium-dioxid-tetraéderek háromdimenziós keretekben kötődnek mind a földpátokhoz, mind a kvarchoz. Ezek nem ferromágneses ásványok – nem tartalmaznak vasat vagy magnéziumot.A szilícium-dioxid-tetraédereken kívül a földpátok különböző kombinációkban tartalmazzák az alumínium, kálium, nátrium és kalcium kationokat. A kvarc csak szilícium-dioxid-tetraédereket tartalmaz. . Mint az olivinben lévő vas és magnézium esetében, a plagioklászban az albit és az anorit között folyamatos a kompozíciók köre (szilárd oldatsorozat). Ennek oka, hogy a kalcium- és nátrium-ionok mérete szinte azonos (1,00 Å versus 0,99 Å). A CaAl2Si3O8 és a NaAlSi3O8 között bármilyen közbenső készítmény létezhet (2.15. Ábra). Ez egy kicsit meglepő, mert bár a méretük nagyon hasonló, a kalcium- és nátriumionok töltése nem azonos (Ca2 + versus Na +). Ezt a problémát az Al3 + Si4 + helyettesítése jelenti. Ezért az albit NaAlSi3O8 (egy Al és három Si), míg az anoritit CaAl2Si2O8 (két Al és két Si), és a köztes összetételű plagioklász földpátok köztes arányban vannak Al és Si. Ezt nevezzük “kapcsolt szubsztitúciónak”.
A köztes összetételű plagioklász földpátok az oligoklász (10–30% Ca), andezin (30–50% Ca), labradorit (50–70%). A Ca-földpát (KAlSi3O8) kissé eltérõ szerkezettel rendelkezik, mint a plagioklászé, a káliumion nagyobb méretének (1,37 Å) és ennek a nagy méretnek köszönhetõen. A kálium és a nátrium nem helyettesíti egymást, kivéve magas hőmérsékleten. Ezek a magas hőmérsékletű földpátok valószínűleg csak a vulkáni kőzetekben találhatók meg, mivel a tolakodó magmás kőzetek elég lassan, alacsony hőmérsékletre hűlnek, hogy a földpátok az egyik alacsonyabb hőmérsékletű formák.
A kvarcban (SiO2) a szilícium-dioxid-tetraéderek „tökéletes” háromdimenziós keretben vannak összekötve. Mindegyik tetraéder négy másik tetraéderhez van kötve (az összes tetraéder minden sarkában megoszlik az oxigén), és ennek eredményeként a szilícium és az oxigén aránya 1: 2. Mivel az egy szilíciumkationnak +4 töltése van, és a két oxigénanion mindegyikének -2 töltése van, a töltés kiegyensúlyozott. Nincs szükség alumíniumra vagy más kationra, például nátriumra vagy káliumra. A kvarc keménysége és hiánya a szilícium-dioxid-tetraéderre jellemző erős kovalens / ionos kötésekből adódik.
2.5. Gyakorlat Ferromágneses szilikátok?
A szilikát ásványi anyagokat ferromágneses vagy nem ferromágneses csoportokba sorolják, attól függően, hogy formulájukban van-e vas (Fe) és / vagy magnézium (Mg). Az alábbiakban számos ásványi anyagot és képletüket soroljuk fel. Mindegyiknél adja meg, hogy ferromágneses szilikátról van-e szó.
| Ásvány | Képlet | Ferromágneses szilikát? |
|---|---|---|
| olivin | (Mg, Fe) 2SiO4 | |
| pirit | FeS2 | |
| plagioklász | CaAl2Si2O8 | |
| piroxén | MgSiO3 | |
| hematit | Fe2O3 | |
| ortoklász | KAlSi3O8 | |
| kvarc | SiO2 |
| Ásványi | képlet * | ferromágnes-szilikát? |
|---|---|---|
| amfibol | Fe7Si8O22 (OH) 2 | |
| muscovite | K2Al4 Si6Al2O20 (OH) 4 | |
| magnetit | Fe3O4 | |
| biotit | K2Fe4Al2Si6Al4O20 (OH) 4 | |
| dolomit | (Ca, Mg) CO3 | |
| gránát | Fe2Al2Si3O12 | |
| szerpentin | Mg3Si2O5 (OH) 4 |
- Az angström az atom kifejezésére általánosan használt egység skála méretei. Az egyik angström 10–10 m vagy 0,0000000001 m. Az angström szimbóluma Å. ↵