Folyóiratok | Politika | Engedély gasztroenterológiai kutatás
A gyomor-bél metaplazia kiszámíthatósága foltos foltos erythema alapján, endoszkópián látva
Naoyoshi Nagataa, g, Takuro Shimbob, Junichi Akiyamaa, Ryo Nakashimaa, Hyung Hun Kimc, Takeichi Yoshidad, Kazufusa Hoshimotoe, Naomi Uemuraf
a Gasztroenterológiai és Hepatológiai Tanszék, Nemzeti Globális Egészségügyi és Orvostudományi Központ (NCGM), Tokió, Japán
b Klinikai Kutatási és Informatikai Tanszék Nemzetközi Klinikai Kutatóközpont Kutatóintézet, NCGM, Tokió, Japán
Belgyógyászati részleg, Kosin Egyetem Orvostudományi Főiskola, Busan, Korea – d Gasztroenterológiai és Hepatológiai Tanszék, Wakayama Orvostudományi Egyetem, Wakayama, Japán
Klinikai Laboratóriumi Patológiai Osztály eDepartementje, NCGM, Tokió, Japán
f Gasztroenterológiai és Hepatológiai Tanszék, NCGM, Kohnodai Kórház, Chiba, Japán
g. G astroenterology and Hepatology, National Center for Global Health and Medicine, 1-21-1 Toyama, Shinjuku-ku, Tokió 162-8655, Japán
A kézirat kiadásra elfogadva 2011. szeptember 26.
Rövid cím: A bél Metaplasia endoszkópos diagnózisa
doi: https://doi.org/10.4021/gr357w
- Kivonat
- Bevezetés
- Módszerek
- Eredmények
- Megbeszélés
| Kivonat | ▴Top |
Háttér: A bél metapláziát (IM) premalignus elváltozásnak tekintik. Az IM endoszkópos diagnosztizálását azonban nehéznek tartották. Az endoszkópia segítségével egyedülálló erythema mintát találtunk, a “Foltos pattanásos eritéma (MPE)”, amely magában foglalja a súlyos IM-t. A Helicobacter pylori (Hp) fertőzés maga is erythemát okozhat, ami a gyomornyálkahártya szövettani változását tükrözi. betegeket, hogy érvényesítsék az MPE és a kóros leletek közötti kapcsolatot.
Módszerek: Krónikus gyomorhurutban szenvedő betegeket vettünk fel, akik legalább 6 hónappal a vizsgálat előtt sikeres Hp felszámoláson estek át. Az MPE-t több lapos vagy depressziós eritemás elváltozásként határoztuk meg. Amikor az MPE-vel endoszkópián találkoztunk, biopsziát végeztünk mind az MPE, mind a nem MPE helyen. A nem MPE helyet egy szomszédos nyálkahártyaként határoztuk meg, amely az MPE helyétől 3 cm-en belül található. Az összes biopsziás mintát immunhisztokémiailag értékeltük az IM altípus használatával MUC2, MUC5AC, MUC6, CD10 és CDX2 foltok. Az IM mértékét a frissített Sydney-rendszer szerint határoztuk meg. Kiszámítottuk az MPE eredmények diagnosztikai pontosságát a patológiás IM-re vonatkozóan. Megvizsgálták az MPE és az IM altípus közötti kapcsolatot is.
Eredmények: Összesen 102 beteget választottak ki a vizsgálatba. Ezek közül 55 betegnél (54%) volt MPE. Ennek az 55 betegnek a biopsziás mintáit az MPE és a nem MPE helyekről vették. Az IM százalékos aránya és az IM medián pontszáma egyaránt szignifikánsan magasabb volt az MPE helyeken (P < 0,001), mint a nem MPE helyeken. Az MPE érzékenysége és specificitása a szövettani IM kimutatásában 72,7% és 84,1% volt. Nem figyeltünk meg szignifikáns összefüggést a MUC2, MUC5AC, MUC6, CD10 és CDX2 expressziójában az MPE helyek és a nem MPE helyek között. A két csoport között nem volt szignifikáns különbség az IM altípusok arányában (teljes / hiányos).
Következtetések: Az MPE hasznos endoszkópos eredmény a szövettani IM kimutatására kromoendoszkópia és nagyító endoszkópia nélkül. Az IM-altípust azonban nehéz azonosítani. A Hp felszámolásának korszakában az MPE képes arra, hogy a gyomorrák kockázatának prediktív megállapításává váljon.
Kulcsszavak: Bél metaplazia; Premalignus elváltozás; Endoszkópos lelet; Bőrpír; Fehér fényű endoszkópia; Altípus, felszámolás; Helicobacter pylori
| Bevezetés | ▴Top |
Úgy gondolják, hogy a gyomorrák kialakulása többlépcsős folyamatot foglal magában, beleértve a Helicobacter pylori (Hp) fertőzést, a krónikus gyomorhurutot, a mirigy atrófiáját, a bélmetapláziát (IM) és végül dysplasia. Az IM-t és a gyomor atrófiát együttesen a bél-típusú gyomorrák kialakulásának kockázati tényezőinek tekintik, és premalignus elváltozásoknak tekintik őket.A gyomor atrófia endoszkópiával felismerhető és összefügg a szövettani értékeléssel. Az IM diagnosztizálását a fehérfényes endoszkópia alkalmazásával azonban nehéznek ítélték meg, mivel az IM-nek hiányzik a színbeli megkülönböztetés és több lapos elváltozásként van jelen.
Nemrégiben , azt találtuk, hogy az endoszkópián egyedülálló erythemás lelet figyelhető meg a Hp felszámolása után is. Ezt a megállapítást “Foltos pattanásos eritéma (MPE)” néven írjuk le. Az MPE többféle lapos vagy enyhén depressziós eritemás elváltozásként ismerhető fel a standard fehérfény-endoszkópia alatt; kórosan súlyos IM-t is magában foglal. A Hp-fertőzés maga is okozhat erythemát, amely az endoszkópián látható, ami olyan szövettani változásokat tükröz, mint a gyulladásos sejtek beszivárgása és az ödéma. , olyan betegeket vettünk fel, akiknek Hp-felszámolása történt az MPE és a kóros leletek közötti kapcsolat validálása érdekében.
| Módszerek | ▴Top |
Betegválasztás
Krónikus gyomorhurutban szenvedő betegeket, akik a vizsgálat előtt legalább 6 hónappal sikeres Hp-felszámoláson estek át, prospektív módon felvették a vizsgálatba a Nemzeti Egészségügyi és Orvostudományi Központban (NCGM) 2008 januárja és 2008 decembere között. Az endoszkópia előtti 4 hét alatt nem szteroid gyulladáscsökkentők (NSAID-ok), savkötők és antitrombotikus szerek alkalmazását tartalmazta. Kizártuk azokat a betegeket is, akiknek kórtörténetében gyomorműtét, vérzéses betegség, májcirrhosis, veseelégtelenség, szívelégtelenség, valamint korai vagy előrehaladott gyomorrák található. A résztvevőktől írásbeli, tájékozott beleegyezést kaptak a Helsinki Nyilatkozattal és annak későbbi felülvizsgálatával összhangban. A vizsgálati protokollt az NCGM Etikai Bizottsága jóváhagyta.
Helicobacter pylori felszámolása
A Hp-fertőzés által kiváltott krónikus gyomorhurutban és peptikus fekélybetegségben szenvedő betegek felszámolási terápián estek át. A betegeket naponta kétszer 7 napos amoxicillint, klaritromicint és protonpumpa-gátlót (PPI) tartalmazó kezeléssel kezelték, amely a Japánban elfogadott standard első vonalbeli kezelés volt. Ha a felszámolás nem volt sikeres, akkor egy második kezelési rendet alkalmaztunk, amely amoxicillint, metronidazolt és PPI-t tartalmazott. Az eradikációt a gyomorbiopsziák negatív szövettani vizsgálata, valamint a negatív 13C-karbamid lélegeztető teszt (13C-UBT) megerősítette 2-3 hónappal az eradikációs terápia befejezése után. Amikor az összes teszt negatív volt, a beteget Hp-fertőzésre negatívnak tekintették.
Endoszkópos értékelés
A Hp felszámolása után legalább 6 hónappal a betegeket endoszkópos vizsgálatnak vetették alá. Nagy felbontású nagy felbontású endoszkópot (Olympus videoszkóp, GIF-H260 modell) használtunk az MPE jelenlétének megfigyelésére a gyomor nyálkahártyájában. Az MPE-t több lapos vagy enyhén depressziós eritemás elváltozásként határoztuk meg, amelyek megkülönböztethetők a torlódást okozó nyálkahártyától, vérzésektől, angioectasiától, foltos erythemától és lineáris erythemától (1A, B ábra). Megkülönböztettük az MPE-t és a vöröses nyálkahártyát egy regeneráló hámmal, amelyet fekély vagy fekélyheg kísér.
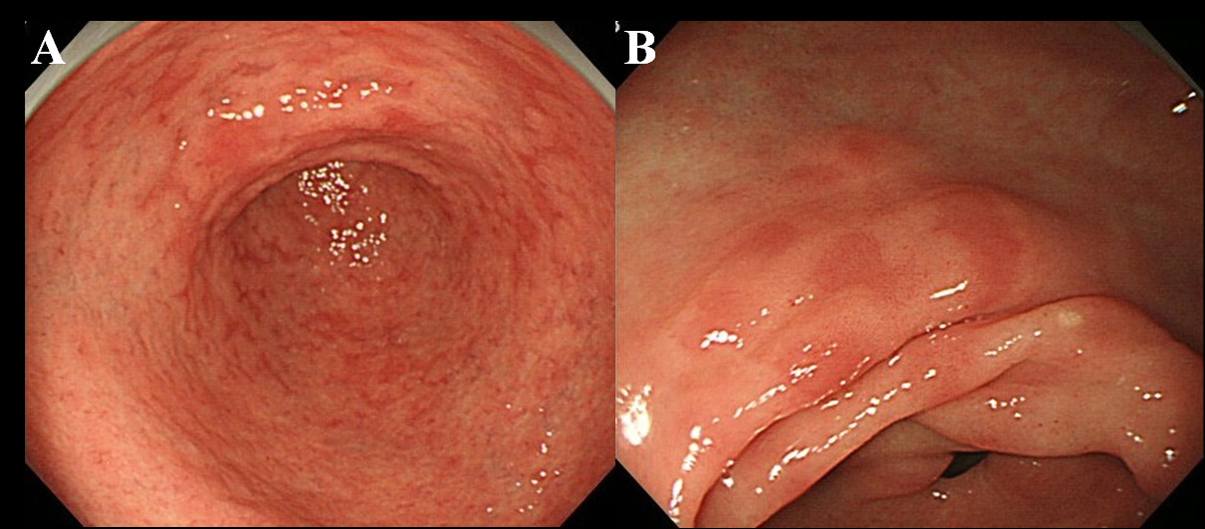 Kattintson a nagy képért kattintson a képre |
1. ábra. Az MPE endoszkópos megtalálása. (A) Többszörös és lapos bőrpír az antrumban; (B) Lapos és depressziós bőrpír az antrum kisebb görbületében. |
Amikor endoszkópián találkoztunk egy MPE-lelet megállapításával, biopsziát végeztünk mind az MPE-helyről, mind a nem-MPE-helyről. A nem MPE helyet egy szomszédos nyálkahártyaként határoztuk meg, amely az MPE helyétől 3 cm-en belül helyezkedik el (2. ábra).
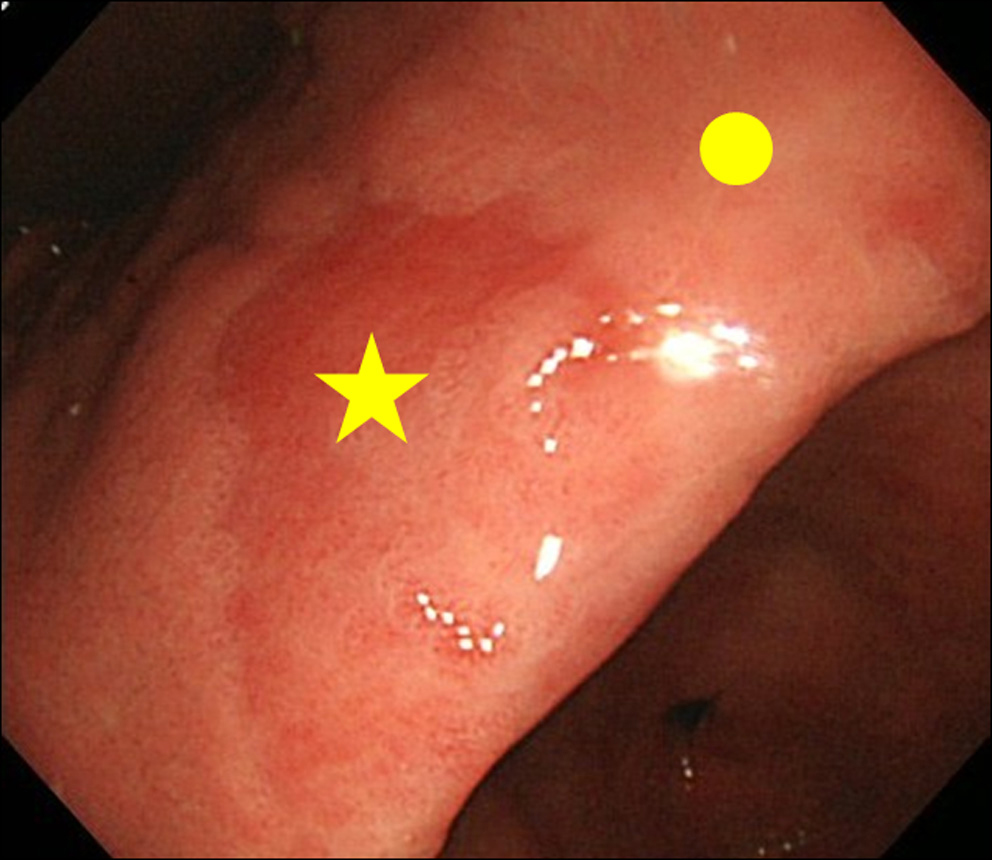 Kattintson a nagy képért |
. 2. ábra Biopszia helye. (★) az MPE biopsziás helye; (•) A nem MPE biopsziás helye. A nem MPE helyet egy szomszédos nyálkahártyaként határoztuk meg, amely az MPE helyétől 3 cm-en belül helyezkedik el. |
Az atrófiás határ mértékét 3 szakaszba sorolták: enyhe, közepes és súlyos, Kimura és Takemoto meghatározása szerint.
Szövettani értékelés
Biopsziás mintákat küldtek laboratóriumunkba, 10% -os pufferelt formalinban rögzítve. A mintákat feldolgoztuk, paraffinba ágyazottuk és 4 µm-es szakaszokra vágtuk. Az egyes minták tárgylemezeit hematoxilin-eozin (HE) segítségével festettük (1. ábra).(3A) és immunhisztokémiai festés. Az immunhisztokémiai foltok a következőket tartalmazták: (1) MUC2, a bélmucin markere, amely hasznos a serlegsejtek kimutatására (3B. Ábra), (2) MUC5AC, a gyomormucin markere, amely nyálkahártya nyaki sejtekben és a foveoláris epithelium (3C. ábra), (3) MUC6, a gyomor mucin markere, amely a test nyaki zónájának nyálkahártya-sejtjeiben és az antrum pylorus mirigyében expresszálódik (3D ábra), (4) CD10, a hasznos marker a vékonybél kefeszegélyének detektálására (3E. ábra), és (5) CDX2, az IM jelenlétének markerje (3F. ábra). A CDX2-t azért használtuk, mert a legújabb tanulmányok kimutatták, hogy a CDX2 expressziója széles körben megfigyelhető az IM mirigyekben, és a Hp felszámolása után nem tűnt el. Az IM jelenlétét mind HE, mind immunhisztokémiai festéssel igazolták.
Az IM altípusait teljes vagy hiányos típusokba sorolták. A teljes típust a gyomor mucin (MUC5AC vagy MUC6) csökkent expressziójának, valamint a bél mucin (MUC2) és a CD10 együttes expressziójának határoztuk meg (3A-F. Ábra). A hiányos típust a gyomor mucin (MUC5AC vagy MUC6) és MUC2 expressziójaként határoztuk meg. Mivel nincsenek megállapított kritériumok ahhoz, hogy egy esetet úgy osztályozzanak, hogy a teljes és a hiányos típus is legyen egy szakaszban, az IM altípusokat rendeltük el elterjedt típusnak.
Az IM-t a frissített Sydney-rendszer alapján pontozták (0: nincs, 1: enyhe, 2: mérsékelt, 3: jelzett).
Statisztikai elemzés
A betegeket két csoportra osztottuk annak alapján, hogy a betegek pozitív vagy negatívak voltak-e az MPE szempontjából. A kor és a felszámolás időtartamának összehasonlításához Student t-tesztjét használtuk. A két csoportban a nemi arányok és az endoszkópos atrófia mértéke a chi-négyzet tesztet vagy a Fisher pontos valószínűségi tesztjét használta.
Összehasonlítottuk a szövettani eredményeket az MPE helyek és a nem MPE helyek között. A két biopszia helyszín közötti különbségek összehasonlításához a Wilcoxon Matched-Pairs Signed-Ranks tesztet használtuk az IM számára medián pontszámot és Fisher pontos tesztjét az IM, az IM altípusok és az IM fenotípusok prevalenciájára. Kiszámolták az MPE érzékenységét, specificitását, pozitív és negatív prediktív értékeit, valamint a kóros IM kimutatására az endoszkópián észlelt pozitív és negatív valószínűségi arányokat. A P értékeket < 0,05 szignifikánsnak tekintették. Az összes statisztikai elemzést a Stata szoftver 10-es verziójával (StataCorp LP, College Station, TX, USA) végeztük.
| Eredmények | ▴Top |
A beteg jellemzői
A vizsgálati időszak alatt 157 beteg akik átestek a felső endoszkópián és Hp felszámolást kaptak, áttekintették. A 157 betegből 52-et kizártunk az elemzésből a következő kritériumok bármelyikével: antacidok (31), antitrombotikus gyógyszerek (17) vagy NSAID-k (3) alkalmazása; vagy májcirrhosis (5), szívelégtelenség (1) vagy korai gyomorrák (2). Több betegnél több kizárási kritériumot alkalmaztak.
Összességében tehát 102 beteget választottak ki elemzésre a kizárás után. Ezek közül 55 (54%) MPE-s beteg volt. Az átlagos életkorban és nemben nem figyeltek meg szignifikáns különbségeket az MPE-pozitív és a negatív betegek között (1. táblázat). A Hp felszámolási periódus után a két csoport között nem volt szignifikáns különbség. A nagyobb súlyosságú (közepes vagy súlyos) gyomor atrófia azonban szignifikánsan gyakrabban jelent meg az MPE-pozitív csoportban, mint az MPE-negatív csoportban (pozitív 65,6% szemben negatív 45,0%, P = 0,035).
 Kattintson a megtekintéshez |
1. táblázat: A betegek demográfiai jellemzői (n = 102) |
Endoszkópos leletek és kóros jellemzők
 Kattintson a megtekintéshez |
2. táblázat: Az MPE és az MPE-n kívüli webhelyek összehasonlítása (n = 55) |
A MUC2, MUC5AC, MUC6, C expressziójában nem figyeltünk meg jelentős összefüggést D10 és CDX2 az MPE helyek és a nem MPE helyek között (3. táblázat). Nem volt szignifikáns különbség az IM altípusok arányában (teljes / hiányos) a két csoport között (MPE: 18/30 versus non-MPE: 8/10, P = 0,778).
 Kattintson a megtekintéshez |
3. táblázat. A bél Metaplasia fenotípusai és altípusai |
| Beszélgetés | ▴Top |
Ebben a tanulmányban a Hp felszámolása után az endoszkópián látható egyedülálló erythemás megjelenésre koncentráltunk. Ezt a megállapítást “MPE” -nek neveztük, és azt találtuk, hogy az MPE jelenléte az endoszkópián láthatóan jellemzően a patológiás IM-re jellemző. azért tartották nehéznek, mert az IM általában lapos nyálkahártyában jelenik meg, és kevés morfológiai változást mutat. Kaminishi és munkatársai “hamuszínű göbös változásról” számoltak be az IM indikátoraként; e nyomozók eredményeinek pontossága magas volt, 98-99% -os specificitással, de az érzékenység alacsony (6-12%). Kaminishi és mtsai megjegyezték, hogy a hagyományos endoszkópia kevésbé hasznos az IM diagnózisának megerősítésére. Legutóbbi tanulmányok jelentek meg az IM endoszkópos megállapításáról nagyító endoszkópia segítségével. Beszámoltak arról, hogy a metilénkék-kromoendoszkópiával észlelt gyomor-gödrök és a konfokális endoszkópiával észlelt “villus-szerű megjelenés” hasznos megállapításai hasznosak voltak az IM diagnosztizálásához. Uedo és munkatársai arról számoltak be, hogy a “világoskék címer” megjelenése ( Az LBC) pontos jel az IM jelenlétére, amint azt a keskeny sávú képalkotó (NBI) nagyító endoszkópiával láthatjuk. A magas berendezésköltség, valamint az olyan speciális eszközök, mint az NBI vagy az endoszkópia nagyítása miatt szükséges további készségek és idő miatt a szűrés ezzel a berendezéssel nem praktikus a mindennapi klinikai gyakorlatban. Ezenkívül fokozott a gasztrointesztinális nyálkahártya DNS-károsodásának kockázata, ha metilénkékkel végzett kromoendoszkópiát követ, majd fehér fényt, és használatakor óvatosságra van szükség. Ezért előnyösebb diagnosztizálni az IM-t az MPE megtalálásával kromoendoszkópia és nagyító endoszkópia nélkül. Vizsgálati eredményeink azt sugallják, hogy az IM jelenléte standard endoszkópiával diagnosztizálható biopszia nélkül.
Miért figyelhető meg az MPE a Hp felszámolása után is? Ez a gyomornyálkahártya szövettani változásainak tulajdonítható. A felszámolást követő figyelemre méltó szövettani változások közé tartozik a gyulladásos sejtek behatolásának javulása, az epitheliális hiperplázia és az ödéma. Az eritemás és ödémás nyálkahártya endoszkópos képei, amelyek javulni látszanak, ezeket a szövettani változásokat tükrözik. Ezért feltételezzük, hogy az MPE a perzisztens erythemás IM fennmaradó területéből és a Hp sikeres felszámolásának eredményeként gyorsan helyreálló nem IM területből áll. A Hp felszámolása egyértelműbbé tette az MPE és a nem MPE területek közötti kontrasztot. Nem ismert azonban, hogy miért csak az MPE helyét figyelik erythematosus nyálkahártyaként. Valószínűleg arra lehet következtetni, hogy a metaplasztikus mirigyeket egy nagyon sűrű mikrovérterület veszi körül; ezt ebben a tanulmányban nem sikerült tisztázni. Ezenkívül az MPE helyén az IM pontszám szignifikánsan magasabb volt, mint a nem MPE helyszínen. Feltételezzük, hogy az eritemás nyálkahártya megjelenése sok metaplasztikus mirigy jelenlétével jár.
Jelen tanulmány kimutatta, hogy az IM teljes altípusa túlnyomórészt a gyomor nyálkahártyájában található meg. . Az IM altípusait a teljes vagy a hiányos típusba sorolták; ezek a legszélesebb körben használt altípusok. Számos tanulmány kimutatta, hogy a teljes típus nem mutat megnövekedett kockázatot a karcinóma kialakulásában, míg a hiányos típus a rosszindulatú transzformáció fokozott kockázatával jár. Az altípusok és a gyomorrák kockázata közötti összefüggés azonban nem elfogadott széles körben. Jelenleg a standard endoszkópiával nehéz meghatározni az egyik altípust.
Beszámoltak arról, hogy a Hp felszámolási terápia hatékony mind a gasztrointesztinális fekély, mind a a gyomorrák kialakulása. A Hp felszámolási terápia ezen alkalmazásai valószínűleg a közeljövőben megjelennek a klinikai gyakorlatban. Óvatosan kell eljárni a gyomorrák kialakulásának kockázatával szemben a Hp felszámolása után. A felszámolás utáni gyomorrák jellemzői szerint a korpuszban kórosan súlyos IM és az endoszkópián kimutatott súlyos gyomor atrófia szerepel. Ezért gondosan meg kell figyelni az IM jelenlétét még a Hp felszámolása után is.
Összegzésképpen elmondható, hogy az MPE jelenléte endoszkópos vizsgálaton jellemző a kóros IM-re.A klinikai gyakorlatban előnyös lenne, ha kóros IM-t kromoendoszkópia vagy nagyító endoszkópia nélkül lehetne diagnosztizálni. Az MPE a gyomorrák kockázatának prediktív megállapításává válhat a Hp felszámolásának korszakában.
Köszönetnyilvánítás
Köszönjük Dr. Hidenobu Watanabe és Dr. Hiroyoshi Ota tanácsadói munkáját a patológiás értékelésekkel kapcsolatos tanulmányban. Köszönetünket szeretnénk kifejezni Hisae Kawashirónak, a klinikai kutatások koordinátorának az adatgyűjtéshez nyújtott segítségért.
Támogatás támogatása
Ezt a munkát a Globális Egészségügyi és Orvostudományi Központ Grantja támogatta (21-108).
Érdekellentétek
A szerzők kijelentik, hogy nincsenek összeférhetetlenségeik.
| ▴Top |
- Correa P. Emberi gyomor karcinogenezise: többlépcsős és többtényezős folyamat – Első American Cancer Society Award előadás a rákról Epidemiológia és megelőzés. Cancer Res. 1992; 52 (24): 6735-6740.
publikált - Leung WK, Sung JJ. Áttekintő cikk: bélmetaplázia és gyomor karcinogenezis. Aliment Pharmacol Ther. 2002; 16 (7): 1209-1216.
publikált doi - Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K és mtsai. Helicobacter pylori fertőzés és a gyomorrák kialakulása. N Engl J Med. 2001; 345 (11): 784-789.
pubmed doi - Kimura K, Takemoto T. Az atrófiás határ endoszkópos felismerése és jelentősége krónikus gyomorhurutban. Endoszkópia. 1969; 1: 1-3.
- Satoh K, Kimura K, Taniguchi Y, Kihira K, Takimoto T, Saifuku K, Kawata H és mtsai. A Helicobacter pylori fertőzés diagnosztizálására és az atrófiás gyomorhurut mértékének felmérésére alkalmas biopsziás helyek. Am J Gastroenterol. 1998; 93 (4): 569-573.
publikált doi - Kaminishi M, Yamaguchi H, Nomura S, Oohara T, Sakai S, Fukutomi H, Nakahara A és mtsai. A krónikus gyomorhurut endoszkópos osztályozása a Gasztritisz Kutató Társaság kísérleti tanulmánya alapján. Digest Endosc. 2002; 14: 138-151.
- Rugge M, Leandro G, Farinati F, Di Mario F, Sonego F, Cassaro M, Guido M és mtsai. Gyomorhám diszplázia. Hogyan viszonyul a klinikopatológiai háttér a menedzsmenthez. Rák. 1995; 76 (3): 376-382.
pubmed doi - Nagata N, Akiyama J, Uemura N. A gyomor bél metapláziájának endoszkópos diagnózisa Helicobacter pylori felszámolása után. Endoszkópia. 2009; 41 (I. melléklet): A212.
- Dixon MF, Genta RM, Yardley JH, Correa P. A gasztritisz osztályozása és osztályozása. A frissített Sydney-rendszer. Nemzetközi műhely a gasztritisz hisztopatológiájáról, Houston 1994. Am J Surg Pathol. 1996; 20 (10): 1161-1181.
közzétett doi - Ho SB, Shekels LL, Toribara NW, Kim YS, Lyftogt C, Cherwitz DL, Niehans GA. Mucin gén expresszió normál, preneoplasztikus és neoplasztikus emberi gyomor hámban. Cancer Res. 1995; 55 (12): 2681-2690.
publikált - Silva E, Teixeira A, David L, Carneiro F, Reis CA, Sobrinho-Simoes J, Serpa J és mtsai. A mucinok mint kulcsmolekulák a gyomor bélmetapláziájának osztályozásához. Virchows Arch. 2002; 440 (3): 311-317.
publikált doi - Reis CA, David L, Correa P, Carneiro F, de Bolos C, Garcia E, Mandel U és mtsai. Az emberi gyomor bélmetapláziája a mucin (MUC1, MUC2, MUC5AC és MUC6) expressziójának különféle mintáit mutatja. Cancer Res. 1999; 59 (5): 1003-1007.
publikálva - Groisman GM, Amar M, Livne E. CD10: értékes eszköz a mikrovillusos zárványbetegség (familiáris mikrovillusos atrófia) fénymikroszkópos diagnosztizálásához. Am J Surg Pathol. 2002; 26 (7): 902-907.
közzétett doi - Carl-McGrath S, Lendeckel U, Ebert M, Wolter AB, Roessner A, Rocken C. A CD143-at a gyomorrákban szabályozzák. Int J Oncol. 2004; 25 (5): 1223-1232.
publikált - Bai YQ, Yamamoto H, Akiyama Y, Tanaka H, Takizawa T, Koike M, Kenji Yagi O és mtsai. A homeodomain fehérje CDX2 méhen kívüli expressziója a bél metapláziájában és a gyomor karcinómáiban. Cancer Lett. 2002; 176 (1): 47-55.
publikált doi - Satoh K, Mutoh H, Eda A, Yanaka I, Osawa H, Honda S, Kawata H és mtsai. A CDX2 aberráns expressziója a gyomor nyálkahártyájában bélmetapláziával és anélkül: a Helicobacter pylori felszámolásának hatása. Helicobacter. 2002; 7 (3): 192-198.
publikált doi - Dinis-Ribeiro M, da Costa-Pereira A, Lopes C, Lara-Santos L, Guilherme M, Moreira-Dias L, Lomba- Viana H és mtsai. Nagyítási kromoendoszkópia a gyomor-bél metaplazia és dysplasia diagnosztizálására. Gastrointest Endosc. 2003; 57 (4): 498-504.
publikált doi - Areia M, Amaro P, Dinis-Ribeiro M, Cipriano MA, Marinho C, Costa-Pereira A, Lopes C és mtsai. A metilénkék nagyítású kromoendoszkópia osztályozásának külső validálása premalignus gyomor elváltozások esetén. Gastrointest Endosc. 2008; 67 (7): 1011-1018.
közzétett doi - Yang JM, Chen L, Fan YL, Li XH, Yu X, Fang DC. A gyomornyálkahártya endoszkópos mintázata és klinikopatológiai jelentősége. Világ J Gasztroenterol. 2003; 9 (11): 2552-2556.
publikált - Uedo N, Ishihara R, Iishi H, Yamamoto S, Yamada T, Imanaka K, Takeuchi Y és mtsai. A gyomor-bél metaplazia diagnosztizálásának új módszere: keskeny sávú képalkotás nagyító endoszkópiával. Endoszkópia. 2006; 38 (8): 819-824.
pubmed doi - Kiesslich R, Jung M. Nagyítási endoszkópia: javítja-e a nyálkahártya felületének elemzését a gyomor-bélrendszeri daganatok diagnosztizálásához ?. Endoszkópia. 2002; 34 (10): 819-822.
közzétett doi - Olliver JR, Wild CP, Sahay P, Dexter S, Hardie LJ. Chromoendoszkópia metilénkékkel és a kapcsolódó DNS-károsodásokkal Barrett nyelőcsövében. Lancet. 2003; 362 (9381): 373-374.
pubmed doi - Oda Y , Miwa J, Kaise M, Matsubara Y, Hatahara T, Ohta Y. Ötéves utóvizsgálat a gyomornyálkahártya szövettani és endoszkópos elváltozásairól a Helicobacter pylori felszámolása után. Dig Endosc. 2004; 16: 213-18.
- Tepes B, Kavcic B, Zaletel LK, Gubina M, Ihan A, Poljak M, Krizman I. A gyomornyálkahártya két-négy éves szövettani nyomon követése Helicobacter után pylori felszámolása. J Pathol. 1999; 188 (1): 24-29.
publikálva doi - Jass JR, Filipe MI. A normál gyomor mucin profiljai nyálkahártya, bélmetaplázia és variánsai, valamint gyomor karcinóma. Histochem J. 1981; 13 (6): 931-939.
pubmed doi - Filipe MI, Munoz N, Matko I, Kato I, Pompe-Kirn V, Jutersek A, Teuchmann S és mtsai. Bélmetaplazia típusok és a gyomor kockázata rák: kohorsz vizsgálat Szlovéniában. Int J Cancer. 1994; 57 (3): 324-329.
közzétett doi - Rokkas T, Filipe MI, Sladen GE. A korai gyomorrák megnövekedett előfordulásának kimutatása III. Típusú bélmetapláziában szenvedő betegeknél, akiket szorosan nyomon követnek. Belek. 1991, 32 (10): 1110-1113.
publikált doi - Genta RM, Rugge M. Felülvizsgálati cikk: A gyomornyálkahártya neoplasztikus állapotai – gyakorlati megközelítés a megzavarodott klinikus számára. Aliment Pharmacol Ther. 2001; 15 (1. kiegészítés): 43-50.
publikált - Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, Terao S és mtsai. A Helicobacter pylori felszámolásának hatása a korai gyomorrák endoszkópos reszekcióját követő metakronus gyomorrák előfordulására: nyílt, randomizált, kontrollált vizsgálat. Gerely. 2008; 372 (9636): 392-397.
közzétett doi - Tashiro J, Miwa J, Tomita T; Matsubara Y, Oota Y. Helicobacter pylori felszámolása után kimutatott gyomorrák. Emésztési endoszkópia. 2007; 19: 167-173.
Ez egy nyílt hozzáférésű cikk, amelyet a Creative Commons Nevezési licenc feltételei szerint terjesztenek, amely megengedi a korlátlan felhasználást, terjesztést és sokszorosítást bármilyen közegben, feltéve, hogy az eredeti mű megfelelően szerepel.
A gasztroenterológiai kutatásokat az Elmer Press Inc. publikálta.