Francium elem tények
A kémiai elem franciát alkálifémnek minősítik. 1939-ben fedezte fel Marguerite Perey.

Adatzóna
| Besorolás: | Francium alkálifém |
| Szín: | ezüst-szürke-metál (feltételezett) |
| Atom súly: | (223), nincsenek stabil izotópok |
| Állapot: | szilárd | 27 oC, 300 K |
| Forráspont: | 677 oC, 950 K |
| Elektronok: | 87 |
| Protonok: | 87 |
| Neutronok a legelterjedtebb izotópban: | 136 |
| Elektronhéjak: | 2, 8,18,32,18,8,1 |
| Elektronkonfiguráció: | 7s1 |
| Sűrűség @ 20oC: | 1,873 g / cm3 |
Mutasson többet, többek között: Melegség, Energia, Oxidáció,
Reakciók, vegyületek, sugarak, vezetőképesség
| Atomtérfogat: | 71,07 cm3 / mol |
| Szerkezet: | feltételezhető, hogy a másolat másolása: testközpontú köbös |
| Keménység: | – |
| Fajlagos hőteljesítmény | – |
| Fúziós hő | 2 kJ mol-1 |
| porlasztási hő | 73 kJ mol-1 |
| párolgási hő | 64 kJ mol-1 |
| 1. ionizációs energia | 384 kJ mol-1 |
| 2. ionizációs energia | – |
| 3. ionizációs energia | – |
| Elektron affinitás | – |
| Minimális oxidációs szám | 0 |
| Min. általános oxidációs sz. | 0 |
| Maximális oxidációs szám | 1 |
| Max. általános oxidáció sz. | 1 |
| Elektronegativitás (Pauling-skála) | 0,7 |
| Polarizálhatóság kötet | 48,7 Å3 |
| Légi reakció | – |
| Reakció 15 M HNO3-val | – |
| Reakció 6 M HCl-lel | erőteljes, ⇒ H2, FrCl |
| Reakció 6 M NaOH-val | erőteljes, ⇒ H2, FrOH |
| oxid (ok) | – |
| Hidrid (ek) | – |
| Klorid (ok) | – |
| Atomsugár | – |
| Ionos sugár (1+ ion) | 194 pm |
| Ionos sugár (2+ ion) | – |
| Ionos sugár (3+ ion) | – |
| Ionos sugár (1-ion) | – |
| Ionos sugár (2-ion) | – |
| Ionos sugár (3-ion) | – |
| Hővezető képesség | 3,61 W m-1 K-1 |
| Elektromos vezetőképesség | – |
| Fagyás / olvadáspont: | 27 oC, 300 K |

Ez az uránérc minta körülbelül 100 000 atom frankium-223-at tartalmaz (3,3 x 10 -20 g). Francium radioaktív; kevesebb mint 30 g létezik a Földön egy adott időpontban. Image Ref. (1)
A Francium felfedezése
Franciumot Marguerite Perey fedezte fel 1939-ben, amikor az aktinium-227 radioaktív bomlását kutatta.
A felfedezés a párizsi Curie Intézetben történt. Az elem a felfedezés országából – Franciaországból – származik.
A felfedezés 1935-ben kezdődött, amikor Perey 26 éves volt, elolvasva egy kutatási cikket, amely szerint amerikai tudósok felfedezték az aktinium által kibocsátott béta részecskéket, amelyek a normálisnál nagyobb energiamennyiséggel rendelkezett. Rendkívül tiszta aktiniummintát készített és tanulmányozta annak sugárzását. Perey felfedezte, hogy az aktiniumok radioaktivitásának körülbelül 1% -át az alfa-részecskék, nem pedig a béta-részecskék bocsátják ki. saját magja. A kialakult leánymag egy korábban felfedezetlen elem volt, amelyet úgy döntött, hogy franciát hív hazája, Franciaország tiszteletére.
227Ac → 223Fr + 4He
87 protonnal az új elem tartozott A periódusos rendszer 1. csoportja, összekapcsolva a másik öt alkálifémet: lítium, nátrium, kálium, rubídium és cézium.
A francium felfedezése befejezte az emberiség által a természetben előforduló elemek felfedezését.
Az azóta felfedezett összes elemet akkor fedezték fel, amikor az elemet a laboratóriumban előállították.

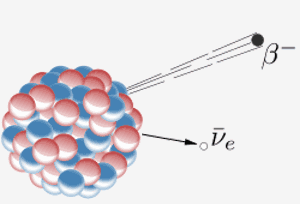
Egy mag béta-részecskét bocsát ki ( egy elektron) és egy antineutrino. Ennek az az eredménye, hogy a magban lévő neutron protonná alakul. Amikor a periódusos rendszer 87-es eleme (francium) ezt megteszi, az extra proton azt jelenti, hogy 88-as elemmé (rádium) válik.
Megjelenés és jellemzői
Káros hatások:
A Francium erősen radioaktív.
Jellemzők:
A Francium nehéz, instabil, radioaktív fém, maximális felezési ideje csak 22 perc. Alacsony olvadáspontú (27 oC, 81 oF), és ha elegendő mennyiséget képes felhalmozni, akkor meleg helyiségben folyékony lenne.
A Francium a földkéreg második legritkább eleme, az astatin mellett. Egyszerre harminc grammnál kevesebb francium létezik a Földön.
A francium az összes elem közül a legkevésbé elektronegatív, ezért a kémiailag leginkább reakcióképes alkálifémnek kell lennie. Sajnos nem áll rendelkezésre elegendő mennyiségben ahhoz, hogy a vízzel reagáljon – apró mennyiségben készül részecskegyorsítókban. Elméletileg a reakciója vízzel erőteljesebb lenne, mint a céziumé, és sokkal erőszakosabb, mint a nátriumé.
A Franciumot legutóbb a New York-i Stony Brook Egyetemen tanulmányozták. Az ottani tudósok egyszerre akár tízezer francium atomot is csapdába ejtettek, lézersugarakkal mágneses mezőben mérve azok tulajdonságait.
A Francium felhasználása
Kereskedelemben a franciát ritkasága és instabilitása miatt nem használják. Csak kutatási célokra használják.
Francium bomlás
A Francium 200 és 232 közötti tömegű izotópjai leggyakrabban alfa- vagy béta-bomláson mennek keresztül.
Íme néhány példa a francium bomlási útjaira:
A Francium-223 az elem leghosszabb élettartalmú izotópja. Felezési ideje 22 perc. Alfa-részecskét (héliummagot) bocsáthat ki az astatin-219 vagy béta-részecske rádium-223 képződéséhez. (A béta-részecske olyan elektron, amely akkor kerül ki a sejtmagból, ha egy neutron protonné alakul.)
A Francium-221 felezési ideje 5 perc. Alfa-részecskéket bocsáthat ki, hogy az asztatin-217-et képezzen, vagy béta-részecskéket, amelyekből rádium-221 válik.
A Francium-216 felezési ideje 0,7 mikroszekundum. Alfa-részecskéket bocsáthat ki az asztatin-212 vagy pozitronból a radon-216-ot.
A Francium-212 felezési ideje 19 perc. Alfa-részecskéket bocsáthat ki az astatin-208 képződéséhez, vagy orbitális elektront képes megkötni radon-212 képződéséhez. (2) (Az orbitális elektron befogása során a mag befogja az atom egyik saját elektronját és neutrínót bocsát ki.)
Bőség és izotópok
Bőséges földkéreg: ~ 0 millió per milliméter , ~ 0 milliméterrész
Bőséges napelemes rendszer: ~ 0 milliomodrész tömeg, ~ 0 rész / milliárd molonként
Tiszta költség: 100 gramm dollár
Költség, ömlesztve: 100 g / dollár
Forrás: A Francium természetes módon az aktinium alfa-radioaktív bomlása következtében fordul elő. ismertek, tömegük 200-232. Nincsenek stabilak. A 223Fr felezési ideje a leghosszabb, 21,8 perc.

- Konrad Roeder fotója
- EK Hyde, a. Ghiorso, G. T. Seaborg, Physical Review., 1950, 77, p655, 6. kiadás.
Idézze ezt az oldalt
Online linkeléshez másolja és illessze be az alábbiak egyikét:
<a href="https://www.chemicool.com/elements/francium.html">Francium</a>
vagy
<a href="https://www.chemicool.com/elements/francium.html">Francium Element Facts</a>
Ennek az oldalnak az idézésére egy tudományos dokumentumban használja a a következő MLA-kompatibilis idézet:
"Francium." Chemicool Periodic Table. Chemicool.com. 11 Jan. 2015. Web. <https://www.chemicool.com/elements/francium.html>.