Határok a sejtes és a fertőzéses mikrobiológiában
Bevezetés
A Staphylococcus aureus fontos kórokozó, amelyet világszerte kórházi betegekből izolálnak, és amely kórházi és közösségbeli fertőzéseket is okoz ( Lowy, 1998). Ez a kórokozó számos különböző szisztémás fertőzés etiológiai ágense, amely a bőrt és a lágy szövetet, valamint a mozgásszervi és keringési rendszert érinti (Lowy, 1998; Changchien et al., 2016). Beszámoltak arról, hogy a S. aureus túlélhet humán monocita eredetű makrofágokban (Kubica et al., 2008). A S. aureus virulenciája szorosan összefügg a baktériumok által termelt különféle enzimekkel és toxinokkal (Otto, 2014). A hemolizin, a leukocidin (Panton – Valentine leukocidin, PVL) és a toxikus sokk szindróma toxin-1 (TSST-1), amelyek elősegítik a vörösvértest membránjának károsodását, a leukociták fagocita funkciójának megrongálódását, és toxikus sokk szindróma kiváltását, kritikus fontosságúak a S. aureus kórokozó folyamatai (Löffler és mtsai, 2010; Vandenesch és mtsai, 2012; Berube és Bubeck Wardenburg, 2013; Andrey és mtsai, 2015; Al Laham és mtsai, 2015). A legújabb tanulmányok kimutatták, hogy a hemolizin is részt vesz az S. aureus biofilm képződésében (den Reijer et al., 2016). A multirezisztens S. aureus törzsek kórházi és közösségi környezetben való növekvő prevalenciája tovább növeli a S. aureus veszélyeit, és komoly kihívást jelent a klinikai terápia szempontjából (Voss és Doebbeling, 1995; Evangelista Sde és de Oliveira, 2015).
Nemrégiben kórházunkban számos, a hiányos hemolitikus fenotípussal (SIHP) rendelkező S. aureus osztályba tartozó törzset találtak. Az ezen SIHP törzsek által okozott hemolízis szignifikánsan különbözik a többi S. aureus törzsben termelt teljes hemolitikus gyűrűtől (β-hemolitikus fenotípus). Ezeket a SIHP törzseket azonban még nem sikerült azonosítani és átfogóan jellemezni. Ezen SIHP törzsek mikrobiológiai jellemzőinek feltárása érdekében 60 SIHP törzset gyűjtöttünk össze, és több kritérium alkalmazásával tanulmányoztuk őket, beleértve a hemolitikus fenotípust, a hemolizin gén expresszióját, a gyógyszerrezisztencia jellemzőit és a virulenciát. Ez a tanulmány azt mutatja, hogy a SIHP-k meticillin-rezisztens törzsek, amelyek nagy mértékben expresszálják a β-hemolizint és nagy virulencia-potenciállal rendelkeznek.
Anyagok és módszerek
Baktériumtörzsek
Hatvan SIHP törzseket izoláltak a Soochow Egyetem második kapcsolt kórházába 2013 és 2015 között felvett betegekből. Minden betegből két mintát vettünk elemzés céljából. Ezeket az izolátumokat azután Columbia juhvér agar lemezeken (CHROMagar Company, Shanghai, Kína) tenyésztettük 35 ° C-on, 5% CO2 (v / v) atmoszférában. A törzsek S. aureus-ként való azonosítását a Phoenix-100 automatizált mikrobiológiai rendszer (Becton, Dickinson and Company, USA) segítségével igazoltuk. A kontroll S. aureus törzseket teljes hemolitikus fenotípussal izoláltuk kórházunkban lévő betegektől ugyanabban az időszakban. Itt a teljes hemolitikus fenotípussal rendelkező S. aureust SCHP törzseknek neveztük. Az S. aureus ATCC25923 referencia törzs (Sanghaji Klinikai Laboratórium, Kína) teljes hemolitikus fenotípussal rendelkezik, és kontrolltörzsként is működött. A Soochow Egyetem Második Kapcsolódó Kórházának Orvosi Etikai Bizottsága jóváhagyta ezt a vizsgálatot, és az összes izolátumot a beteg beleegyezésével gyűjtötték össze.
A hiányos hemolitikus fenotípus összehasonlító elemzései
A S. aureus törzseket tenyésztettünk különböző vállalatok (CHROMagar, Autobio Diagnostics Co., Ltd., Kína és BioMérieux, Kína) kereskedelmi véragar lemezein, valamint Columbia véragar por (OXIDE, Egyesült Királyság) felhasználásával készített saját készítésű juhvér agar lemezeken. A baktériumokat tenyésztettük 35 ° C-on, 5% CO2 (v / v) tartalmú atmoszférában 24 órán át, majd sorozatos passzáláson mentek keresztül. Ezután megfigyelték a hemolitikus jelenséget. Klinikailag izolált, teljes hemolitikus fenotípussal rendelkező törzseket és az ATCC25923 referencia törzset is megfigyeltünk kontrollként összehasonlító elemzésekhez.
S. aureus négy hemolizin génjének mRNS-szintjének meghatározása fordított transzkripcióval, valós idejű mennyiségi PCR (qPCR)
A SIHP-ből és az ATCC25923 referencia törzsből a teljes RNS-extrakciót a korábban leírtak szerint végeztük (Qin et al., 2014). Kezdetben a sejteket lizosztafin, lizozim és proteináz K. alkalmazásával lizáltuk. Az RNS-t ezután RNeasy Mini Kit (Qiagen) alkalmazásával extraháltuk és tisztítottuk a gyártó ajánlása szerint. Az RNS minőségét és koncentrációját a NanoDrop1000 alkalmazásával értékeltük. – a gyártó utasításainak megfelelően reverz transzkripciós készlet (Thermo Fisher Scientific Inc., USA) segítségével átírjuk cDNS-be.Röviden a qPCR-t a következőképpen hajtottuk végre: elődenaturálás 94 ° C-on 3 percig, denaturálás 94 ° C-on 30 másodpercig, izzítás 52 ° C-on 30 másodpercig, megnyúlás 72 ° C-on 40 másodpercig, összesen 45 ciklus . Minden mintának három technikai és három biológiai ismétlése volt. A négy hemolizin gén és a 16s rRNS gén transzkripciós profilját 2-ΔΔCt módszerrel határoztuk meg. A transzkripció szintjét a 16s rRNS gén expressziójához viszonyítva határoztuk meg. Négy hemolizin gén (hla, hlb, hlgC és hld) szekvenciáját a GenBank adatbázisból nyertük le. A primerek tervezéséhez Primer 5.0 szoftvert használtunk (1. táblázat), ezeket a primereket a Sangon Biotech Co., Ltd. (Sanghaj, Kína) szintetizálta.
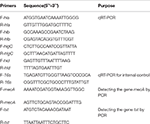
1. táblázat. A tanulmányban használt alapozók.
Az adatok elemzéséhez az SPSS 17.0 verziót használták. A mérési adatokat x̄ ± s formában mutatjuk be. Két független minta T-tesztjét használtuk a négy hemolizin gén mindegyikének relatív expressziójának összehasonlításához. A statisztikai szignifikanciát p < 0,05 értékkel határoztuk meg.
Az α-hemolizin (Hla) expressziójának detektálása Western Blot segítségével
A SIHP-t és az S. aureus ATCC25923 referencia törzset 5,0 McFarland értékre állítottuk be egy zavarosságmérővel. Ezután az összes mintából kivontuk az összes fehérjét, azonos koncentrációra állítottuk be, és elektroforézist végeztünk SDS-PAGE gélen. A fehérjéket ezután nitrocellulóz membránra vittük, és a membránt 5% sovány tejjel blokkoltuk 1 órán át. Kecske anti-staphylococcus α-hemolizin poliklonális antitesteket (Abcam) adtunk hozzá 2 μg / ml végkoncentrációban. A reakcióelegyet ezután egy éjszakán át 4 ° C-on inkubáltuk. Miután a membránt megmostuk, 1: 1000 hígított HRP-jelölt nyúl anti-kecske IgG antitesteket adtunk hozzá és inkubáltuk 37 ° C-on 2 órán át. Végül kemilumineszcens szubsztrátumokat adtunk a színfejlődéshez. Az α-hemolizin expresszióját végül a képalkotó alatt figyeltük meg.
A SIHP antimikrobiális érzékenységének vizsgálata
Az antimikrobiális érzékenységi szűrés elvégzéséhez a mikrotiter leves hígítási módszert alkalmazták. Az eljárást a Phoenix-100 automatizált mikrobiológiai rendszer üzemeltetési kézikönyve szerint hajtották végre. Ennek a szűrésnek az eredményeit a Klinikai és Laboratóriumi Intézet (CLSI; Clinical and Laboratory Standards Institute, 2014) által bevezetett M100-S24 kritériumok alapján értelmezték. A meticillin-rezisztens S. aureus (MRSA) státust két antibiotikum MIC (minimális gátló koncentráció) alkalmazásával határoztuk meg. A SIHP törzseknél ≥4 μg / ml volt az oxallicin MIC-értéke, és ≥8 μg / ml volt a cefoxitin MIC-je.
mecA és tst gének kimutatása
Mind a 60 SIHP törzseket teszteltük a mecA gyógyszer-rezisztencia gén és a virulencia gén tst. A genomi DNS forrásban történő extrahálását a lizosztafint alkalmazó sejtlízist követően hajtottuk végre. Ezután a mecA és a tst géneket amplifikáltuk a genomi DNS-ből a DreamGreen Taq kit segítségével. A PCR-körülmények a következők voltak: elődenaturálás 94 ° C-on 3 percig, denaturálás 94 ° C-on 30 másodpercig, izzítás 50 ° C-on 30 másodpercig, meghosszabbítás 72 ° C-on 1 percig. A PCR termékeket szekvenáltuk és a BLAST elemezte, hogy a várt termékeknek bizonyuljanak. A mecA gyógyszer-rezisztencia gén és az S. aureus virulencia gén szekvenciáit a GenBank adatbázisból szereztük be. A primerek tervezéséhez Primer 5.0 szoftvert használtak (1. táblázat), ezeket a primereket a Sangon Biotech Co., Ltd. (Shanghai, Kína) szintetizálta.
S. aureus SIHP törzsek túlélésének detektálása Makrofágok
A makrofágokban lévő S. aureus SIHP törzsek túlélésének összehasonlítása a tst negatív S. aureus SCHP törzsek túlélésével, a THP-1 humán monocita sejtvonalat 10% (v / v) FBS 37 ° C-on 5% (v / v) CO2-ot tartalmazó atmoszférában. Makrofágfertőzés céljából a THP-1 sejteket lyukanként 5×105 sejttel oltottuk 24 üreges szövettenyésztő csészékbe, és 10-7 M phbolbol 12-mirisztát 13-acetáttal (PMA) 48 órán át differenciálódásra indukáltuk őket. A logaritmikus fázisú (OD600 0,5–0,6) baktériumokat kb. 3 × 108 kolóniaképző egységet (CFU) centrifugálással ülepítettük, kétszer PBS-sel mostuk és 1 ml RPMI-1640-ben szuszpendáltuk. Ezután baktériumokat adtunk a sejtréteghez 20: 1 MOI mellett, és 5 percig 1000 fordulat / perc sebességgel centrifugáltuk. A fertőzött sejteket 20 percig 37 ° C-on inkubáltuk, majd háromszor mostuk előmelegített PBS-sel (pH 7,4), és további 1 órán át inkubáltuk 100 ug / ml gentamicint tartalmazó táptalajban az extracelluláris baktériumok elpusztítása érdekében. A sejteket mostuk és lizáltuk, hogy az intracelluláris baktérium mint nulla időminta (T0) mennyiségileg meghatározható legyen. További sejteket gyűjtöttünk 12 vagy 24 órás inkubálás után, 12 μg / ml gentamicint tartalmazó friss, kiegészített szövet-táptalaj jelenlétében.A baktériumok szaporodását a THP-1 sejtekben úgy határoztuk meg, hogy a 12 vagy 24 órás intracelluláris baktériumok számát elosztottuk a 0 időpont számával (T12 / T0 vagy T24 / T0). A kísérletet háromszor egymástól függetlenül megismételtük.
S. aureus SIHP törzsekkel fertőzött makrofágok citokin-szekréciójának kimutatása
A baktériumokkal 12 órán át fertőzött THP-1 makrofágok tenyészet felülúszóit összegyűjtött. A citokinszinteket FACSCalibur flow citometriával (BD) mértük CBA Human Thl / Th2 Cytokine Kit II (BD) alkalmazásával, a gyártás utasításai szerint.
Multilocus Sequence Typing and Analysis
Eredmények
SIHP törzsek hemolitikus fenotípusa juh-agar vérlemezeken
Amint az 1A, B ábrákon látható, a teljes hemolitikus gyűrűt (β-hemolitikus fenotípus) figyelték meg az S kontrollban . aureus törzsek, miután a törzseket véragar lemezeken 24 órán át tenyésztettük. A SIHP törzsekben azonban különböző hemolitikus fenotípusok (itt hiányos hemolitikus fenotípusnak nevezhetők) jelentek meg. Ezenkívül a hiányos hemolitikus fenotípus megfigyelhető volt a különböző környezeti körülmények között nőtt SIHP törzsekben. állapotok, beleértve a mikroaerofil, aerob és anaerob állapotokat (1C – E. ábra). Ezenkívül 10 soros passzálás után ez a hiányos hemolitikus fenotípus továbbra is fennmaradt (1F. ábra).
Relatív Négy hemolizin gén mRNS expressziós szintje
Amint a 2. ábra mutatja, a négy hemolizin gén hla, hlb, hlgC és hld expressziós szintjei SCHP törzsekben nem mutattak statisztikailag szignifikáns különbséget (p > 0,05) összehasonlítva az ATCC25923 kontroll törzsekével. Azonban a hla, a hlgC és a hld expressziós szintjét a SIHP törzsekben szignifikánsan elnyomta 50-, 16,7- és 8,3-szoros (p < 0,05), összehasonlítva a kontroll ATCC25923 és SCHP törzsek, míg a hlb expressziója SIHP törzsekben szignifikánsan 7,7-szeresére nőtt a kontrollokhoz képest (p < 0,05).
Az α-hemolizin detektálása Western Blot segítségével
Az α-hemolizin által kódolt a gén hla a S. aureus által kiválasztott pórusképző toxin, amelynek molekulatömege 33 kDa (Andrey és mtsai, 2015; Al Laham és mtsai, 2015). Western-blot analízis azt mutatta, hogy az a-hemolizin expressziója SIHP törzsekben 40-szer alacsonyabb volt, mint az SCHP és a kontroll törzseké, ami összhangban van a qRT-PCR adatokkal (3. ábra).

3. ábra: az a-hemolizin Western blotja S. aureusban. ATCC29213: S. aureus kontroll a teljes hemolitikus fenotípussal; SCHP: S. aureus a teljes hemolitikus fenotípussal, amelyet klinikai mintákból izoláltak ugyanabban az időszakban; SIHP: S. aureus hiányos hemolitikus fenotípussal.
A SIHP gyógyszerrezisztenciája
Tesztelt gyógyszerérzékenység mikrotitráló leves hígításokkal kimutatták, hogy az oxacillin és a cefoxitin MIC-értékei > 2 és > 8 μg / ml voltak 60 SIHP-foltban . A CLSI M100-S24 irányelvek szerint mind a 60 SIHP törzs MRSA törzsnek minősül. A PCR mind a 60 törzsben kimutatta a mecA gént is.
A tst gén vizsgálata
A tst gén fontos virulencia faktor a S. aureus-ban. A PCR kimutatta, hogy mind az 50 SIHP törzs tartalmaz tst gént.
A S. aureus SIHP törzsek túlélési képessége makrofágokban nagyobb, mint a negatív S. aureus
a SIHP törzsek és a tst negatív SCHP törzs intracelluláris túlélési képességei a makrofágokban. A lemezekről kinyert baktériumok számának megszámlálásával azt tapasztaltuk, hogy a SIHP törzs intracelluláris túlélési képessége jóval magasabb, mint a tst negatív S. aureus törzsé 12 vagy 24 óra fertőzött THP-1-ből származó makrofágok után (4. ábra). Előzetesen feltételeztük, hogy a SIHP törzsek potenciálisan magas virulenciával bírnak, és azt javasolták, hogy a SIHP-t nagyobb figyelmet kell fordítani a kórházban.
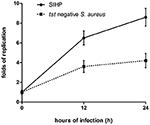
4. ábra A SIHP törzsek és a tst negatív S. aureus túlélése THP-1-ből származó makrofágokban. Miután a makrofágokat 12 és 24 órán át baktériumokkal fertőztük, a makrofágokat lizáltuk, és az intracelluláris túlélő baktériumokat LB agarra helyeztük. Az intracelluláris túlélő baktériumok replikációs redőit a fenti LB agarlemezen található telepszámok alapján számítottuk ki.
A szekréció különbségei S. aureus SIHP törzsek és tst negatív S. aureus fertőzött citokinek és kemokinek csoportja
A citokinek és kemokinek szekréciós különbségeinek összehasonlítása a SIHP törzs által fertőzött THP-1 eredetű makrofágokban és a tst negatív S.aureus törzsben, pro-gyulladásos citokineket áramlási citometriával detektáltunk a SIHP törzsekkel és a tst negatív S. aureus törzsekkel fertőzött makrofágok tenyészet felülúszójában. Az eredmények szignifikánsan magasabb IL-2, IL-6 és IL-17A indukciót mutattak a SIHP törzsekben, de nem tst negatív S. aureus által, ami arra utal, hogy az SIHP törzsek citokin / kemokin válaszokat indukálnak a makrofágokban (5. ábra). A makrofágok által kiválasztott többi IL-4, IL-10, INF-γ és TNF citokin nem volt nyilvánvaló különbség a SIHP törzsek és a tst negatív S. aureus érintett csoportok között.
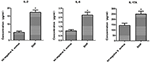
5. ábra Az S. aureusszal fertőzött makrofágok által kiválasztott citokinek és kemokinek kimutatása. * P < 0,05.
Többfókuszú szekvencia beírása
Meghatároztuk a kórházunkban 2013 és 2014 között felvett betegektől összegyűjtött 60 SIHP izolátum multilokusz genotípusát. Az S. aureus MLST adatbázisban ajánlott hét lokuszos sémát alkalmaztuk. Az MLST elemzés azt mutatta, hogy az összes SIHP törzset ST5 klónba sorolták.
Megbeszélés
A hemolizin az egyik legfontosabb virulencia faktor S. aureus számára (Wiseman, 1975). A négyféle hemolizin együttes hatása a vörösvértest membránjának pusztulását eredményezi, ami a teljes átlátszó hemolitikus gyűrű kialakulásához vezet a véragar lemezeken. Az elmúlt években SIHP-t találtak a Soochow Egyetem második kapcsolt kórházának klinikai mintáiban. Ebben a tanulmányban arra törekedtünk, hogy azonosítsuk ezeket a törzseket és tanulmányozzuk azok jellemzőit a mikrobiológiában. Kezdetben különböző kereskedelmi vagy saját készítésű juhvér agar lemezeket alkalmaztunk a törzsek izolálására, inkubálására és egymás utáni áthaladására. Kimutattuk, hogy vannak olyan törzsek, amelyek hosszan tartó szubkultúra után is hiányos hemolitikus fenotípust mutatnak és tartanak fenn. Így kizárható annak lehetősége, hogy ezt a fenotípust nem bakteriális tényezők indukálják. Vizsgálataink szerint a SIHP lehet az egyedi S. aureus törzsek részhalmaza.
Korábbi tanulmányok szerint a nyúl vörösvértestjei nagyon érzékenyek az α-hemolizinre (Hildebrand et al., 1991). Berube és mtsai. számoltak be arról, hogy az α-hemolizin hatása a vörösvértestek lízisére koncentrációfüggő (Berube és Bubeck Wardenburg, 2013). A γ-hemolizin károsíthatja az emberek és állatok vörösvértestjeit (Kaneko és Kamio, 2004). Míg a δ-hemolizin csak nagy koncentrációban károsítja a vörösvérsejteket, transzmembrán pórusokat képez, amelyek lizálják a sejtmembránt (Verdon et al., 2009). Ebben a tanulmányban megmutattuk, hogy a SIHP és SCHP törzsek négy hemolizinjének expressziója szignifikánsan eltérő transzkripciós expressziós profillal rendelkezik. Az α-, γ-, δ-hemolizin expressziója a SIHP törzsekben, amely közvetlenül károsíthatja a vörösvértesteket, sokkal alacsonyabb, mint az SCHP törzseké, míg a β-hemolizin expressziós szintje jóval magasabb az SCHP törzsekhez képest. Ezenkívül az a-hemolizin fehérje expressziós szintjét tovább validáltuk Western-blot segítségével. Beszámoltak arról, hogy a β-hemolizin túlnyomórészt növeli a vörösvérsejtek érzékenységét más toxinokkal szemben, a sejtek közvetlen lizálása helyett, hacsak a sejteket nem tenyésztik alacsonyabb hőmérsékleten (Vandenesch és mtsai, 2012). Ebben a tanulmányban a β-hemolizin magas expresszióját detektálták a SIHP törzsekben, de a teljes hemolitikus gyűrűt soha nem figyelték meg az SIHP törzsekben, még akkor sem, ha 4 ° C-on inkubálták. Ezek az eredmények arra engednek következtetni, hogy a SIHP törzsek megfigyelt hiányos fenotípusa valószínűleg mind a négy hemolizin hatása, amelyek más módon expresszálódnak az SCHP törzsekhez képest. Korábbi tanulmányok kimutatták, hogy a krónikus patogenezis során az antibiotikumokból, köztük a ciprofloxacinból és a trimetoprimból eredő szelektív nyomás, valamint a gazda immunválasz együttes hatása az a-hemolizin fokozott expressziójához vezethet, ami nagyon fontos az S kolonizációja szempontjából. aureus a nyálkahártyában, különösen légúti fertőzések esetén (Goerke et al., 2006; Huseby et al., 2010). Ebben a tanulmányban az összes SIHP-vel fertőzött beteg hosszú távú széles spektrumú antibiotikum-kezelést kapott, függetlenül attól, hogy ez a szelektív nyomás a gyógyszerrezisztens gének túlzott expresszióját indukálta-e, és zavarta-e a hemolizin gének expresszióját vizsgálat.
A SIHP mikrobiológiai jellemzőinek feltárásához antimikrobiális érzékenységi teszteket hajtottunk végre, és a S. aureus patogenitásával összefüggő virulencia gént választottuk. Megállapítottuk, hogy mind a 60 SIHP törzs besorolható MRSA törzsek közé, és hordozhatják a mecA gént. Az antimikrobiális érzékenységi vizsgálatok eredményei azt mutatták, hogy e 60 SIHP törzsből 10 passzálás után is csak három SIHP törzs linezolid és teicoplanin MIC-értéke változott.A MIC-értékek ezen változásai azonban nem befolyásolták az antimikrobiális érzékenység eredményeinek értékelését. A tst virulencia gén toxikus sokk szindróma toxint (TSST-1) kódol (Kreiswirth, 1989). Szuper antigénként a TSST-1 fokozza az endotoxinok által kiváltott sokk- és immunszuppressziós válaszokat (Kulhankova et al., 2014). A PCR-vizsgálatok azt találták, hogy mind a 60 SIHP törzs rendelkezik a tst génnel, ami fokozott virulenciára utal. Nemrégiben számos jelentés kimutatta, hogy a S. aureus túlélheti az emberi monocita eredetű makrofágokat, és ezek a S. aureus törzsek virulensebbek (Kubica et al., 2008; Tranchemontagne et al., 2015; Münzenmayer et al., 2016; Nandi és Bishayi, 2016). Ezért összehasonlítottuk az SIHP törzsek és az SCHP törzsek intracelluláris túlélési képességeit, amelyek makrofágokban tst negatív S. aureus, és azt találtuk, hogy a SIHP törzs intracelluláris túlélési képessége sokkal magasabb, mint a tst negatív S. aureus törzsé. Ezenkívül a betegadatok elemzése kimutatta, hogy a SIHP törzsekkel fertőzött betegek többségénél az antiinfektív terápia hatása rosszabb volt, mint a hasonló, SCHP törzsekkel fertőzött betegeké (az adatokat nem közöljük). Vizsgálatunk előzetes kísérleti bizonyítékot szolgáltat arra a spekulációra vonatkozóan, hogy a SIHP törzsek potenciálisan magas virulenciával bírnak. a neutrofilek és makrofágok, valamint a gyulladásgátló citokinek, nevezetesen a TNF-α, az IL-1β és az IL-6 termelése (Bekeredjian-Ding et al., 2015; Giai et al., 2016; Zhao et al., 2016 ). Beszámoltak arról, hogy az IL-6 gyulladásos citokinek szekréciója az S. aureus növekvő koncentrációjával nőtt (Chen és mtsai, 2016). Ezenkívül a szuperantigén S. aureus különösen hatékony az IL-17 termelés stimulálásában (Islander és mtsai, 2010). Ebben a tanulmányban az SIHP törzsek szignifikánsan magasabb IL-2, IL-6 és IL-17A indukciót mutattak a makrofágokban, mint a tst negatív SCHP törzsek, ami arra utal, hogy az SIHP törzsek nagyobb mértékű citokinek szekréciót indukálhatnak a makrofágok ölő hatása ellen. Ezenkívül az MLST elemzés azt mutatta, hogy az összes SIHP törzset ST5 klónba sorolták. Ezen túlmenően ezeket a SIHP törzseket a t2460 spa típusba csoportosítottuk (az adatokat nem közöljük).
Összességében a SIHP az MRSA új alcsoportja lehet, potenciálisan magas virulenciájú, és nagyobb figyelmet kell fordítani a ezeknek a törzseknek a kezelése és kezelése a kórházakban.
Szerzői közreműködések
Nyilvántartás az összeférhetetlenségről
A szerzők kijelentik, hogy a kutatást kereskedelmi jellegű adatok hiányában végezték. vagy pénzügyi kapcsolatok, amelyek potenciális összeférhetetlenségként értelmezhetők.
Köszönetnyilvánítás
Ezt a tanulmányt a Kínai Nemzeti Természettudományi Alapítvány (81572032, 81401636), a Természettudományi Intézet támogatta. Jiangsu tartomány főiskoláinak és egyetemeinek alapítványa (16KJB320006), valamint Suzhou tudományos és technológiai programja (SYSD2014094, SYS201551, SS201638).
Klinikai és laboratóriumi Szabványügyi Intézet (2014). M100-S24 antimikrobiális érzékenység-tesztelési teljesítménystandardok; Huszonnegyedik tájékoztató kiegészítés. Wayne, Pennsylvania: CLSI.
Nandi, A. és Bishayi, B. (2016). A fagocitózis után intracellulárisan túlélett Staphylococcus aureus virulensebb citotoxicitást vált ki friss egér peritoneális makrofágokban, TLR-2-t használva lehetséges célpontként. Mikrobás. Pathog. 97, 131–147. doi: 10.1016 / j.micpath.2016.06.007
PubMed Abstract | CrossRef teljes szöveg | Google Tudós
Wiseman, G. M. (1975). A Staphylococcus aureus hemolizinjei. Bacteriol. Rev. 39, 317–344.
PubMed Abstract | Google Tudós