Kadmiumelem tények
A kadmium kémiai elem átmenetifémnek minősül. 1817-ben fedezte fel Friedrich Stromeyer.

Adatzóna
| Besorolás: | Kadmium átmenetifém |
| Szín: | kékesfehér |
| Atomsúly: | 112.41 |
| Állapot: | szilárd |
| Olvadáspont: | 321,1 oC, 594,3 K |
| Forráspont: | 765 oC, 1038 K |
| Elektronok: | 48 |
| Protonok: | 48 |
| Neutronok a legelterjedtebb izotópban: | 66 |
| Elektronhéjak: | 2,8,18,18,2 |
| Elektronkonfiguráció: | 4d10 5s2 |
| Sűrűség @ 20oC: | 8,65 g / cm3 |
Mutasson többet, többek között: hő, energia, oxidáció, reakciók,
vegyületek, sugarak, Vezetőképesség
| Atomtérfogat: | 13,1 cm3 / mol |
| Felépítés: | hcp: hatszögletű bezárva csomagolva |
| Keménység: | 2.0 mohs |
| Fajlagos hőkapacitás | 0,23 J g-1 K-1 |
| Fúziós hő | 6,192 kJ mol-1 |
| porlasztás hője | 112 kJ mol-1 |
| párolgási hő | 99,87 kJ mol-1 |
| 1. ionizációs energia | 867,7 kJ mol-1 |
| 2. ionizációs energia | 1631,4 kJ mol-1 |
| 3. ionizációs energia | 3616,2 kJ mol-1 |
| Elektron affinitás | – |
| Minimális oxidációs szám | 0 |
| Min. általános oxidációs sz. | 0 |
| Maximális oxidációs szám | 2 |
| Max. általános oxidáció sz. | 2 |
| Elektronegativitás (Pauling-skála) | 1,69 |
| Polarizálhatóság térfogat | 7.2 Å3 |
| Légi reakció | enyhe, w / ht ⇒ CdO |
| Reakció 15 M HNO3-val | enyhe ⇒ Cd (NO3) 2, NOx |
| Reakció 6 M HCl-lel | enyhe, ⇒ H2, CdCl2 |
| Reakció 6 M NaOH-val | nincs |
| oxid (s) | CdO, CdO2 |
| Hidrid (ek) | CdH2 |
| Klorid (ok) | CdCl2 |
| Atomsugár | 151 pm |
| Ionos sugár (1+ ion) | – |
| Ionos sugár (2+ ion) | 109 pm |
| Ionos sugár (3+ ion) | – |
| Ionos sugár (1-ion) | – |
| Ionos sugár (2-ion) | – |
| Ionos sugár (3-ion) | – |
| átlagos vezetőképesség | 96,6 W m-1 K-1 |
| Elektromos vezetőképesség | 14,7 x 106 S m-1 |
| Fagyás / olvadáspont: | 321,1 oC, 594,3 K |

Kis kadmiumgömb, érmével a méretreferenciához.

Friedrich Stromeyer, aki 1817-ben fedezte fel a kadmiumot.
Kadmium periódusos rendszerének szomszédsága
| csoport 11 |
12. csoport | 13. csoport | |
| 4 | 29 Cu |
30 Zn |
31 Ga |
| 5 | 47 Ag |
48 Cd |
49 In |
| 6 | 79 Au |
80 Hg |
81 Tl |
A kadmium felfedezése
A kadmiumot Friedrich Stromeyer német vegyész fedezte fel 1817-ben a cink-oxid szennyeződéseként. (1)
Stromeyer a kormány felkérését követően fedezte fel, hogy vizsgálja meg a németországi Hildesheim város gyógyszertárait.
Azokban a napokban cink-oxidot használtak, ahogy jelenleg is, a bőrbetegségek kezelésére. Valamilyen oknál fogva a Hildesheim gyógyszertárai cink-karbonátot adnak el, nem pedig a szokásos cink-oxidot.
Stromeyer tisztában volt azzal, hogy a cink-karbonát vörös forróságig történő melegítésével oxiddá alakul. Ezt a gyógyszertárak mintáival tette. Megállapította, hogy a ragyogó fehér karbonát oxidokká vált, amelynek fehérnek kellett volna lennie, de valójában sárga / narancssárgának.
Ez a szín általában vas- vagy ólomszennyeződésre utal, de Stromeyer nem talált nyomot ezekből az elemekből.
Felkereste a salzgitteri gyárat, ahol a gyógyszertárak megvették a cink-karbonátot. Megkérdezte, miért árulnak cink-karbonátot a szokásos oxid helyett.
A menedzser elmagyarázta neki, hogy cink-karbonátjuk a várt szín – fehér – és könnyen eladható.
Amikor a karbonátot melegítéssel oxidává próbálták átalakítani, mindig sárga lett. Mivel a cink-oxidnak fehérnek kell lennie, nem tudták eladni. Gondosan megvizsgálták a vas-szennyeződéseket, de nem találtak ilyet.
Stromeyer ezután úgy döntött, hogy ő maga gondosan elemzi ezt a sárga cink-oxidot. Úgy találta, hogy a sárga színt “különös fémoxid jelenléte okozta, amelynek létezésére eddig nem volt gyanú”.
Ezt az új fémoxidot kivonta a cink-oxidból, majd redukálta, hogy izolálja a világ első kadmiumfémjét. Megjelenését a platinához hasonlította, sűrűségét pedig 8,75 g / cm3-nek mérte – nagyon közel a maihoz elfogadott érték.
További munkát végzett, és megállapította, hogy más cinkvegyületek is tartalmazzák új fémet. Elemezte a „tiszta” cinkfémet, és megállapította, hogy új féme még ebben is jelen van.
Becslése szerint az új fém 0,1% és 1% között volt a cinkben és vegyületeiben, amelyekből 3 gramm tiszta kadmiumfémet tudott elkülöníteni.
Stromeyer a kadmium nevét javasolta. A „cadmia” után a calamine latin neve. A calamine a cinkérc régi neve.
A kadmiumot Karl Hermann német kémikus fedezte fel 1818-ban. Hermann váratlan sárga színt észlelt a cink-szulfidban. Feltételeztük, hogy a sárga arzénszennyeződésekből származik, de Hermann rájött, hogy valójában egy korábban ismeretlen elének köszönhető. ment. (2)


A kadmium-teluridot vékony film napelemek készítésére használják, amelyek képesek elnyeli a látható fény több mint 90% -át. Kép: NREL
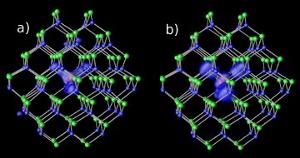
Magnézium-szennyeződések kadmium – szelén nanokristályokban két különböző résszinten : (a) rezonáns és (b) hibrid. Kép: NERSC
Megjelenés és jellemzők
Káros hatások:
Kadmium és vegyületei erősen mérgező.
Jellemzők:
A kadmium egy puha, alakítható, képlékeny, kékesfehér fém, amelyet késsel könnyen lehet vágni. Kiváló elektromos vezető, és jól ellenáll a korróziónak és a vegyi anyagok hatásának.
Kémiai tulajdonságai sok tekintetben hasonlóak a cinkhez.
A kadmium beszennyeződik a levegőben, és savakban oldódik, de lúgokban nem.
A fém a levegőben égve barna kadmium-oxidot (CdO) képez.
Kadmium felhasználása
A kadmium fő felhasználási területe akkumulátorokban (különösen újratölthető nikkel-kadmium, NiCad, akkumulátorok).
Az alacsony súrlódási együttható és a magas fáradtságállósága következtében a kadmiumot a csapágyak ötvözeteiben használják. A kadmiumot alacsony olvadáspontú ötvözetekben használják, és sokféle forrasztóanyag alkotóeleme. Galvanizáláshoz is használják.
A kadmiumot tartalmazó vegyületeket fekete-fehér televíziós foszforokban, a kék és zöld foszforokban pedig színes televíziós képcsöveknél használják. A kadmium-szulfidot sárga pigmentként, a kadmium-szelenidet pedig piros pigmentként használják, gyakran kadmiumvörösnek.
A kadmium és a tellúr olyan CdTe vékonyfilm-fotovoltaikus modulokba keverhető, amelyek fizikai jellemzői ideálisak napelem termelés. Viszonylag alacsony költségűek, és szinte tökéletes sávszélességük van a napenergia-betakarításhoz.
Bőség és izotópok
Bőséges földkéreg: 150 tömegrész milliárd, molban 30 rész / milliárd
Bőséges napelemes rendszer: 6 milliomodrész tömeg, mólonként 70 billió milliárd rész
Tiszta költség: 46 USD / 100 g
Költség, ömlesztve: 0,77 USD 100 g-ra
Forrás: A kadmium leggyakrabban kis mennyiségben fordul elő cinkércekhez, például szfalerithez (ZnS) társulva. A Greenockite (CdS) az egyetlen kadmium ásvány, amelynek bármilyen következménye van. Szinte az összes kadmium a cink-, réz- és ólomérc-finomítási műveletek mellékterméke.

- Friedrich Stromeyer, Annals of Philosophy, szerkesztette Thomas Thomson, XIII. kötet, 1819., Robert Baldwin, 108. o.
- JW Mellor, Átfogó értekezés a szervetlen és elméleti kémiában, IV. Kötet, 1929., Longmans, Green and Co. Ltd., 404. o.
Idézd ezt az oldalt
Online linkeléshez , kérjük, másolja és illessze be a következők egyikét:
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium</a>
vagy
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium Element Facts</a>
idézze ezt az oldalt egy tudományos dokumentumban, kérjük, használja a következő MLA-kompatibilis idézetet:
"Cadmium." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cadmium.html>.