Megoldások
ColligativeProperties
Gőznyomás-csökkentés
A fizikai tulajdonságok két kategóriába sorolhatók. A kiterjedt tulajdonságok (például tömeg és térfogat) a minta méretétől függenek. Az intenzív tulajdonságok (például a sűrűség és a koncentráció) az anyag jellemző tulajdonságai, nem függenek a vizsgált minta méretétől. A Thissection bemutat egy harmadik kategóriát, amely a rendszer intenzív tulajdonságainak részhalmaza. Ez a harmadik kategória, más néven kolligativ tulajdonságok, csak megoldásokra alkalmazható. Az általános meghatározás, az oldat egyik tulajdonsága a kolligativ tulajdonság, ha az csak az oldott anyag és az oldószer részecskéinek számától függ, és nem az oldott anyag azonosságától.
A megoldás fizikai tulajdonságai közül nagyon kevés arekolligatív tulajdonság. Fizikai tulajdonságainak korlátozott halmazának példájaként vegyük figyelembe, hogy mi történik az oldószer gőznyomásával, amikor oldott anyagot adunk az oldathoz. Meghatározzuk Po-t a tiszta folyadék gőznyomásaként ![]() az oldószer
az oldószer ![]() és P, mint az oldószer gőznyomása az oldott anyag hozzáadása után.
és P, mint az oldószer gőznyomása az oldott anyag hozzáadása után.
Po = a tiszta folyadék vagy oldószer gőznyomása
P = az oldószer gőznyomása oldatban
Amikor a folyadék hőmérséklete alacsonyabb, mint a forrás pontban feltételezhetjük, hogy az egyetlen molekula, amely a fólifolyadékból gázképződés céljából el tud menekülni, az a molekula, amely a hígfolyadék felszíne közelében fekszik.
Ha oldott anyagot adunk az oldószerhez, az egyes szolutemolekulák a folyadék felszíne közelében lévő helyet foglalják el, amelyet az alábbi ábra mutat be. Ha egy oldott anyagot oldószerben oldunk, az oldószermolekulák száma a felület közelében csökken, és az oldószer gőznyomása csökken.

Ez nincs hatással arra, hogy milyen sebességgel kondenzálódnak az oldószermolekulák a gázfázisban folyadékká. De csökken, amikor a folyadékban lévő oldószermolekulák eljuthatnak a gázfázisból. Ennek eredményeként az oldatból kiáramló oldószer gőznyomásának kisebbnek kell lennie, mint a tiszta oldószer gőznyomása.
| P | < | Po | ||
| gőznyomás oldószer – oldat felett |
a tiszta oldószer gőznyomása |
1887 és 1888 között Francois-Marie Raoult kimutatta, hogy az oldat párologási nyomása megegyezik az oldószer mólfrakciójának és a tiszta folyadék gőznyomásának szorzatával.
| P | = | Csolvent Po | ||||
| gőznyomás |
gőznyomása |
Ez az egyenlet, amelyet Raoult törvényének nevezünk, könnyen érthető. Ha az oldószer tiszta, és az oldószer molefrakciója egyenlő 1-vel, P egyenlő Po-val. Amint az oldószer moláris része kisebb lesz az oldatból kilépő oldószer gőznyomása is kisebb lesz.
Tegyük fel, hogy jelenleg az oldószer az egyetlen komponense az oldatnak, amely elég illékony ahhoz, hogy mérhető gőznyomása legyen. Ha ez igaz, akkor az oldat gőznyomása megegyezik az oldatból távozó oldószer gőznyomásával. Raoult törvénye szerint a tiszta oldószer gőznyomásának és az oldatnak a különbsége növekszik, amikor az oldószer mólfrakciója csökken.
Az a gőznyomás változása, amely akkor következik be, amikor az aszolvátot oldószerhez adják, ezért kolligatív tulajdonság. Ha ez az oldott anyag mol frakciójától függ, akkor annak az oldatban lévő oldott tosz oldószer részecskéinek arányától kell függenie, de nem az oldott anyag azonosságától.
![]()
Forráspont-emelkedési és fagyáspont-depresszió
Az alábbi ábra annak a következményeit mutatja be, hogy az oldószer alacsonyabb gőznyomását oldja. A fázisdiagram B és C összekötő pontjai a hőmérséklet és a nyomás kombinációit tartalmazzák, amelyek mellett a tiszta oldószer és gőze egyensúlyban van. Ezért ezen a vonalon minden egyes pont leírja a tisztítószer gőznyomását ezen a hőmérsékleten. Az ábrán a pontozott vonal leírja a tulajdonságokat oldatban oldott oldatban kapott oldat.Bármely adott hőmérsékleten az oldószerből kilépő oldószer gőznyomása kisebb, mint a tiszta oldószer gőznyomása. A pontozott vonal ezért a folytonos vonal alatt fekszik.
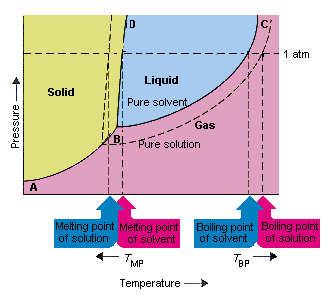
A az oldószer gőznyomása, amely oldott anyag hozzáadásakor következik be, az oldat forráspontjának növekedését és olvadáspontjának csökkenését okozza.
Ezen ábra szerint az oldat nem forrhat tiszta mint oldószeres mintahőmérsékleten. Ha a az oldatból távozó oldószer kisebb, mint a tiszta oldószer gőznyomása bármely adott hőmérsékleten, az oldatot magasabb hőmérsékletre kell felmelegíteni, mielőtt felforrna. Az oldószer gőznyomásának csökkenése, amikor oldat képződik, ezért növeli a folyadék forráspontját.
A fázisdiagramok bevezetésekor a hármas pontot definiálták a hőmérséklet és a nyomás egyetlen kombinációjaként, amelynél a gáz, a folyadék és a szilárd anyag egyszerre létezhet. A fenti ábra mutatja hogy az oldat hármaspontja alacsonyabb hőmérsékleten fordul elő, mint a tiszta oldószer hármaspontja. Önmagában a hármaspont változása nem fontos. Butit azonban megváltoztatja azt a hőmérsékletet, amelynél az oldat fagy vagy megolvad. Megérteni miért, vigyáznunk kell teljesen azon a vonalon, amely elválasztja a szilárd és a folyékony régiókat a fázisdiagramban. Ez a vonal majdnem függőleges, mert egy anyag olvadáspontja nem túl érzékeny a nyomásra.
Oldott anyag oldószerhez adása nem változtatja meg az olvadáspont nyomásfüggését. Az oldat szilárd és folyékony régióit elválasztó vonal ezért párhuzamos azzal a vonallal, amely ugyanazt a funkciót tölti be a tiszta oldószer számára Ennek a vonalnak át kell mennie az oldat hármas pontján. A hármas pont csökkenése, amely akkor következik be, amikor az olvadékot oldószerben oldják, csökkenti az oldat olvadáspontját.
A fenti ábra mutatja, hogy a Az oldott anyag oldószerben történő oldódása esetén bekövetkező változás az olvadáspont és az oldószer forráspontjának változásához is vezet. Mivel a gőznyomás változása kolligatív tulajdonság, amely csak az oldott anyag és az oldószerrészecskék relatív számától függ , az oldószer forráspontjának és olvadáspontjának változása szintén kolligatív tulajdonság.
![]()
ColligativeProperties számítások
A démonok legjobb módja a kolligativ tulajdonságok fontosságát Raoult törvényének következményeinek vizsgálata jelenti. Megállapítottuk, hogy az oldódásból kilépő oldószer gőznyomása arányos az oldószer mólfrakciójával.
P = CsolventPo
De az oldószer gőznyomása nem kolligativ tulajdonság. Az oldat kolligatív tulajdonságai között csak az a gőznyomás változása vehető figyelembe, amikor oldott anyagot adunk az oldószerhez.
Mivel a nyomás egy állapotfüggvény, az oldószer gőznyomásában bekövetkező változás, amely oldott oldat hozzáadásakor következik be, meghatározható a tiszta oldószer gőznyomásának és az oldószer gőznyomása közötti különbségnek. menekülve a megoldás elől.
P = Po – P
A Raoult törvényének ebbe az egyenletbe történő behelyettesítése a következő eredményt adja.
P = Po – Csolvent Po = (1 – Csolvent) Po
Ezt az egyenletet egyszerűsíteni lehet, ha emlékezünk az oldott anyag moláris frakciója és az oldószer molefrakciója közötti összefüggésre.
Csolute + Csolvent = 1
Ennek helyettesítése összefüggés az egyenletbe, amely meghatározza Pgives-t Raoult törvényének egy másik formájával.
P = CsolutePo
Ez az egyenlet arra emlékeztet bennünket, hogy az oldószer gőznyomásának változása, amely akkor következik be, amikor oldott anyagot adunk az oldószerhez, az oldott anyag moláris hányadával arányos. Amint a morolesz oldódik az oldószerben, az oldószer gőznyomása csökken, és a oldószer gőznyomásának változása növekszik.
Mivel az oldószer forráspontjának (TBP) változásai, amelyek az oldott anyag oldószerhez való hozzáadásakor következnek be, az oldószer gőznyomásának változásából adódnak, ezért a forráspont változásának nagysága is arányos az oldott anyag molefrakciójáig.
![]() TBP = kbsolute
TBP = kbsolute
Híg oldatokban az oldott anyag molaránya arányos az oldat molalitásával, amint az az alábbi ábra.

Az egyenlet, amely leírja a forráspont emelkedésének nagyságát, amely akkor fordul elő, amikor oldott anyagot adunk egy oldószerhez, ezért gyakran a következőképpen íródik.
![]() TBP = kbm
TBP = kbm
Itt ![]() TBP a forráspont magassága – A forráspont változása, amely akkor következik be, amikor egy oldott anyag oldódik az oldószerben, és a kb az arányosság állandója, amelyet az oldószer moláris forráspont-emelkedési állandójának nevezünk.
TBP a forráspont magassága – A forráspont változása, amely akkor következik be, amikor egy oldott anyag oldódik az oldószerben, és a kb az arányosság állandója, amelyet az oldószer moláris forráspont-emelkedési állandójának nevezünk.
Hasonló egyenlet írható le annak leírására, hogy mi történik az oldószer fagyáspontjáig (vagy olvadáspontjáig), amikor az oldószert oldott anyaghoz adjuk.
![]() TFP = -kfm
TFP = -kfm
Ebben az egyenletben a ![]() TFP a fagyáspont depresszió
TFP a fagyáspont depresszió ![]() a fagyáspont változása, amely akkor következik be, amikor az oldott anyag feloldódik az oldószerben – és kfis a molális fagyáspont-depresszió állandó a oldószer számára. Negatív előjelet használunk ebben az egyenletben annak jelzésére, hogy az oldószer fagyáspontja csökken az oldott anyag hozzáadásakor.
a fagyáspont változása, amely akkor következik be, amikor az oldott anyag feloldódik az oldószerben – és kfis a molális fagyáspont-depresszió állandó a oldószer számára. Negatív előjelet használunk ebben az egyenletben annak jelzésére, hogy az oldószer fagyáspontja csökken az oldott anyag hozzáadásakor.
A kf és kbas értékeit, valamint számos tiszta oldószer fagyáspontját és forráspontját az alábbi táblázatok adják meg.
Fagyáspont-depressziós konstansok
Forráspont-emelkedési konstansok
6. feladat:
Számítsa ki a kén molekulatömegét, ha 35,5 gramm kén oldódik 100,0 gramm CS2-ben 49,48 ° C-os forráspontú oldat előállításához.
Kattintson ide a 6. gyakorlati feladat megválaszolásához.
Kattintson ide, hogy megoldást találjon a 6. gyakorló feladatra.
7. feladat:
Határozza meg az ecetsav molekulatömegét, ha egy oldat 30,0 gramm ecetsavat tartalmaz kilogramm víz -0,93oC-on fagy meg. Ezek az eredmények egyetértenek azzal a feltételezéssel, hogy az ecetsav képlete CH3CO2H?
Kattintson ide, hogy ellenőrizze a 7. gyakorló feladatra adott válaszát.
Kattintson ide, hogy megoldást találjon a 7. gyakorló feladatra.
Mi történne a 7. gyakorlatban szereplő számítás során, erősebb savval, például hamuszósavval ismételjük meg?
8. feladat:
Magyarázza el, hogy a benzolban oldott HCl 0,00 m-es oldatának fagyáspont-depressziója 0,512oC, míg a 0,100 m-es vizes HCl-oldat fagyáspont-depressziója 0,352oC.
Kattintson ide a 8. gyakorlati feladat megválaszolásához.
1884-ben Jacobus Henricus van “t Hoff egy újabb kifejezést vezetett be a fagyáspont-mélyedés és a forráspont-emelkedés kifejezésekbe, hogy megmagyarázza a vízben oldódva disszociáló vegyületek oldatainak kolligatív tulajdonságait.
![]() TFP = – kf (i) m
TFP = – kf (i) m
Ebbe az egyenletbe egy 0,100 m HCl oldat fagyáspont-depressziójának kísérleti értékét behelyettesítve az i kifejezésre 1,89-es értéket adunk. Ha a HCl nem disszociál a vízben, akkor 1 lennék. Ha teljes mértékben disszociál, akkor 2. lennék. Az 1,89 kísérleti értéke azt sugallja, hogy a HCl-molekulák legalább 95% -a disszociál ebben a megoldásban.
Gyakorlat 9. feladat:
Magyarázza el, miért oldódik fel 0,60 gramm ecetsav 200 gramm benzolban, és olyan oldatot képez, amely a benzol fagyáspontját 5,40 ° C-ra csökkenti.
Kattintson ide, hogy ellenőrizze a választ 9. feladat gyakorlása
![]()
ozmotikus nyomás
1784-ben Jean AntoineNollet francia fizikus és papnő felfedezte, hogy a vízbe koncentrált alkoholtartalmú oldattal töltött sertés hólyagja kitágult, amikor vízbe merült. A hólyag féligáteresztő membránként működött, amely lehetővé tette a vízmolekulák bejutását az oldatba, de megakadályozta az alkoholmolekulák elmozdulását a másik irányban. Az oldat egyik komponensének mozgását a membránon az oldat hígítása érdekében ozmózisnak nevezzük, a nyomást, amelyet ez produkál, ozmotikus nyomásnak () nevezünk.
Az ozmotikus nyomást az alábbi ábrán bemutatott készülékkel lehet bemutatni. A bogáncscső nyitott végére féligáteresztő membrán van kötve. Ezután a csövet részben cukor vagy alkohol vizes oldatával töltjük meg, és vízzel elöntjük. A víz addig áramlik a csőbe, amíg a gravitációs erő miatt a vízoszlopon lévő nyomás kiegyenlíti a membránon keresztüli víz mozgatását.

A víz átfolyik a féligáteresztő membrán az alkohololdat hígításához, amíg az oldat oszlopán lehúzódó gravitációs erő kiegyenlíti az ozmotikus nyomást, amely a vizet a membránon keresztül nyomja.
Ugyanebben az évben, amikor Raoult felfedezte az oldat gőznyomásának és a tisztítószer, Jacobus Henricus gőznyomásának összefüggését van “t Hoff megállapította, hogy egy híg oldat () ozmotikus nyomása megfelel az ideális gázegyenlettel egyenértékű egyenletnek.
| |
= | nRT | ||
| V |
Ez az egyenlet arra utal, hogy az ozmotikus nyomás a kolligatív tulajdonság egy másik példája, mert ez A nyomás az oldott részecskék számának és az oldat térfogatának arányától függ ![]() n / V
n / V ![]() és nem az oldott részecskék azonosságától. emlékeztet bennünket az ozmotikus nyomás nagyságára is. Ezen egyenlet szerint egy 1,00 M s az olúció 22,4 atm ozmotikus nyomással rendelkezik 0 ° C-on.
és nem az oldott részecskék azonosságától. emlékeztet bennünket az ozmotikus nyomás nagyságára is. Ezen egyenlet szerint egy 1,00 M s az olúció 22,4 atm ozmotikus nyomással rendelkezik 0 ° C-on.

Ez azt jelenti, hogy egy 1,00 M-es megoldásnak képesnek kell lennie egy 670 hüvelykes vagy csaknem 56 láb magas vízoszlop támogatására !
A biológusok és biokémikusok gyakran használják az ozmotikus nyomás előnyeit, amikor izolálják a sejt komponenseit. Ha egy vizes oldathoz celliumot adnak, amely sokkal nagyobb koncentrációjú ionokat tartalmaz, mint a sejtben lévő folyadék, akkor a víz a sejt membránján átáramló vízzel leválasztja a sejtet, amíg a sejt annyira összezsugorodik, hogy a membrán elszakad. Alternatív megoldásként, ha egy sejtet sokkal kisebb ionerősségű oldatba helyezünk, víz ömlik a sejtbe, és a sejt kitágul, amíg a sejtmembrán fel nem szakad.
![]()