Polónium tények
A polónium kémiai elem kalkogén és metalloid osztályba tartozik. 1898-ban fedezte fel Marie és Pierre Curie.

Adatzóna
| Besorolás: | A polónium kalkogén és metalloid |
| Szín: | ezüstös-szürke |
| Atomsúly : | (209), nincsenek stabil izotópok |
| Állapot: | szilárd |
| Olvadáspont: | 254 oC, 527 K |
| Forráspont: | 960 oC, 1233 K |
| Elektronok: | 84 |
| Protonok: | 84 |
| A legtöbb izotópban lévő neutronok: | 125 |
| Elektronhéjak: | 2,8 , 18,32,18,6 |
| Elektronkonfiguráció: | 4f14 5d10 6s2 6p4 |
| Sűrűség @ 20oC: | 9,4 g / cm3 |
Mutasson többet, többek között: Melegségek, Energiák, Ökör idation,
Reakciók, vegyületek, sugarak, vezetőképesség
| Atomtérfogat: | 22,23 cm3 / mol |
| Szerkezet: | egyszerű köbös |
| Keménység: | – |
| Fajlagos hőteljesítmény | 0,12 J g-1 K-1 0,12 |
| Fúziós hő | 13 kJ mol-1 |
| Porlasztás hője | 142 kJ mol-1 |
| Párolgási hő | 120 kJ mol-1 |
| 1. ionizációs energia | 812 kJ mol-1 |
| 2. ionizációs energia | – |
| 3. ionizációs energia | – |
| Elektron affinitás | 180 kJ mol-1 |
| Minimális oxidációs szám | -2 |
| Min. általános oxidációs sz. | -2 |
| Maximális oxidációs szám | 6 |
| Max. általános oxidáció sz. | 4 |
| Elektronegativitás (Pauling-skála) | 2.0 |
| Polarizálhatóság kötet | 6,8 Å3 |
| Légreakció | enyhe, ⇒ PoO2 |
| Reakció 15 M HNO3-tal | – |
| Reakció 6 M HCl-lel | enyhe, ⇒ PoCl2 |
| Reakció 6 M NaOH-val | nincs |
| oxid (ok) | PoO2, PoO2 |
| Hidrid (ek) | PoH2 |
| Klorid (ok) | PoCl2 |
| Atomsugár | 190 pm |
| Ionos sugár (1+ ion) | – |
| Ionos sugár (2+ ion) | – |
| Ionos sugár (3+ ion) | – |
| Ionos sugár (1-ion) | – |
| Ionos sugár (2-ion) | – |
| Ionos sugár (3-ion) | – |
| Hővezető képesség | 0,2 W m-1 K-1 |
| Elektromos vezetőképesség | 0,7 x 106 S m-1 |
| Fagyás / olvadáspont: | 254 oC, 527 K |

Marie Curie 16 évesen 1883-ban. A polónium volt az első elem, amelyet 15 évvel később felfedezett.
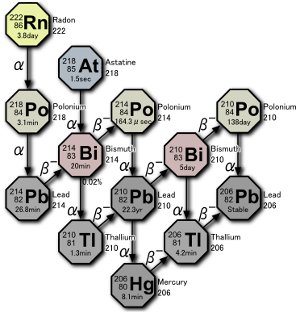
A uránbomlási sorozat. Három polónium-izotóp termelődik a természetben, akár maga a radon gáz bomlása, akár a radon bomlásából származó atomok bomlása révén. Tosaka képe.
A polónium felfedezése
A polónium volt az első elem, amelyet Marie és Pierre Curie fedezett fel.
1898-ban Párizsban fedezték fel a polóniumot, majd a rádiumot, miközben a szurok (uránoxid) radioaktivitását vizsgálták. / p>
Azt írták: “Úgy gondoljuk, hogy a szurokból kivont anyag egy soha nem ismert fémet tartalmaz, analitikai tulajdonságaihoz hasonlóan a bizmuthoz. Ha ennek az új fémnek a megléte beigazolódik, javasoljuk, hogy egyikünk származási országának neve után polóniumnak hívják. ”
A Curies kívánságainak megfelelően a polónium Lengyelországról kapta a nevét, ahol Marie Curie született és nőtt fel.
A radioaktív elemekkel való munkavégzés veszélyei nem voltak ismertek, amikor a Curies laboratóriumi jegyzetfüzeteik ettől az időponttól kezdve annyira radioaktívak, hogy ólmozott bélésű tokban tárolják őket. (1) p>
A polónium kémiai toxicitása és radioaktivitása révén egyaránt káros. A polónium-210 alfa-kibocsátó. Mint ilyen, lenyelve vagy belélegezve nagyon veszélyes.A polóniumnak való kitettség növeli a különféle rákos megbetegedések kockázatát.
Jellemzők:
A polónium ritka, ezüstös szürke, radioaktív, alacsony olvadáspontú metalloid.
A polónium könnyen reagál híg savakkal, de csak lúgokkal.
Minden izotópja radioaktív.
A 210Po kék fényt bocsát ki, mivel a körülötte lévő levegőt a bomlás gerjeszti Termékek. 1 gramm Po annyi alfa-részecskét bocsát ki, mint 5 kilogramm rádium.
A polónium alfa-bomlása által felszabadított energia jelentős és felmelegíti a körülötte lévő teret. A felszabaduló energia olyan nagy (140 W / g), hogy egy körülbelül fél gramm kapszula 500 ° C feletti hőmérsékletet ér el.
A polónium felhasználása
Az alfa sugarak a polónium felhasználható a statikus elektromosság kiküszöbölésére olyan folyamatok során, mint a papír, huzal és fémlemez hengerlése. A béta sugárforrásokat azonban gyakrabban használják, mivel kevésbé veszélyesek.
A 210Po atomi hőforrásként használható, de az izotóp rövid felezési ideje (138,4 nap) miatt nem nyújt energiát hosszú távú felhasználáshoz.
A polóniumot antisztatikus kefékben is használják, hogy eltávolítsák a fényképes film porát. Kefékbe van zárva, hogy ellenőrizzék a radioaktív emissziót.
Bőség és izotópok
Bőséges földkéreg: kvadrilliónként 1 rész nagyságrendű.
Bőséges naprendszer: elhanyagolható
Költség , tiszta: 100 g-ra
Költség, ömlesztve: 100 g-ra
Forrás: A polónium minden izotópjának rövid felezési ideje miatt nagyon ritka elem. Perces mennyiségben található meg az uránércekben. Meg lehet szerezni úgy, hogy a természetes bizmutot (209Bi) neutronokkal bombázzuk, így 210Bi-t kapunk, amely aztán β-bomlás révén 210Po-ra bomlik. Körülbelül 100 g polónium szintetizálódik évente.
Izotópok: A polóniumnak 29 olyan izotópja van, amelyek felezési ideje ismert, tömegük 190 és 218. tömeg. A legstabilabb izotóp 209Po, felezési ideje 102 év.

Idézze ezt az oldalt
Online linkeléshez másolja és illessze be az alábbiak egyikét:
<a href="https://www.chemicool.com/elements/polonium.html">Polonium</a>
vagy
<a href="https://www.chemicool.com/elements/polonium.html">Polonium Element Facts</a>
Ha ezt az oldalt egy tudományos dokumentumban szeretné idézni, kérjük, használja a következő MLA-kompatibilis idézetet:
"Polonium." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/polonium.html>.