Analisi economica dell’uso dell’oscillazione della parete toracica ad alta frequenza (HFCWO) in pazienti con non cistica Fibrosi Bronchiectasie
Abstract
La bronchiectasia è una malattia cronica progressiva caratterizzata da una dilatazione patologica irreversibile dei bronchi polmonari. I trattamenti per le bronchiectasie mirano a mobilitare le secrezioni delle vie aeree, ridurre l’infiammazione, prevenire le infezioni respiratorie, migliorare la ventilazione, ridurre al minimo il numero di esacerbazioni e migliorare la qualità della vita di una persona. L’oscillazione della parete toracica ad alta frequenza (HFCWO) è un trattamento di clearance delle vie aeree attualmente utilizzato per una serie di malattie croniche che compromettono le vie aeree, comprese le bronchiectasie da fibrosi non cistica. Questo studio ha valutato l’impatto economico del trattamento con HFCWO fornito dal sistema di eliminazione delle vie aeree SmartVest® sull’utilizzo e sui costi sanitari correlati alle bronchiectasie.
Metodi
I risultati di una revisione del caso pubblicata in precedenza -studio clinico degli autori ha fornito la base per questa analisi di costo-efficacia. Le riacutizzazioni correlate alle bronchiectasie, compreso il numero di ricoveri, le visite al pronto soccorso (DE) e la frequenza delle prescrizioni di antibiotici sono state registrate per ciascun paziente per un periodo di un anno prima dell’uso di SmartVest (controllo dello standard di cura) e per un periodo di un anno dopo l’inizio di SmartVest uso. Sono stati confrontati i tassi di esacerbazione per un anno prima di SmartVest e un anno dopo lo SmartVest. Le riacutizzazioni sono state verificate sia dalla cartella clinica del paziente che tramite intervista telefonica. I costi degli antibiotici sono stati determinati utilizzando il “prezzo scontato in linea delle farmacie”, mentre i costi di ospedalizzazione e ED sono stati determinati utilizzando l’Healthcare Cost and Utilization Project (HCUP) Statistical Brief # 146 e il database HCUP National Inpatient Sample (NIS) 2013.
Risultati
I risultati clinici pubblicati in precedenza di cinquantanove pazienti SmartVest con bronchiectasie da fibrosi non cistica sono serviti come base per questa analisi. Quando sono stati analizzati i dati di esito, lo SmartVest è stato utilizzato rispetto allo standard del controllo delle cure, è stato associato a risultati statisticamente significativi; una diminuzione del 58% del costo degli antibiotici, una diminuzione del 63% del costo delle visite ED e una diminuzione del 60% dei costi di ospedalizzazione. In totale, l’analisi dei costi ha portato a un risparmio annuo di $ 3.045 per paziente all’anno di utilizzo di SmartVest.
Conclusioni
L’efficacia clinica dell’utilizzo di SmartVest come trattamento per i pazienti con bronchiectasie non cistiche è stata precedentemente verificata da una significativa riduzione n nelle esacerbazioni correlate alle bronchiectasie, che si traduce direttamente in una significativa riduzione complessiva del 60% dell’utilizzo e dei costi dell’assistenza sanitaria in questa popolazione. Inoltre, vantaggi secondari come il potenziale di riduzione dei ricoveri ospedalieri e il potenziale impatto nella deterrenza della resistenza agli antibiotici possono avere benefici ancora maggiori rispetto alla riduzione dei costi.
Parole chiave
SmartVest, petto ad alta frequenza oscillazione della parete, HFCWO, bronchiectasie, costo
Introduzione
La bronchiectasia è una malattia cronica ed etiologicamente eterogenea. Le caratteristiche comuni delle bronchiectasie sono mancanza di respiro, esacerbazioni frequenti, tosse cronica, emottisi e produzione eccessiva di espettorato. La malattia è tipicamente caratterizzata da cicli di ridotta clearance mucociliare, infezione bronchiale e infiammazione che provocano danni strutturali alle vie aeree con dilatazione permanente e anormale.1 La bronchiectasia può essere il risultato di una vasta gamma di malattie respiratorie e sistemiche, inclusa la fibrosi cistica, sindromi ciliare discinetiche, lesioni da inalazione / aspirazione, stati di immunodeficienza primaria e acquisita e una serie di condizioni reumatiche e infiammatorie.2 La bronchiectasia è osservata nel 7% -52% dei pazienti con asma o broncopneumopatia cronica ostruttiva (BPCO) .3,4 , 37
Seitz, et al, hanno analizzato un campione del 5% del database dei reclami ambulatoriali Medicare per le bronchiectasie tra i beneficiari di età ≥65 anni dal 2000 al 2007.6 Il database contiene informazioni sul livello delle richieste di assistenza sanitaria ambulatoriale non istituzionale fornitori. La bronchiectasia è stata identificata dal database utilizzando i codici di classificazione internazionale delle malattie, nona revisione, codici di modifica clinica (ICD-9-CM). La popolazione dello studio includeva > 2 milioni di individui unici iscritti a Medicare Parte B per almeno un mese dal 2000 al 2007. Lo studio ha determinato che la prevalenza di bronchiectasie nella popolazione complessiva era di 1.106 casi per 100.000 persone durante il periodo di revisione di otto anni. Lo studio ha anche rilevato che la prevalenza di bronchiectasie nei beneficiari di Medicare è aumentata dell’8,7% tra il 2000 e il 2007 e il tasso di ospedalizzazione per bronchiectasie è aumentato ogni anno a un tasso di 2.4% tra gli uomini e 3,0% tra le donne.
L’onere complessivo della malattia polmonare avanzata è in aumento e, laddove esistono dati, i costi relativi alla morbilità e alla mortalità di queste malattie sembrano significativi.2 Ciò potrebbe, in parte, essere un riflesso del crescente invecchiamento della popolazione affetta da malattie polmonari croniche, che ha un aumento sproporzionato dei costi sanitari; il tasso di ospedalizzazione per malattia polmonare cronica aumenta notevolmente al di sopra dei 50 anni, e in particolare nelle donne anziane.2,7 Utilizzando le registrazioni delle dimissioni dal 1997 al 2010, è stato stimato il costo medio ospedaliero per cure ospedaliere in pazienti con un l’esacerbazione della polmonite è stata di $ 9.300,28 Nel 2001, è stato anche stimato che il costo medico annuale delle cure per le persone negli Stati Uniti con bronchiectasie era di $ 13.244, che è maggiore del costo annuale per molte altre malattie croniche, come le malattie cardiache ($ 12.000) e BPCO ($ 11.000) .38 Uno studio del 2005 ha rilevato che i pazienti con bronchiectasie da fibrosi non cistica avevano una media di 2,0 giorni in più all’anno in ospedale, avevano 6,1 ulteriori visite ambulatoriali e 27,2 giorni in più di terapia antibiotica rispetto ai pazienti senza la malattia.9 Nel 2005 , i costi di trattamento per le bronchiectasie da fibrosi non cistica erano di 630 milioni di dollari all’anno.5
I pazienti con bronchiectasie da fibrosi non cistica possono avere difficoltà a liberarsi dall’aria ay secrezioni e può trarre vantaggio in modo significativo dalla terapia di clearance delle vie aeree.2 Gli obiettivi del trattamento per le bronchiectasie sono di mobilitare le secrezioni delle vie aeree in modo da ridurre l’infiammazione, prevenire le infezioni respiratorie, migliorare la ventilazione, ridurre al minimo il numero di riacutizzazioni e migliorare la qualità della vita del paziente. 10-12 Attualmente vengono utilizzati numerosi metodi terapeutici per eliminare le secrezioni delle vie aeree in pazienti con malattia polmonare, compromissione della clearance del muco respiratorio o che sono a rischio di sviluppare una di queste condizioni.8 Questi metodi generalmente mirano a promuovere la clearance della secrezione riducendo viscosità del muco e utilizzo di forze di taglio per rilasciare il muco dalla parete polmonare per facilitare la mobilizzazione per facilitare l’espettorazione. Lo standard di cura prevede la terapia di combinazione con agenti mucolitici e mucocinetici, broncodilatatori, terapia antinfiammatoria e qualche forma di terapia fisica / meccanica per la clearance delle vie aeree.2 La terapia per la clearance delle vie aeree gioca un ruolo fondamentale in quanto aiuta a evitare la ritenzione di muco carico di patogeni che è l’origine alla base dell’infezione ricorrente che causa un deterioramento polmonare progressivo.2,13,14 I metodi di clearance delle vie aeree svolgono un ruolo fondamentale nel mantenimento della salute respiratoria per tutta la vita del paziente.
Diverse procedure di clearance delle vie aeree sono disponibili metodi tra cui fisioterapia toracica, maschere a pressione di fine espirazione positiva, dispositivi ad alta frequenza orale e oscillazione della parete toracica ad alta frequenza (HFCWO) .2 Maschere a pressione di fine espirazione positiva e dispositivi ad alta frequenza orale richiedono uno sforzo attivo, padronanza del tecnica e / o agilità fisica che possono limitarne l’uso.2
L’HFCWO viene utilizzato per la clearance delle vie aeree in pazienti con un’ampia gamma di compromissione delle vie aeree ng malattie e condizioni, comprese malattie genetiche e immunologiche, malattie neuromuscolari e condizioni polmonari ostruttive, come l’asma e la BPCO.15-18 A differenza di alcuni altri metodi, l’HFCWO richiede un’attività minima da parte dell’utente e non dipende dalle cure di un operatore sanitario tecnica per essere efficace.2 Studi clinici, principalmente in pazienti con fibrosi cistica, hanno dimostrato che l’HFCWO è sicuro ed efficace.2,15,19-22 HFCWO fornisce impulsi di compressione alla parete toracica attraverso un giubbotto gonfiabile collegato a un generatore di impulsi ad aria .2 Il generatore produce un flusso d’aria alternato dentro e fuori il giubbotto che comprime e rilascia rapidamente la parete toracica entro una gamma di frequenze e pressioni selezionabili. È stato riportato che la compressione oscillatoria impartita alla parete toracica assottiglia il muco viscoso, scollega il muco dalla parete del polmone e spinge il muco dalle vie aeree minori dei polmoni verso le vie aeree maggiori dove può essere espettorato o aspirato via.2,23, 24 HFCWO può portare a un miglioramento significativo del volume polmonare da 15 a 57 ml e del flusso fino a 1,6 l / sec.22
Uno studio precedente di revisione di un caso ha valutato i risultati clinici della terapia con SmartVest® Airway Clearance System in caso di riacutizzazione utilizzo sanitario correlato e uso di farmaci in soggetti con bronchiectasie non da fibrosi cistica.25 Lo studio ha rilevato che l’uso di SmartVest ha determinato una riduzione statisticamente significativa del 60% delle esacerbazioni correlate alle bronchiectasie, inclusi l’uso di antibiotici, le visite al pronto soccorso (DE) e i ricoveri . L’attuale studio è progettato per valutare l’impatto economico della terapia SmartVest sui costi sanitari e antibiotici correlati alle bronchiectasie.
Metodi
Un recente SmartVest (Electromed, Inc., New Prague, MN , USA), uno studio clinico basato sui risultati della revisione del caso è servito come base per questa analisi.25 Lo studio ha registrato tutte le riacutizzazioni correlate alle bronchiectasie includendo il numero di ricoveri, visite ED e uso di antibiotici per un periodo di un anno prima dell’uso di SmartVest (controllo dello standard di cura) e, per confronto, per un periodo di un anno dopo l’inizio del Uso di SmartVest (trattamento). Lo studio ha incluso solo quei soggetti con diagnosi di bronchiectasie da fibrosi non cistica che utilizzavano SmartVest per almeno un anno e le cui cartelle cliniche erano disponibili per un anno prima dell’inizio della terapia con SmartVest. I pazienti sono stati esclusi se non erano stati conformi al regime terapeutico SmartVest prescritto, non potevano essere contattati telefonicamente o se erano scaduti. Tutti i dati raccolti prima dell’uso di SmartVest sono stati acquisiti tramite le cartelle cliniche del paziente.
Le cartelle cliniche del paziente sono state esaminate per tutte le riacutizzazioni correlate alle bronchiectasie che si sono verificate durante un periodo di un anno prima dell’inizio della terapia con SmartVest. I soggetti sono stati contattati e intervistati telefonicamente per raccogliere le esacerbazioni correlate alle bronchiectasie per il periodo di un anno dopo l’inizio della terapia con SmartVest. Il questionario per il sondaggio telefonico è stato sviluppato ai soli fini dello studio. Durante l’intervista telefonica, al soggetto sono state poste domande specifiche riguardanti l’uso di antibiotici legati alle vie respiratorie, le visite ED e i ricoveri. L’intervista ha anche chiesto se il paziente stesse utilizzando SmartVest in base al regime di prescrizione del medico.
I costi degli antibiotici sono stati determinati utilizzando il “prezzo scontato per le farmacie online”, tuttavia, il costo delle visite ambulatoriali e le spese mediche non sono stati inclusi I costi di ospedalizzazione e ED sono stati determinati utilizzando le stime nazionali ponderate dal National Inpatient Project (NIS) del progetto Healthcare Cost and Utilization (NIS), 2013, Agency for Healthcare Research and Quality (AHRQ), sulla base dei dati raccolti dai singoli Stati e forniti a AHRQ da parte degli Stati.26 Il database NIS include un campione di probabilità stratificato di ospedali dai database di degenza statale che includono ricoveri di pazienti con Medicare, Medicaid, assicurazioni private e non assicurati.27 Il NIS contiene dati da 5 a 8 milioni di degenze ospedaliere da 1000 ospedali. È designato per approssimare un campione del 20% degli ospedali statunitensi non federali a breve termine come definito dall’American Medical Associ azione. Il NIS è tratto dagli stati che partecipano al progetto Healthcare Cost and Utilization. Il NIS contiene dati uniformi sulla degenza dei pazienti dai database delle dimissioni ospedaliere gestiti da agenzie statali, associazioni ospedaliere e altre organizzazioni private. Il numero totale di dimissioni ponderate negli Stati Uniti sulla base dell’HCUP NIS era 35.597.792,28
Risultati
La revisione dei database HCUP e Medicare ha rivelato che i costi sanitari associati per una riacutizzazione correlata alla bronchiectasia
essere $ 450 (2012) per una visita ED e $ 9.300 (2010) per un ricovero con polmonite. Non sono state calcolate degenze ospedaliere prolungate basate su complicanze o comorbidità. Utilizzando i calcoli dei prezzi delle farmacie scontate in linea, il costo di un regime antibiotico standard per la polmonite era di $ 290 (2016). Le tariffe mediche per una visita ambulatoriale e la successiva prescrizione non erano disponibili per il calcolo.
Dei 104 pazienti con bronchiectasie identificati con SmartVest, cinquantanove pazienti soddisfacevano i criteri di inclusione / esclusione.25 Nella popolazione dello studio, il numero medio delle prescrizioni di antibiotici all’anno era del 58% in meno per SmartVest (0,6 / anno) rispetto al controllo standard di cura (1,4 / anno) (vedere Tabella 1). L’uso di SmartVest ha anche ridotto significativamente le visite ED del 63% (0,08 / anno versi 0,03 / anno) e le ospedalizzazioni del 60% (0,5 / anno versi 0,2 / anno). I costi annuali per paziente per gli antibiotici per i pazienti trattati con SmartVest erano inferiori di circa $ 233 rispetto a quelli trattati con standard di cura (vedere Tabella 1). Anche i ricoveri, dopo un anno di utilizzo di SmartVest, sono stati significativamente ridotti di $ 2.790 per paziente all’anno. In totale, i risultati complessivi hanno rivelato un risparmio annuale di $ 3.045 per paziente all’anno di utilizzo di SmartVest.
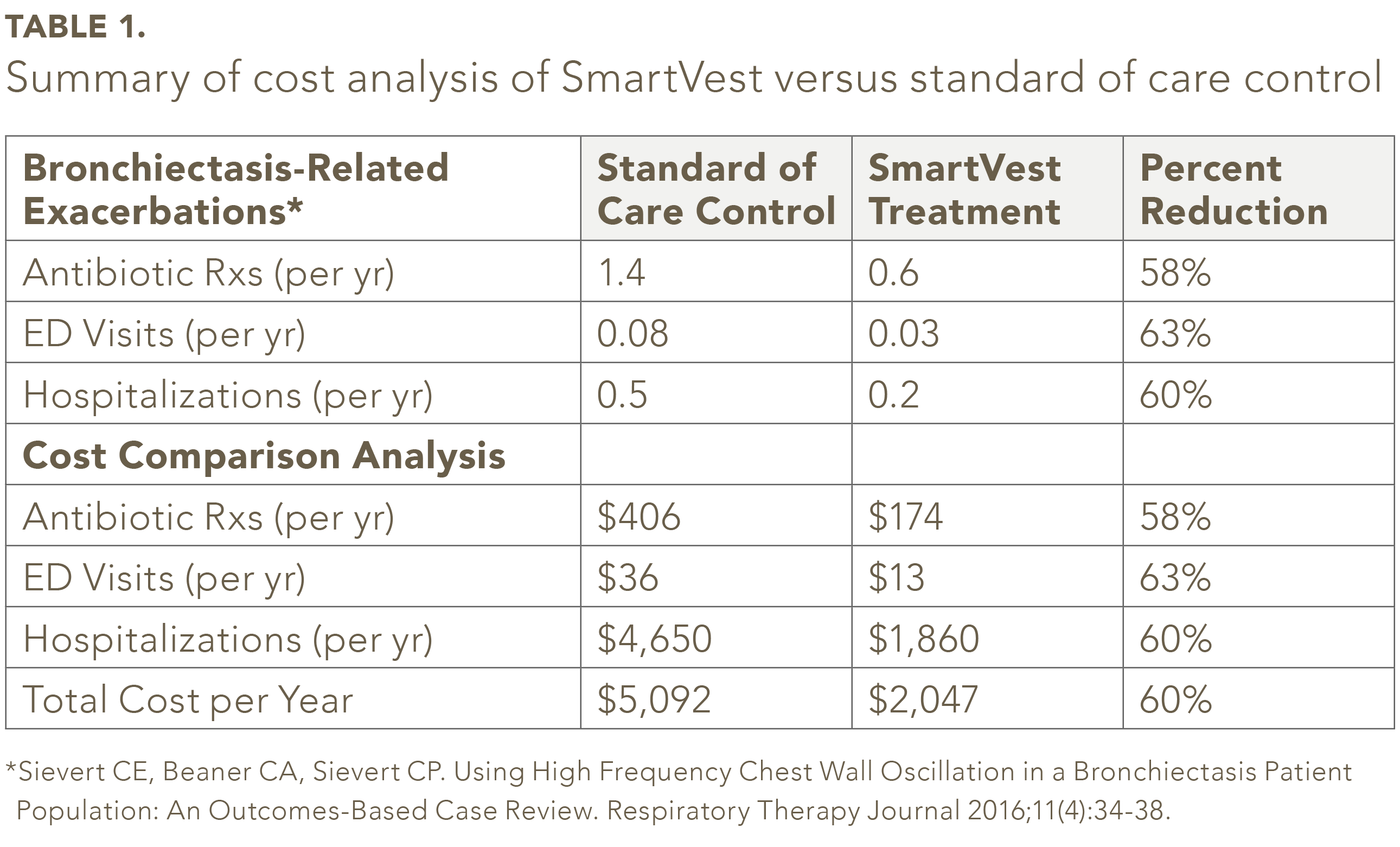
L’analisi non lo ha fatto tenere conto di eventuali spese mediche / studio sostenute per ottenere una prescrizione di antibiotici senza ricovero in ospedale. Inoltre, l’analisi non ha tenuto conto di una visita ambulatoriale per una potenziale esacerbazione che non ha comportato una prescrizione o un ricovero in ospedale. Inoltre, l’analisi non ha tenuto conto delle spese aggiuntive se la riacutizzazione era una polmonite da ceppo batterico resistente agli antibiotici che, secondo quanto riferito, può costare più di $ 15.000 per ogni episodio.
Discussione
Lo scopo di l’analisi era volta a valutare l’impatto economico dell’uso di SmartVest sui costi medici associati alle bronchiectasie rispetto a uno standard di controllo. A nostra conoscenza, questo è il primo studio a valutare i costi sanitari del trattamento di pazienti con bronchiectasie non fibrosi cistica con HFCWO.Il costo complessivo includeva il costo degli antibiotici, delle visite di pronto soccorso e dei ricoveri correlati alle esacerbazioni associate a bronchiectasie da fibrosi non cistica. Lo studio ha dimostrato una significativa riduzione dell’utilizzo dell’assistenza sanitaria e dei costi associati quando i pazienti con bronchiectasie sono stati trattati con SmartVest per un anno. Il costo complessivo è stato ridotto del 60%, il che si traduce in un risparmio di $ 3.045 per paziente all’anno.
Un recente studio che ha valutato dimissioni ospedaliere, riammissioni e visite ED per BPCO o bronchiectasie negli adulti negli Stati Uniti dal 2001 al 2012 il numero di dimissioni ospedaliere è aumentato di 88.000.31 Lo studio ha anche rilevato che circa il 7% dei pazienti con BPCO o bronchiectasie è stato riammesso entro 30 giorni con BPCO o bronchiectasie come diagnosi principale.31 Al contrario, il tasso di dimissioni è diminuito per altre malattie.31 La ragione del significativo aumento delle visite ospedaliere e di pronto soccorso per la BPCO e per le bronchiectasie non è chiara poiché è stata osservata una riduzione significativa dei tassi di fumo. Tuttavia, può riflettere il potenziale sottodiagnosi della malattia e la natura a lungo termine della BPCO e delle bronchiectasie in una popolazione che invecchia.31
Un precedente studio basato sui risultati della revisione del caso ha riportato che l’uso di SmartVest ha ridotto i ricoveri di 1,5 volte, 25 indicando il vantaggio in termini di costi di HFCWO sulla riduzione del carico di utilizzo dell’assistenza sanitaria. Altri studi hanno anche valutato fattori (sia del sistema che del paziente) che possono ridurre la riammissione nei pazienti con BPCO e sono, almeno in parte, rilevanti per i pazienti con bronchiectasie. Questi fattori includono la continuità con le cure primarie fornite dai pazienti o con lo pneumologo, l’intervento del coordinatore delle dimissioni e l’entità o il tipo di terapia respiratoria. 32-34
La riduzione del numero di riacutizzazioni correlate alle bronchiectasie può anche avere un impatto su un qualità della vita del paziente.35,36 In una popolazione di pazienti con BPCO, l’uso di SmartVest è stato associato a un miglioramento significativo nel punteggio dei cinque sintomi P = 0,002 (valutazione di espettorato, respiro sibilante, tosse, mancanza di respiro e tolleranza all’esercizio ) .36 Il trattamento con SmartVest ha anche dimostrato un miglioramento significativo nel questionario respiratorio di San Giorgio (SGRQ) P = 0,02, mentre non è stato osservato alcun miglioramento nei pazienti trattati con il trattamento convenzionale.36 Allo stesso modo, il nostro precedente studio basato sui risultati della revisione del caso ha rilevato che 68 La% dei soggetti ha indicato durante il colloquio telefonico che l’uso di SmartVest aveva migliorato in modo significativo la loro qualità di vita.25
Si dovrebbero prendere in considerazione diversi limiti al disegno dello studio rosso durante l’interpretazione dei risultati. La dimensione del paziente dello studio era piccola ei dati sui ricoveri, sulle visite ED e sull’uso di antibiotici dopo l’inizio della terapia con SmartVest sono stati ottenuti principalmente attraverso l’intervista al paziente. Lo studio può essere considerato conservativo a causa dell’assenza di costi aggiuntivi per gli onorari del medico associati a una visita ambulatoriale risultante in una prescrizione di antibiotici o, nessun costo aggiuntivo per una visita ambulatoriale che non ha comportato una prescrizione di antibiotici. Inoltre, le basi di dati Reliance on HCUP, NIS e AHRQ, che dipendono dalle diagnosi inserite nei reclami, possono essere codificate in modo errato o non codificate affatto, introducendo così potenzialmente errori di misurazione rispetto alle variabili basate su ICD-9-CM.
La riduzione dei costi di utilizzo dell’assistenza sanitaria come l’uso di antibiotici, le visite di pronto soccorso e i ricoveri sono obiettivi prioritari delle recenti direttive sanitarie come l’Affordable Care Act (ACA). Ad esempio, l’ACA ha istituito il programma di riduzione delle riammissioni ospedaliere (HRRP), che ha ordinato a CMS di penalizzare gli ospedali riducendo i pagamenti di rimborso per le riammissioni di pazienti in eccesso per la stessa condizione. L’HRRP ha originariamente identificato le tre principali “condizioni applicabili” per la misurazione mirata della riammissione, includendo infarto miocardico acuto, insufficienza cardiaca e polmonite. Inoltre, il CMS ha recentemente finalizzato l’espansione di ulteriori condizioni applicabili a partire dal programma dell’anno fiscale 2015 per includere i pazienti riammessi per un esacerbazione acuta della BPCO. La significativa riduzione dell’utilizzo dell’assistenza sanitaria e dei ricoveri per i pazienti con bronchiectasie non cistiche che utilizzano SmartVest, come dimostrato in questo studio e in altri, può svolgere un ruolo fondamentale nell’aiutare gli ospedali a ridurre le riammissioni e quindi non essere penalizzati.
Per i pazienti che hanno infezioni delle vie aeree resistenti agli antibiotici orali, il carico è molto maggiore e più grave. Gli antibiotici per via endovenosa complicano notevolmente le cure perché è necessario il ricovero in ospedale o il monitoraggio domiciliare. Il trattamento per questi pazienti include il posizionamento di un catetere venoso centrale, il coordinamento di le dosi di farmaci che spesso devono essere somministrate multi volte al giorno, esami del sangue regolari per monitorare gli effetti collaterali e misurazione dei livelli ematici dell’antibiotico per molti giorni, passaggi che diventano costosi e sconvolgono la vita dei pazienti.
L’Organizzazione mondiale della sanità (OMS) ha dichiarato che la resistenza microbica agli antibiotici rappresenta “una grave minaccia globale con implicazioni devastanti per la salute pubblica”. La resistenza antimicrobica minaccia la prevenzione e il trattamento efficaci di una gamma sempre crescente di infezioni causate non solo da batteri ma anche da virus e funghi. I Centri statunitensi per il controllo e la prevenzione delle malattie (CDC) considerano la resistenza antimicrobica una delle loro principali preoccupazioni e priorità. Solo negli Stati Uniti, almeno 2 milioni di persone vengono infettate da batteri resistenti agli antibiotici e almeno 23.000 persone muoiono ogni anno come conseguenza diretta di tali infezioni.39 In risposta alla preoccupazione mondiale, i Centri statunitensi per Medicare & Medicaid Services (CMS) ha recentemente rilasciato una proposta di modifica delle regole alle sue Condizioni di partecipazione che, tra le altre modifiche, richiederebbe agli ospedali di implementare programmi di gestione degli antibiotici per partecipare ai programmi Medicare e Medicaid. La gestione degli antibiotici include il miglioramento dei risultati dei pazienti mediante l’adozione di processi e procedure che riducono l’incidenza di infezioni da pa particolare attenzione alla polmonite come la cura del trattamento preventivo. Come vantaggio secondario rispetto ai risultati in termini di costi-benefici di questo studio, una significativa riduzione della necessità di antibiotici nei pazienti con bronchiectasie mediante l’uso di SmartVest può avere benefici anche maggiori rispetto alla riduzione dei costi. Un trattamento disponibile che potrebbe ridurre significativamente le infezioni respiratorie e quindi la necessità di antibiotici si adatta bene ai programmi di controllo delle infezioni dell’ospedale.
In sintesi, l’efficacia clinica della clearance delle vie aeree HFCWO dimostrata da SmartVest nei pazienti con BPCO36 e in quelli con bronchiectasie, 25 e la significativa riduzione dei costi di antibiotici, DE e ospedalizzazione osservata in questo studio supporta il vantaggio in termini di costi dell’uso di SmartVest e sostiene la copertura assicurativa di SmartVest da parte dei contribuenti. Inoltre, benefici secondari come la possibilità di ridurre le riammissioni ospedaliere e il potenziale impatto nella deterrenza della resistenza agli antibiotici possono avere benefici anche maggiori rispetto alla riduzione dei costi.
Scarica il testo dello studio
Ringraziamenti
Gli autori desiderano ringraziare Elizabeth Goodwin PhD per il supporto editoriale.
- King P. Pathogenesis of bronchiectasis. Paediatr Respir Rev 2011; 12 (2): 104-110. 10.1016 / j.prrv.2010.10.011
- Braverman J, Miller H. Compressione toracica ad alta frequenza: una terapia pratica per pazienti con bronchiectasie. Terapia respiratoria 2008; 3 (1): 22-26.
- Patel IS, Vlahos I, Wilkinson TM, et al. Bronchiectasie, indici di esacerbazione e infiammazione nella malattia polmonare ostruttiva cronica. Am J Respir Crit Care Med 2004; 170 (4): 400-407. 10.1164 / rccm.200305-648OC
- Gono H, Fujimoto K, Kawakami S, et al. Valutazione dello spessore della parete delle vie aeree e dell’intrappolamento d’aria mediante HRCT nell’asma asintomatico. Eur Respir J 2003; 22 (6): 965-971.
- Weycker D, Edelsberg J, Oster G, et al. Prevalenza e onere economico delle bronchiectasie. Clinical Pulmonary Medicine 2005; 12 (4): 205-209.
- Seitz AE, Olivier KN, Adjemian J, et al. Tendenze nelle bronchiectasie tra i beneficiari di Medicare negli Stati Uniti, dal 2000 al 2007. CHEST Journal 2012; 142 (2): 432-439.
- Seitz AE, Olivier KN, Steiner CA, et al. Tendenze e carico dei ricoveri associati a bronchiectasie negli Stati Uniti, 1993-2006. Petto 2010; 138 (4): 944-949. 10.1378 / petto.10-0099
- Seitz AE, Olivier KN, Steiner CA, et al. Tendenze e carico dei ricoveri associati a bronchiectasie negli Stati Uniti, 1993-2006. CHEST Journal 2010; 138 (4): 944-949.
- Weycker D, Edelsberg J, Oster G, et al. Prevalenza e onere economico delle bronchiectasie. Clinical Pulmonary Medicine 2005; 12: 205-209.
- Fibrosi. AoCPiC. Standard di cura e buona pratica clinica per la gestione fisioterapica della fibrosi cistica 2011. Disponibile da: https://www. cysticfibrosis.org.uk/media/82076/CD Standards of Care Physio Jun 11.pdf.
- O’Donnell AE. Bronchiectasie. Petto 2008; 134 (4): 815-823. 10.1378 / petto.08-0776
- Barker AF. Bronchiectasie. N Engl J Med 2002; 346 (18): 1383-1393. 10.1056 / NEJMra012519
- McCool FD, Rosen MJ. Terapie non farmacologiche per la clearance delle vie aeree: linee guida di pratica clinica basate sull’evidenza. Petto 2006; 129 (1 Suppl): 250S-259S. 10.1378 / chest.129.1 suppl.250S
- Salathe M, O’Riordan TG, Wanner A. Trattamento della disfunzione mucociliare. Chest 1996; 110 (4): 1048-1057.
- Arens R, Gozal D, Omlin KJ, et al. Confronto tra compressione toracica ad alta frequenza e fisioterapia toracica convenzionale in pazienti ospedalizzati con fibrosi cistica. Am J Respir Crit Care Med 1994; 150 (4): 1154-1157. 10.1164 / ajrccm.150.4.7921452
- Fink JB, Mahlmeister MJ. Oscillazione ad alta frequenza delle vie aeree e della parete toracica. Respir Care 2002; 47 (7): 797-807.
- Hansen LG, Warwick WJ.Sistema di compressione toracica ad alta frequenza per favorire l’eliminazione del muco dal polmone. Biomed Instrum Technol 1990; 24 (4): 289-294.
- Lange DJ, Lechtzin N, Davey C, et al. Oscillazione ad alta frequenza della parete toracica nella SLA: uno studio esplorativo randomizzato e controllato. Neurology 2006; 67 (6): 991-997. 10.1212 / 01. wnl.0000237439.78935.46
- Warwick WJ, Hansen LG. L’effetto a lungo termine della terapia di compressione toracica ad alta frequenza sulle complicanze polmonari della fibrosi cistica. Pediatr Pulmonol 1991; 11 (3): 265-271.
- Kluft J, Beker L, Castagnino M, et al. Un confronto tra i trattamenti di drenaggio bronchiale nella fibrosi cistica. Pediatr Pulmonol 1996; 22 (4): 271-274. 10.1002 / (SICI) 1099-0496 (199610) 22: 4 < 271 :: AID-PPUL7 > 3.0.CO; 2- P
- Scherer TA, Barandun J, Martinez E, et al. Effetto delle vie aeree orali ad alta frequenza e dell’oscillazione della parete toracica e della terapia fisica convenzionale del torace sull’espettorazione in pazienti con fibrosi cistica stabile. Chest 1998; 113 (4): 1019-1027.
- Nicolini A, Cardini F, Landucci N, et al. Efficacia del trattamento con oscillazione della parete toracica ad alta frequenza in pazienti con bronchiectasie. BMC Pulm Med 2013; 13:21. 10.1186 / 1471-2466-13-21
- Osman LP, Roughton M, Hodson ME, et al. Studio comparativo a breve termine dell’oscillazione ad alta frequenza della parete toracica e delle tecniche europee di clearance delle vie aeree in pazienti con fibrosi cistica. Torace 2010; 65 (3): 196-200. 10.1136 /
thx.2008.111492 - Chatburn RL. Eliminazione delle vie aeree assistita ad alta frequenza. Respir Care 2007; 52 (9): 1224-1235; discussione 1235-1227.
- Sievert CE, Beaner CA, Sievert CP. Utilizzo dell’oscillazione della parete toracica ad alta frequenza in una popolazione di pazienti con bronchiectasie: analisi del caso basata sui risultati. Respiratory Therapy Journal 2016; 11 (4): 34-38.
- HCUP. Panoramica del campione nazionale del dipartimento di emergenza (NEDS) 2016. Disponibile da: https://www .hcup-us.ahrq.gov / nedsoverview.jsp.
- Panoramica dei campioni di pazienti ricoverati nazionali (a livello nazionale). Disponibile presso: https://www .hcup-us.ahrq.gov / nisoverview.jsp.
- Pfuntner A, Wier LM, Steiner C. Costi per soggiorni in ospedale nel Stati Uniti, 2010: Statistical Brief # 146. Riassunti statistici del progetto di costo e utilizzo sanitario (HCUP). Rockville (MD): Agenzia per la ricerca sanitaria e la qualità (USA); 2006.
- Stein PD, Matta F. Costi delle visite al pronto soccorso e dei ricoveri per ipertensione arteriosa polmonare.
J Epidemiol Public Health Rev 2016; 1 (3). doi http://dx.doi. org / 10.16966 / 2471-8211.120 - Kangovi S, Grande D. Rimborso della gestione dell’assistenza transitoria per ridurre la riammissione di BPCO. Petto
2014; 145 (1): 149-155. 10.1378 / petto.13-0787 - Ford ES. Dimissioni ospedaliere, riammissioni e visite ED per BPCO o bronchiectasie tra adulti statunitensi: risultati
dal campione nazionale di pazienti ricoverati 2001-2012 e campione nazionale del dipartimento di emergenza 2006-2011. Petto 2015; 147 (4): 989-998. 10.1378 / petto.14-2146 - Sharma G, Kuo YF, Freeman JL, et al. Visita ambulatoriale di follow-up e visita al pronto soccorso di 30 giorni e riammissione in pazienti ospedalizzati per malattia polmonare ostruttiva cronica. Arch Intern Med 2010; 170 (18): 1664-1670. 10.1001 / archinternmed.2010.345
- Lainscak M, Kadivec S, Kosnik M, et al. L’intervento del coordinatore delle dimissioni previene i ricoveri in pazienti con BPCO: uno studio controllato randomizzato. J Am Med Dir Assoc 2013; 14 (6): 450 e451-456. 10.1016 / j.jamda.2013.03.003
- Revitt O, Sewell L, Morgan MD, et al. Il breve programma di riabilitazione polmonare ambulatoriale riduce la riammissione a seguito di un ricovero in ospedale per esacerbazione di malattia polmonare ostruttiva cronica. Respirologia 2013; 18 (7): 1063-1068. 10.1111 / resp.12141
- Milne RJ, Hockey H, Rea H. La terapia di umidificazione dell’aria a lungo termine è conveniente per i pazienti con broncopneumopatia cronica ostruttiva moderata o grave o bronchiectasie. Value Health 2014; 17 (4): 320-327. 10.1016 / j.jval.2014.01.007
- Chakravorty I, Chahal K, Austin G. Uno studio pilota sull’impatto dell’oscillazione ad alta frequenza della parete toracica in pazienti con malattia polmonare ostruttiva cronica con ipersecrezione di muco. Int J Chron Obstruct Pulmon Dis 2011; 6: 693-699. 10.2147 / COPD. S22896.
- Martınez-Garcıa MA, et al. Valore prognostico della bronchiectasia nei pazienti con malattia polmonare ostruttiva cronica da moderata a grave. Am J Respir Crit Care Med 2013; Vol 187, Iss. 8, pagg. 823–831.
- O’Donnell AE. Bronchiectasie. Chest 2008; 134: 815–82.
- Sito web dei Centers for Disease Control and Prevention – Antibiotic / Antimicrobial Resistance https://www .cdc.gov / drugresistance /