Cyclohexane Molecule (Italiano)
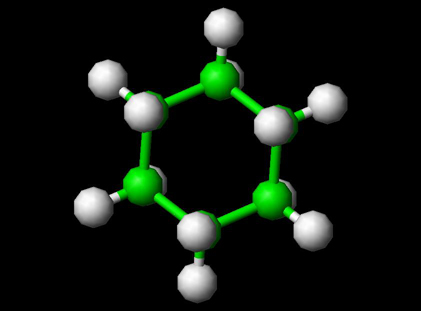
Il cicloesano è un cicloalcano con la formula molecolare C6H12. Il cicloesano è utilizzato come solvente non polare per l’industria chimica e anche come materia prima per la produzione industriale di acido adipico e caprolattame, entrambi intermedi utilizzati nella produzione di nylon. Su scala industriale, il cicloesano viene prodotto facendo reagire il benzene con l’idrogeno. Grazie alle sue proprietà chimiche e conformazionali uniche, il cicloesano viene utilizzato anche nei laboratori di analisi e come standard.
Molecola di cicloesano che utilizza Jsmol vedi – Per strutture 3D
Struttura del cicloesano Molecola
L’anello a 6 vertici non è conforme alla forma di un esagono perfetto. La conformazione di un esagono piano 2D piatto ha una notevole deformazione angolare dovuta al fatto che i suoi legami non sono di 109,5 gradi; anche lo sforzo torsionale sarebbe considerevole a causa di tutti i legami eclissati. Pertanto, per ridurre la tensione torsionale, il cicloesano adotta una struttura tridimensionale nota come conformazione a sedia. La nuova conformazione pone i carboni ad un angolo di 109,5 °. La metà degli idrogeni si trova nel piano dell’anello (equatoriale) mentre l’altra metà è perpendicolare al piano (assiale). Questa conformazione consente la struttura più stabile del cicloesano. Esiste un’altra conformazione del cicloesano, nota come conformazione della barca, ma si converte nella formazione della sedia leggermente più stabile. Se il cicloesano è mono-sostituito con un sostituente grande, molto probabilmente il sostituente si troverà attaccato in una posizione equatoriale, poiché questa è la conformazione leggermente più stabile.
Il cicloesano ha l’angolo più basso e la deformazione torsionale di tutti i cicloalcani, di conseguenza il cicloesano è stato considerato uno 0 nella deformazione totale dell’anello, una combinazione di deformazione angolare e torsionale. Questo rende anche il cicloesano il più stabile dei cicloalcani e quindi produrrà la minor quantità di calore una volta bruciato rispetto agli altri cicloalcani.
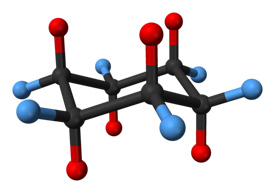
Una molecola di cicloesano in chairconformation. Gli atomi di idrogeno nelle posizioni assiali sono mostrati in rosso, mentre quelli nelle posizioni equatoriali sono in blu.
Reazioni con il cicloesano
Il cicloesano puro di per sé è piuttosto non reattivo, essendo un non polare, idrocarburo idrofobo. Può reagire con acidi molto forti come il sistema superacido HF + SbF5 che causerà protonazione forzata e “cracking degli idrocarburi”. I cicloesani sostituiti, tuttavia, possono essere reattivi in una varietà di condizioni, molte delle quali sono importanti per la chimica organica. Il cicloesano è altamente infiammabile.
Derivati del cicloesano
La disposizione specifica dei gruppi funzionali nei derivati del cicloesano, e in effetti nella maggior parte delle molecole di cicloalcano, è estremamente importante nelle reazioni chimiche, specialmente nelle reazioni che coinvolgono i nucleofili. I sostituenti sull’anello devono trovarsi nella formazione assiale per reagire con altre molecole. Ad esempio, la reazione del bromocicloesano e di un comune nucleofilo, un anione idrossido, produrrebbe cicloesene.
Questa reazione, comunemente nota come reazione di eliminazione o dealogenazione (in particolare E2), richiede che il sostituente del bromo sia nella formazione assiale, opponendosi a un altro atomo di H assiale per reagire. Supponendo che il bromocicloesano fosse nella formazione appropriata per reagire, la reazione E2 inizierebbe come tale:
- Il legame della coppia di elettroni tra il C-Br si sposta verso il Br, formando Br∠‘e impostandolo privo di cicloesano
- Il nucleofilo (-OH) dà una coppia di elettroni all’adiacente assiale H, lasciando H libero e legandosi ad esso per creare H2O
- Il legame di coppia di elettroni tra l’adiacente l’assiale H si sposta sul legame tra i due CC rendendolo C = C
Nota: tutti e tre i passaggi avvengono simultaneamente, caratteristica di tutte le reazioni E2.
La reazione di cui sopra genererà principalmente reazioni E2 e di conseguenza il prodotto sarà principalmente (~ 70%) cicloesene. Tuttavia, la percentuale varia a seconda delle condizioni e, in generale, competono due diverse reazioni (E2 e Sn2). Nella reazione di cui sopra, una reazione Sn2 sostituirebbe invece il bromo con un gruppo idrossile (OH-), ma ancora una volta, il Br deve essere assiale per reagire. Una volta completata la sostituzione SN2, il gruppo OH appena sostituito tornerebbe rapidamente alla posizione equatoriale più stabile (~ 1 millisecondo) .Utilizzi
Commercialmente la maggior parte del cicloesano prodotto viene convertito in una miscela di cicloesanone-cicloesanolo mediante catalitico ossidazione. L’olio di KA viene quindi utilizzato come materia prima per acido adipico e caprolattame. In pratica, se il contenuto di cicloesanolo dell’olio KA è superiore al cicloesanone, è più probabile (economico) essere convertito in acido adipico e, nel caso inverso, la produzione di caprolattame è più probabile. Tale rapporto nell’olio KA può essere controllato selezionando opportuni catalizzatori di ossidazione. Parte del cicloesano viene utilizzata come solvente organico.
Cicloesano nella ricerca
Sebbene si sappia già molto su questo idrocarburo ciclico, la ricerca è ancora in corso su miscele di cicloesano e benzene e cicloesano in fase solida per determinare le rese di idrogeno della miscela quando irradiata a 195 ° C.
Storia
A differenza di composti come il benzene, il cicloesano non può essere facilmente ottenuto da risorse naturali come il carbone. Verso la fine del diciannovesimo secolo i primi ricercatori chimici dovettero dipendere dalla sintesi organica. Ci sono voluti 30 anni per rimpolpare i dettagli. Nel 1867 Marcellin Berthelot ridusse il benzene con acido idroiodico a temperature elevate. Ha erroneamente identificato il prodotto di reazione come n-esano non solo per la comoda corrispondenza del punto di ebollizione (69 ° C) ma anche perché non credeva che il benzene fosse una molecola ciclica (come il suo contemporaneo August Kekule) ma piuttosto una sorta di associazione di acetilene. Nel 1870 uno dei suoi scettici Adolf von Baeyer ripeté la reazione e pronunciò lo stesso prodotto di reazione esaidrobenzene e nel 1890 Vladimir Markovnikov credette di essere in grado di distillare lo stesso composto dal petrolio del Caucaso chiamando la sua miscela esanaftene
Nel 1894 Baeyer cicloesano sintetizzato a partire da una condensazione Dieckmann di acido pimelico seguita da riduzioni multiple. e nello stesso anno E. Haworth e W.H. Perkin Jr. (1860-1929) fece lo stesso in una reazione di Wurtz di 1,6-dibromoesano. Sorprendentemente i loro cicloesani bollirono più in alto di 10 ° C rispetto all’esaidrobenzene o all’esanaftene, ma questo enigma fu risolto nel 1895 da Markovnikov, NM Kishner e Nikolay Zelinsky quando hanno nuovamente diagnosticato l’esaidrobenzene e l’esanaftene come metilciclopentano, il risultato di una reazione di riarrangiamento inaspettato.