Frontiere della fisiologia
Introduzione
I barocettori arteriosi fungono da sensori in prima linea per rilevare i cambiamenti della pressione sanguigna nel flusso sanguigno. I cambiamenti nella pressione sanguigna stimolano le terminazioni nervose meccanosensibili che sono localizzate nelle pareti arteriose. La forza meccanica viene trasdotta in segnali elettrici ai terminali nervosi, con conseguente attivazione del potenziale d’azione dipendente dalla pressione nei neuroni dei barocettori. I segnali nervosi si propagano quindi al centro di controllo cardiovascolare nel tronco encefalico per la regolazione del baroriflesso della pressione sanguigna (Levy MN, 2007). Inoltre, le strutture sopra-midollari, incluso il nucleo cuneiforme del mesencefalo e la corteccia prefrontale mediale ventrale, hanno anche un ruolo inibitorio nella regolazione del baroriflesso (Verberne et al., 1997).
Ci sono due barocettori arteriosi, vale a dire, i barocettori aortici e i barocettori carotidi, situati rispettivamente nello strato avventizio dell’arco aortico e delle arterie carotidi. I barocettori aortici rilevano la pressione sanguigna nell’aorta. I corpi cellulari (soma) dei barocettori aortici si trovano nel ganglio nodoso (NG) (Figura 1). I segnali nervosi dai terminali nervosi del barocettore aortico vengono trasmessi al ganglio nodoso attraverso un nervo sensoriale chiamato nervo depressore aortico (ADN) (Figura 1). I barocettori carotidi rilevano la pressione sanguigna nell’arteria carotide, che fornisce sangue al cervello. I terminali nervosi dei barocettori carotidi si trovano bilateralmente alle biforcazioni dell’arteria carotide, vicino all’arteria carotide interna. I segnali nervosi dai barocettori carotidi viaggiano lungo i nervi del seno carotideo (CSN) fino al loro soma localizzato nel ganglio petroso (PG). Il ganglio petroso sporge oltre il forame giugulare (Figura 1) (McDonald, 1983; Shoukas et al., 1991; Vander et al., 1998; Sato et al., 1999; Donnelly e Rigual, 2000; Weijnen et al., 2000) . Poiché i barocettori aortici rilevano la pressione sanguigna nell’aorta, che fornisce sangue all’intera circolazione sistemica, si prevede che questi barocettori giochino un ruolo funzionale importante nel mantenimento della pressione sanguigna sistemica complessiva. D’altra parte, i barocettori carotidi rilevano la pressione del sangue che viene erogato al cervello. Questi barocettori possono essere più importanti per il mantenimento di una pressione sanguigna cerebrale stabile e del flusso sanguigno cerebrale.
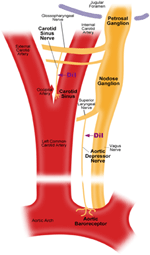
Figura 1. Diagramma schematico dei terminali e dei nervi dei barocettori aortico e carotideo. Diagramma che illustra le posizioni anatomiche dei terminali nervosi dei barocettori aortico e carotideo, delle loro fibre nervose e delle regioni somata. I terminali dei barocettori aortici si trovano nell’arco aortico. La sua fibra nervosa afferente è il nervo depressore aortico. Il soma è nel ganglio nodoso (NG). Il barorecettore carotideo è posizionato nell’arteria carotide interna vicino alla biforcazione carotidea. Il suo nervo afferente è il nervo del seno carotideo. Il soma si trova nel ganglio petroso (PG).
Ci sono rapporti contrastanti su quali barocettori, barocettori aortici o carotidi barocettori, sono più sensibili al cambiamento della pressione sanguigna. Alcuni ricercatori hanno riferito che i barocettori carotidi sono più sensibili alla pressione (Donald e Edis, 1971; Fadel et al., 2003), mentre altri ritengono che i barocettori aortici siano più sensibili alla pressione (Glick e Covell, 1968; Pickering et al., 2008), e altri ancora non hanno riportato differenze nella sensibilità alla pressione tra questi due barocettori (Hainswor et al., 1970; James e Daly, 1970). Tuttavia, quasi tutti questi studi precedenti hanno utilizzato solo le risposte baroriflesse (come la frequenza cardiaca e l’attività del nervo simpatico renale) come punti finali per il test di sensibilità dei barocettori. Non esiste ancora uno studio che registri e confronti direttamente la sensibilità alla pressione dei neuroni del barocettore aortico e carotideo di per sé.
Qui abbiamo utilizzato una pinza di pressione ad alta velocità per alterare la pressione idrostatica all’interno dei neuroni dei barocettori e misurata. le corrispondenti risposte elettrofisiologiche di questi neuroni mediante patch clamping a cellule intere. Abbiamo anche utilizzato una camera di stiramento uniassiale per allungare i neuroni barocettori e misurato i corrispondenti cambiamenti nel Ca2 + citosolico in questi neuroni. Inoltre, per gli studi su animali in vivo, abbiamo misurato il potenziale d’azione indotto dalla pressione nel depressore aortico e nei nervi del seno carotideo, che sono i nervi sensoriali rispettivamente dei barocettori aortico e carotideo.
Materiali e metodi
Animali
Tutti gli esperimenti sugli animali sono stati condotti sotto l’autorità di una licenza rilasciata dal governo della RAS di Hong Kong e l’approvazione del Comitato etico per la sperimentazione animale, l’Università cinese di Hong Kong.Ratti maschi Sprague-Dawley (S / D) (180-200 g) sono stati forniti dal Laboratory Animal Services Center dell’Università cinese di Hong Kong.
Cultura primaria
S / D i ratti sono stati anestetizzati con sodio pentobarbital (100 mg / kg). L’area cervicale sinistra è stata esposta mediante incisione sulla linea mediana in condizioni sterilizzate. Come mostrato nella Figura 1, il nervo depressore aortico o il nervo del seno carotideo è stato esposto e 2-3 mm del nervo sono stati accuratamente staccati dai tessuti circostanti mediante dissezione smussa. Cristalli fluorescenti lipofili di 1,1-dioctadecil-3,3,3 ′, 3′-tetrametilindocarbocianina (DiI) (Invitrogen) sono stati applicati intorno al nervo e ricoperti con Kwik-Sil (World Precision Instruments, USA). L’incisione è stata successivamente suturata. I ratti sono stati autorizzati a riprendersi per 5-7 giorni per consentire al colorante DiI di diffondersi retrogradamente lungo il nervo depressore aortico o il nervo del seno carotideo fino ai somati situati rispettivamente nel ganglio nodoso o nel ganglio petroso.
i neuroni sono stati isolati da ratti etichettati con DiI e tagliati a pezzi in EBSS ghiacciato. Sono stati sottoposti a digestione per 1 ora a 37 ° C con tripsina (1 mg / ml) e collagenasi IA (1 mg / ml). I singoli neuroni sono stati dispersi mediante triturazione delicata con pipetta Glass Pasteur, seguita da centrifugazione. I neuroni sono stati risospesi e coltivati in mezzi DMEM / F-12 integrati con 5% di FBS, 1% di antibiotico-antimicotico e 7S NGF (100 ng / ml). La citosina arabinofuranoside (Ara-C; 10 μM) è stata inclusa nel terreno di coltura per inibire la crescita delle cellule in divisione. I neuroni sono stati coltivati per almeno 3 giorni prima degli esperimenti. Per la registrazione del potenziale d’azione, i neuroni sono stati isolati di recente e incubati in F12 almeno 30 minuti prima degli esperimenti. Per tutti gli esperimenti, le cellule sono state incubate su vetrini prerivestiti con 0,1 mg / ml di poli-L-lisina, ad eccezione degli esperimenti di stiramento cellulare in cui le camere in silicone erano prerivestite con gelatina al 2%.
Patch Clamp
La registrazione di corrente a cella intera è stata ottenuta da un amplificatore patch clamp EPC7 (HEKA, Germania). Le pipette patch con resistenza 3–5 MΩ sono state riempite con soluzione per pipette (in mM): 130 K-gluconato, 10 KCl, 2 MgCl2, 2 Na2ATP, 0.4 Tris GTP, 1 EGTA, 10 HEPES, pH 7.25-7.3 da KOH. Le cellule sono state immerse nel liquido cerebro-spinale artificiale (ACSF) (in mM): 120 NaCl, 2 KCl, 1,2 MgSO4 · 7H2O, 1,2 KH2PO4, 26 NaHCO3, 2,5 CaCl2, 11 glucosio, equilibrato con carbogeno (95% O2 e 5 % CO2). Nella registrazione con clamp di corrente, le cellule sono state mantenute al potenziale di membrana a riposo. Un sistema di bloccaggio a pressione ad alta velocità (HSPC-1, ALA Scientific Instruments, USA) è stato utilizzato per fornire una pressione positiva alla cella attraverso la micropipetta. Le registrazioni sono state campionate a 50 kHz e filtrate a 5 kHz. I dati sono stati analizzati con PulseFit (HEKA). Tutti gli esperimenti sono stati eseguiti a temperatura ambiente.
Calcium Imaging
La misurazione citosolica del Ca2 + è stata eseguita come descritto altrove (Wong et al., 2010). In breve, le cellule sono state caricate con 5 μM Fluo-4 / AM per 40 min. La misurazione citosolica del Ca2 + è stata eseguita con una soluzione tamponata con HEPES (in mM): 140 NaCl, 2,5 KCl, 1 MgCl2, 1 CaCl2,10 HEPES, 10 glucosio, pH 7.4 da NaOH. La variazione citosolica del Ca2 + in risposta all’allungamento uniassiale è stata eseguita con STREX Cell Stretching System (ST-150, B-Bridge International, Inc.). Le cellule sono state stimolate dal 10, 20 o 30% di allungamento unidirezionale per 1 s. La risposta citosolica del Ca2 + è stata misurata a temperatura ambiente. La fluorescenza Fluo-4 è stata registrata e analizzata dal sistema di imaging confocale a scansione laser FV1000. La variazione della risposta di fluorescenza Ca2 + citosolica è stata espressa come rapporto (Fx / F0) di fluorescenza in tempo reale, dove Fx è il segnale fluo-4 / AM in tempo reale e F0 è il segnale fluo-4 / AM di base prima dello stiramento.
Registrazione dell’attività nervosa
I ratti sono stati anestetizzati con 100 mg / kg di pentobarbital di sodio. L’area cervicale è stata esposta mediante incisione sulla linea mediana. L’arteria carotide destra è stata isolata e cannulata da un catetere collegato al trasduttore di pressione (ML221, ADInstruments, USA) per la registrazione della pressione sanguigna. La vena femorale sinistra è stata cannulata per l’iniezione di fenilefrina e SNP. Il nervo depressore aortico sinistro o il nervo del seno carotideo è stato collegato a un elettrodo d’argento bipolare, seguito da un amplificatore (amplificatore CA differenziale modello 1700, A-M Systems Inc., USA). Sia la pressione sanguigna che l’attività nervosa sono state registrate continuamente dalla Tabella 5.0 (strumenti AD). L’attività nervosa è stata amplificata 10.000 volte e filtrata a una banda passante di 100–5000 Hz. I valori della pressione arteriosa media, della frequenza cardiaca e della frequenza dei picchi in risposta alla fenilefrina sono stati analizzati dal software Chart 5.0. È stata calcolata la variazione della frequenza dei picchi (frequenza degli spike dopo fenilefrina – frequenza degli spike prima della fenilefrina) in risposta alla variazione massima della pressione sanguigna (pressione arteriosa media dopo fenilefrina – pressione arteriosa media prima della fenilefrina) dopo l’iniezione di fenilefrina (Lau et al., 2016) .
Analisi statistica
Le tracce rappresentative sono state tracciate come tracce del corso del tempo. I dati di tutti gli esperimenti sono stati riassunti in un grafico a barre espresso in media ± sem di singoli esperimenti. Il test t di Student è stato utilizzato per l’analisi statistica. È stato utilizzato il test t pairwise dove appropriato.
Risultati
Proprietà dei neuroni depressori aortici e dei neuroni del seno carotideo
Dil è stato applicato al nervo depressore aortico o al nervo del seno carotideo. Pertanto, i neuroni marcati con Dil nel ganglio nodoso includevano i neuroni dei barocettori che innervano l’arco aortico ei neuroni dei chemocettori che innervano il corpo aortico. D’altra parte, i neuroni marcati con Dil Il ganglio petroso includeva i neuroni barorecettori che innervano il seno carotideo ei neuroni chemiorecettori che innervano il corpo carotideo. Abbiamo prima studiato le proprietà di base di questi neuroni con etichetta Dil. I neuroni marcati con DiI nel nodosio e il ganglio petroso sono stati coltivati separatamente e sottoposti a una corrente elettrica depolarizzante come mostrato nella Figura 2. Sono stati registrati due tipi di risposte, una ha risposto con un singolo potenziale d’azione e l’altra con potenziali d’azione continui dopo la corrente di depolarizzazione (Figura 2) (Belmonte e Gallego, 1983). Questi neuroni sono stati successivamente sottoposti a un protocollo di pressione idrostatica per testare la loro sensibilità ai cambiamenti della pressione idrostatica. Una rampa di pressione idrostatica positiva è stata applicata a livello intracellulare attraverso una micropipetta di vetro dal sistema di bloccaggio a pressione ad alta velocità (HSPC-1, ALA Scientific Instruments, USA) fino a quando i potenziali d’azione sono stati stimolati. I risultati hanno mostrato che il 45% dei neuroni dei barocettori aortici ha attivato potenziali d’azione continui in risposta alla corrente elettrica depolarizzante (Tabella 1A). Tra questi, il 91% (41% / 45%) ha anche risposto alla variazione della pressione idrostatica e ha mostrato potenziali di azione dipendenti dalla pressione (Tabella 1A). Il restante 55% dei neuroni del barocettore aortico ha attivato solo un singolo potenziale d’azione in risposta alla corrente depolarizzante (Tabella 1A) e, tra questi, il 40% (22% / 55%) potrebbe rispondere al cambiamento di pressione (Tabella 1A). Per i neuroni barorecettori carotidei, il 45% delle cellule forniva potenziali di azione continua quando erano stimolate dalla corrente depolarizzante (Tabella 1B). Tra questi, l’82% (37% / 45%) era anche sensibile alla variazione di pressione (Tabella 1B). Inoltre, tra i neuroni barorecettori carotidi che hanno attivato solo un singolo potenziale d’azione in risposta alla corrente depolarizzante, il 24% (13% / 55%) potrebbe rispondere al cambiamento di pressione (Tabella 1B).
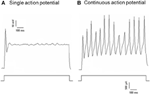
Figura 2. Registrazione del potenziale d’azione da depressori aortici coltivati e neuroni del seno carotideo. Sono mostrate le tracce dei potenziali d’azione che sono stati registrati da due neuroni depressore aortico / seno carotideo rappresentativi su una corrente depolarizzante. (A) Neuroni rappresentativi che attivano un solo potenziale d’azione sulla stimolazione corrente; (B) Neuroni rappresentativi che attivano solo potenziali d’azione continui sulla stimolazione corrente. Pannello inferiore: protocollo per l’iniezione corrente. Barra della scala, orizzontale, 100 ms, verticale, 10 mV (tracce superiori) e 500 pA (tracce inferiori). n = 27 en = 38 rispettivamente per i neuroni depressore aortico e del seno carotideo.

Tabella 1. Proprietà del depressore aortico e dei neuroni del seno carotideo.
Indipendentemente dal fatto che attivassero un singolo potenziale d’azione o potenziali d’azione continui, il 63% dei neuroni dei barocettori aortici marcati con Dil è risultato sensibile al cambiamento di pressione, mentre solo il 50% dei neuroni dei barocettori carotidi marcati con Dil era sensibile al cambiamento di pressione (Tabella 1).
Sensibilità allo stiramento dei neuroni barorecettori aortici e carotidi
È stata analizzata la soglia di pressione per la scarica del potenziale d’azione. Come mostrato nella Figura 3, i neuroni dei barocettori aortici avevano una soglia di pressione inferiore (24 ± 4 mmHg) rispetto a quella dei neuroni dei barocettori carotidi (39 ± 4 mmHg).

Figura 3. Sensibilità dei neuroni barorecettori aortici e carotidi alla pressione idrostatica. (A, B) Pannello superiore, tracce rappresentative del corso temporale che illustrano le attivazioni del potenziale d’azione dipendente dalla pressione nei neuroni barorecettori aortici (A) e carotidi (B). La rampa di pressione (pannello inferiore) è stata applicata all’interno delle celle attraverso una micropipetta utilizzando un sistema di bloccaggio a pressione ad alta velocità (HSPC). Barra della scala orizzontale, 1 s, verticale, 20 mV e 20 mmHg. (C) Riepilogo che mostra la soglia di pressione che avvia le attivazioni del potenziale d’azione nei neuroni dei barocettori aortici e carotidi. n = 13 per i neuroni dei barocettori aortici en = 15 per i neuroni dei barocettori carotidi. *** p < 0,01, dal test t di Student.
Risposta Ca2 + indotta da stiramento nei neuroni barorecettori
depressore aortico coltivato o neuroni del seno carotideo sono stati sottoposti a 10, 20 o 30% dell’allungamento uniassiale con STREX Cell Stretching System, che tenta di imitare lo stiramento dei vasi sanguigni sotto pressione sanguigna. I risultati hanno mostrato che un allungamento uniassiale del 20% ha indotto un marcato aumento della fluorescenza citosolica del Ca2 + nei neuroni dei barocettori aortici ma non nei neuroni dei barocettori carotidi (Figure 4A-C). Inoltre, l’entità dell’aumento della fluorescenza del Ca2 + in risposta all’allungamento uniassiale del 30% era molto più alta nei neuroni dei barocettori aortici rispetto ai neuroni dei barocettori carotidi (Figure 4A – C).
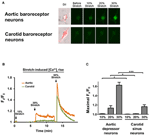
Figura 4. Sensibilità del depressore aortico e dei neuroni del seno carotideo all’allungamento uniassiale. Le cellule sono state caricate con il colorante fluorescente sensibile al Ca2 + Fluo-4 / AM. Vengono mostrate immagini rappresentative (A) e tracce del decorso temporale (B) degli aumenti citosolici relativi del Ca2 + in risposta all’allungamento uniassiale del 10, 20 e 30% della lunghezza delle cellule nei neuroni depressori aortici e del seno carotideo. (C) Riepilogo del massimo aumento citosolico di Ca2 + in risposta a diversi gradi di allungamento. La variazione del Ca2 + citosolico è stata espressa come Fx / F0, dove Fx è il segnale fluo-4 / AM in tempo reale e F0 è il segnale fluo-4 / AM di base prima dello stretching. Media ± s.e.m. (n = 5). * p < 0,05, *** p < 0,01 rispetto al controllo corrispondente, mediante test t a coppie.
Attività nervosa dei barocettori in vivo
L’attività nervosa dei due barocettori è stata studiata in vivo. La fenilefrina è stata iniettata per via endovenosa. Le variazioni della pressione sanguigna in seguito all’applicazione di fenilefrina sono mostrate nel pannello superiore delle Figure 5A, B. Le variazioni della sottosequenza nell’attività del nervo barocettore sono mostrate nel pannello inferiore (Figure 5A, B). L’attività nervosa indotta dalla pressione era molto più alta nel nervo depressore aortico rispetto al nervo del seno carotideo (Figure 5A, B). La variazione della frequenza dei picchi per aumento mmHg è riassunta nella Figura 5C. Il risultato ha indicato che i barocettori aortici sono più sensibili alla pressione idrostatica rispetto ai barocettori carotidei in vivo.
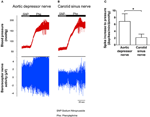
Figura 5. Attività nervosa dei barocettori nel ratto in vivo. (A, B) Tracce rappresentative che mostrano il cambiamento nell’attività del nervo depressore aortico (A) e del nervo del seno carotideo (B) all’aumento della pressione sanguigna. In entrambi (A, B), il pannello superiore era la variazione della pressione sanguigna prima e dopo l’applicazione di Phe come indicato dalle barre orizzontali. Il pannello inferiore era il corrispondente cambiamento nell’attività nervosa. (C) Dati riassunti che mostrano la variazione dell’attività nervosa per unità di variazione della pressione sanguigna. Media ± s.e.m. (n = 8). * p < 0,05 rispetto al controllo nei barocettori aortici, mediante t-test a coppie.
Espressione dei canali TRP
Diversi canali TRP sono stati segnalati come sensibili al meccanismo, inclusi TRPC1, -C3, -C5, -C6, -V1, -V4, -P2 (O “Neil e Heller, 2005; Christensen e Corey, 2007; Pedersen e Nilius, 2007; Patel et al., 2010; Lau et al., 2016). Qui, abbiamo studiato il possibile ruolo di questi canali TRP meccanosensibili in relazione all’aorta e sensibilità del barorecettore carotideo. Le espressioni di mRNA di questi canali nel ganglio nodoso e petroso sono state confrontate. È stato riscontrato che le espressioni di TRPV4 e TRPC6 erano più elevate nel ganglio nodoso rispetto al ganglio petroso (Figura 6). È possibile che il più alto l’espressione di canali meccanosensibili nel ganglio nodoso può contribuire alla maggiore sensibilità.
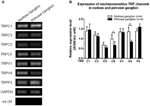
Figura 6. Espressione di canali TRP meccanosensibili nel ganglio nodoso e petroso. (A) Immagini di gel rappresentative che confrontano il livello di espressione di mRNA dei canali TRP meccanosensibili, (TRPC1, -C3, -C5, -C6, -V1, -V4, -P2) tra neuroni gangliari nodosi e petrosi. L’analisi RT-PCR semiquantitativa è stata utilizzata per confrontare i livelli di espressione di mRNA di diversi canali TRP rispetto all’espressione di mRNA di GAPDH. I risultati di 9 esperimenti sono stati riassunti in (B). I valori erano in media ± sem. * p < 0,05, mediante t-test a coppie.
Discussione
Nel presente studio, sono state confrontate le proprietà meccanosensibili dei barocettori aortico e carotideo. Studi con patch clamp a cellule intere hanno dimostrato che, rispetto ai neuroni del seno carotideo, una percentuale più alta di neuroni depressori aortici era sensibile allo stiramento. Inoltre, la soglia di pressione che potrebbe avviare potenziali attivazioni d’azione è stata trovata inferiore nei neuroni dei barocettori aortici rispetto ai neuroni dei barocettori carotidi. L’aumento del Ca2 + citosolico indotto da stiramento uniassiale è stato anche confrontato tra il depressore aortico e i neuroni del seno carotideo.L’entità dell’aumento citosolico del Ca2 + in risposta all’allungamento uniassiale era molto più alta nei neuroni dei barocettori aortici rispetto ai neuroni dei barocettori carotidi. I neuroni dei barocettori aortici mostravano anche una soglia inferiore di risposte citosoliche di Ca2 + all’allungamento uniassiale. In un’altra serie di esperimenti, abbiamo scoperto che l’aumento indotto dalla pressione nelle attivazioni del potenziale d’azione era maggiore nel nervo depressore aortico rispetto al nervo del seno carotideo. Presi insieme, i nostri dati forniscono una forte evidenza del fatto che i barocettori aortici sono più sensibili alla pressione sanguigna rispetto ai barocettori carotidi.
In precedenza, sono stati compiuti molti sforzi per comprendere la differenza di sensibilità tra i due barocettori. Tuttavia, i risultati sono controversi. Alcuni rapporti hanno concluso che i barocettori aortici sono più sensibili ai cambiamenti di pressione (Glick e Covell, 1968; Fan et al., 1996; Pickering et al., 2008), mentre altri hanno affermato che i barocettori carotidi sono più sensibili ai cambiamenti di pressione (Donald e Edis, 1971; Fadel et al., 2003). Tuttavia, quasi tutti questi studi precedenti hanno coinvolto procedure chirurgiche altamente complicate e alla fine hanno utilizzato risposte barorecettrici, come la frequenza cardiaca e l’emissione simpatica renale, come punti finali per il test di sensibilità dei barocettori. Le procedure chirurgiche complicate tendono a introdurre errori sperimentali, che possono portare a conclusioni controverse. Inoltre, è anche possibile una variazione dipendente dalla specie animale nella sensibilità dei barocettori. Inoltre, la risposta baroriflessa non è solo influenzata dalla sensibilità dei barocettori, ma anche da molti altri fattori tra cui la conduzione nervosa, la mediazione centrale, la contrattilità dei vasi sanguigni e la funzione cardiaca. Pertanto, le prove degli studi precedenti sono indirette e difficilmente ideali. Ad oggi, mancano studi diretti che confrontino la sensibilità alla pressione dei neuroni barorecettori aortici e carotidi. In questo studio, la meccanosensibilità è stata studiata direttamente nei neuroni barorecettori. I dati suggeriscono fortemente che i barocettori aortici sono più sensibili alla pressione rispetto ai barocettori carotidi. Queste informazioni possono avere un’importante rilevanza fisiologica nella regolazione della pressione sanguigna.
Non è chiaro quali siano i meccanismi alla base della differenza di sensibilità alla pressione tra i barocettori aortici e carotidi. Abbiamo confrontato il livello di espressione di diversi canali TRP meccanosensibili (Figura 6) (O “Neil e Heller, 2005; Christensen e Corey, 2007; Pedersen e Nilius, 2007; Patel et al., 2010). I nostri risultati hanno mostrato che i neuroni dei barocettori aortici hanno una maggiore espressione di diversi canali TRP meccanosensibili tra cui TRPV4 e TRPC6. È possibile che una maggiore espressione di TRPV4 e / o TRPC6 possa contribuire alla sensibilità all’alta pressione dei barocettori aortici. Sono necessari ulteriori studi per verificare il ruolo di questi canali ionici.
È stato precedentemente riportato che il ganglio nodoso e il ganglio petroso contengono due diversi tipi di neuroni (Belmonte e Gallego, 1983). Uno di loro fornisce potenziali d’azione continui su stimolazione elettrica, mentre l’altro fornisce solo una singola azione potenziale alla stimolazione. Gli autori hanno assegnato i primi come neuroni sensibili alla pressione e hanno assegnato i secondi come neuroni chemio-sensibili. I nostri risultati indicano che potrebbe non essere appropriato te di assegnare i neuroni sensibili alla pressione e i neuroni insensibili alla pressione solo in base al fatto che attivino un singolo potenziale d’azione o potenziali d’azione continui in risposta alla corrente depolarizzante. In effetti, una grande percentuale di cellule che attivano un singolo potenziale d’azione in risposta alla stimolazione elettrica sono anche sensibili alla pressione, e quindi appartengono ai neuroni barorecettori sensibili alla pressione (Figura 2 e Tabella 1).
In sintesi, il presente studio fornisce la prova che i barocettori aortici sono più sensibili alla pressione rispetto ai barocettori carotidi e aggiunge nuove informazioni alla comprensione della fisiologia di base.
Contributi dell’autore
EL e XY progettano gli esperimenti e redigono il manoscritto. EL, CL e YY eseguono gli esperimenti. XY, YH, AM e LJ hanno rivisto il manoscritto. Tutti gli autori hanno approvato la versione finale del manoscritto.
Finanziamento
Questo lavoro è stato sostenuto da sovvenzioni del Comitato per le sovvenzioni di ricerca di Hong Kong CUHK478710, CUHK478413, AoE / M-05/12, TBRS / T13-706 / 11, China National Science Foundation Grant 31470912 e RGC-NSFC Joint Grant N_CUHK439 / 13.
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che potrebbe essere interpretata come un potenziale conflitto di interessi.
James, JEA e Daly, MDB (1970). Confronto delle risposte vasomotorie riflesse alla stimolazione separata e combinata dei seni carotidi e dei barocettori dell’arco aortico mediante pressioni pulsatili e non pulsatili nel cane. J. Physiol. 209, 257–293. doi: 10.1113 / jphysiol.1970.sp009165
Estratto di PubMed | Testo completo CrossRef | Google Scholar
Levy MN, P. A. (2007). Fisiologia cardiovascolare. Philadelphia, PA: Mosby Elsevier.
Vander, A. J., Sherman, J. H. e Luciano, D. S. (1998). Fisiologia umana: il meccanismo della funzione corporea. Boston, MA: WCB McGraw-Hill.