Frontiere della microbiologia cellulare e delle infezioni
Introduzione
Lo Staphylococcus aureus è un importante patogeno umano isolato dai pazienti ospedalizzati in tutto il mondo, che causa infezioni sia ospedaliere che acquisite in comunità ( Lowy, 1998). Questo patogeno è l’agente eziologico di diverse infezioni sistemiche, che colpiscono la pelle e i tessuti molli, nonché i sistemi muscolo-scheletrico e circolatorio (Lowy, 1998; Changchien et al., 2016). È stato riferito che S. aureus può sopravvivere nei macrofagi derivati da monociti umani (Kubica et al., 2008). La virulenza di S. aureus è strettamente associata a una varietà di enzimi secreti e tossine prodotte dai batteri (Otto, 2014). L’emolisina, la leucocidina (Panton-Valentine leukocidin, PVL) e la sindrome da shock tossico tossina-1 (TSST-1), che facilitano il danneggiamento della membrana dei globuli rossi, danneggiano la funzione fagocitica dei leucociti e inducono la sindrome da shock tossico rispettivamente, sono fondamentali per il processi patogeni di S. aureus (Löffler et al., 2010; Vandenesch et al., 2012; Berube e Bubeck Wardenburg, 2013; Andrey et al., 2015; Al Laham et al., 2015). Studi recenti hanno dimostrato che l’emolisina partecipa anche alla formazione del biofilm di S. aureus (den Reijer et al., 2016). La crescente prevalenza di ceppi di S. aureus multiresistenti all’interno di ambienti ospedalieri e comunitari aumenta ulteriormente i pericoli di S. aureus e rappresenta una seria sfida per la terapia clinica (Voss e Doebbeling, 1995; Evangelista Sde e de Oliveira, 2015).
Recentemente, nel nostro ospedale sono stati trovati numerosi ceppi appartenenti a una classe di S. aureus con fenotipo emolitico incompleto (SIHP). L’emolisi causata da questi ceppi SIHP è significativamente diversa dall’anello emolitico completo (fenotipo β-emolitico) prodotto in altri ceppi di S. aureus. Tuttavia, questi ceppi SIHP non sono stati ancora identificati e caratterizzati in modo completo. Per esplorare le caratteristiche microbiologiche di questi ceppi SIHP, abbiamo raccolto 60 ceppi SIHP e li abbiamo studiati utilizzando criteri multipli tra cui fenotipo emolitico, espressione del gene dell’emolisina, caratteristiche di resistenza ai farmaci e virulenza. Questo studio dimostra che i SIHP sono ceppi resistenti alla meticillina che esprimono altamente β-emolisina e possiedono un alto potenziale di virulenza.
Materiali e metodi
Ceppi batterici
Sessanta SIHP ceppi sono stati isolati da pazienti ricoverati nel secondo ospedale affiliato dell’Università di Soochow tra il 2013 e il 2015. Sono stati prelevati campioni duplicati da ciascun paziente per l’analisi. Questi isolati sono stati quindi coltivati su piastre di agar sangue di pecora Columbia (CHROMagar Company, Shanghai, Cina) a 35 ° C in un’atmosfera contenente il 5% di CO2 (v / v). L’identità dei ceppi come S. aureus è stata confermata utilizzando il sistema microbiologico automatizzato Phoenix-100 (Becton, Dickinson and Company, USA). I ceppi di controllo di S. aureus, con fenotipo emolitico completo, sono stati isolati dai pazienti nel nostro ospedale durante lo stesso periodo di tempo. Qui, S. aureus con il fenotipo emolitico completo è stato chiamato ceppi SCHP. Il ceppo di riferimento S. aureus ATCC25923 (Shanghai Center for Clinical Laboratory, Cina) ha il fenotipo emolitico completo e funge anche da ceppo di controllo. Il comitato di etica medica del secondo ospedale affiliato della Soochow University ha approvato questo studio e tutti gli isolati sono stati raccolti con il consenso del paziente in questo studio.
Analisi comparative del fenotipo emolitico incompleto
Lo S. aureus ceppi sono stati coltivati su piastre di agar sangue commerciali di diverse aziende (CHROMagar, Autobio Diagnostics Co., Ltd., Cina e BioMérieux, Cina) e piastre di agar sangue di pecora auto-preparate utilizzando polvere di agar sangue Columbia (OXIDE, UK). I batteri sono stati coltivati a 35 ° C in un’atmosfera contenente il 5% di CO2 (v / v) per 24 ore e poi sono stati sottoposti a passaggio seriale. È stato quindi osservato il fenomeno emolitico. Sono stati inoltre osservati ceppi clinicamente isolati con fenotipo emolitico completo e ceppo di riferimento ATCC25923 come controllo per analisi comparative.
Determinazione dei livelli di mRNA di quattro geni dell’emolisina di S. aureus mediante trascrizione inversa quantitativa in tempo reale PCR (qPCR)
L’estrazione dell’RNA totale dal SIHP e dal ceppo di riferimento ATCC25923 è stata eseguita come descritto in precedenza (Qin et al., 2014). Inizialmente le cellule sono state lisate utilizzando lisostafina, lisozima e proteinasi K. L’RNA è stato quindi estratto e purificato utilizzando RNeasy Mini Kit (Qiagen) secondo il protocollo raccomandato dal produttore. La qualità e la concentrazione dell’RNA sono state valutate utilizzando NanoDrop1000. L’RNA è stato quindi inverso -trascritto al cDNA utilizzando un kit di trascrizione inversa (Thermo Fisher Scientific Inc., USA) secondo le istruzioni del produttore.In breve la qPCR è stata condotta come segue: pre-denaturazione a 94 ° C per 3 min, denaturazione a 94 ° C per 30 s, ricottura a 52 ° C per 30 s, allungamento a 72 ° C per 40 s, per un totale di 45 cicli . Ogni campione aveva tre ripetizioni tecniche e tre biologiche. Il profilo trascrizionale di ciascuno dei quattro geni dell’emolisina e del gene rRNA 16s è stato determinato utilizzando il metodo 2 − ΔΔCt. Il livello di trascrizione è stato determinato rispetto all’espressione del gene rRNA 16s. Le sequenze di quattro geni dell’emolisina (hla, hlb, hlgC e hld) sono state recuperate dal database GenBank. Il software Primer 5.0 è stato utilizzato per progettare i primer (Tabella 1) e questi primer sono stati sintetizzati da Sangon Biotech Co., Ltd. (Shanghai, Cina).
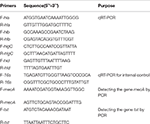
Tabella 1. Primer utilizzati in questo studio.
SPSS 17.0 è stato utilizzato per l’analisi dei dati. I dati di misurazione sono presentati come x̄ ± s. Il test T per due campioni indipendenti è stato utilizzato per confrontare l’espressione relativa di ciascuno dei quattro geni dell’emolisina. La significatività statistica è stata definita come p < 0,05.
Rilevamento dell’espressione di α-emolisina (Hla) mediante Western Blot
La concentrazione di SIHP e il ceppo di riferimento S. aureus ATCC25923 sono stati adeguati a 5,0 McFarland utilizzando un torbidimetro. La proteina totale è stata quindi estratta da ciascun campione, regolata alla stessa concentrazione e sottoposta a elettroforesi su un gel SDS-PAGE. Le proteine sono state quindi trasferite su una membrana di nitrocellulosa e la membrana è stata bloccata con il 5% di latte scremato per 1 ora. Anticorpi policlonali anti-stafilococco di capra α-emolisina (Abcam) sono stati aggiunti a una concentrazione finale di 2 μg / mL. La miscela di reazione è stata quindi incubata a 4 ° C per una notte. Dopo che la membrana è stata lavata, sono stati aggiunti anticorpi IgG anti-capra di coniglio marcati con HRP diluiti 1: 1000 e incubati a 37 ° C per 2 h. Infine, sono stati aggiunti substrati chemiluminescenti per lo sviluppo del colore. L’espressione dell’α-emolisina è stata infine osservata sotto l’imager.
Test di suscettibilità antimicrobica di SIHP
Il metodo di diluizione del brodo di microtitolazione è stato utilizzato per eseguire lo screening della suscettibilità antimicrobica. La procedura è stata eseguita secondo il manuale operativo del sistema microbiologico automatizzato Phoenix-100. I risultati di questo screening sono stati interpretati utilizzando i criteri M100-S24 introdotti dal Clinical and Laboratory Standards Institute (CLSI; Clinical and Laboratory Standards Institute, 2014). Lo stato di S. aureus resistente alla meticillina (MRSA) è stato determinato utilizzando la MIC (concentrazione inibitoria minima) di due antibiotici. Per i ceppi SIHP, ≥4 μg / mL era la MIC per l’ossallicina e ≥8 μg / mL era la MIC per cefoxitina.
Rilevazione dei geni mecA e tst
Tutti i 60 SIHP ceppi sono stati testati per il gene di resistenza ai farmaci mecA e il gene di virulenza tst. L’estrazione per ebollizione del DNA genomico è stata condotta dopo la lisi cellulare utilizzando lisostafina. I geni mecA e tst sono stati poi amplificati dal DNA genomico utilizzando il kit DreamGreen Taq. Le condizioni della PCR erano le seguenti: pre-denaturazione a 94 ° C per 3 min, denaturazione a 94 ° C per 30 s, ricottura a 50 ° C per 30 s, estensione a 72 ° C per 1 min. I prodotti della PCR sono stati sequenziati e analizzati da BLAST per confermare che fossero i prodotti attesi. Le sequenze del gene di resistenza ai farmaci mecA e del gene di virulenza tst di S. aureus sono state recuperate dal database GenBank. Il software Primer 5.0 è stato utilizzato per progettare i primer (Tabella 1) e questi primer sono stati sintetizzati da Sangon Biotech Co., Ltd. (Shanghai, Cina).
Rilevazione della sopravvivenza dei ceppi SIHP di S. aureus in Macrofagi
Per confrontare la sopravvivenza dei ceppi di S. aureus SIHP nei macrofagi con quella dei ceppi di S. aureus SCHP negativi al tst, la linea cellulare dei monociti umani THP-1 è stata mantenuta in RPMI-1640 contenente il 10% (v / v) FBS a 37 ° C in un’atmosfera contenente il 5% (v / v) di CO2. Per l’infezione dei macrofagi, le cellule THP-1 sono state seminate a 5 × 105 cellule per pozzetto in piastre di coltura tissutale a 24 pozzetti e indotte a differenziare con 10-7 M phorbol 12-miristato 13-acetato (PMA) per 48 h. Circa 3 × 108 unità formanti colonie (CFU) di batteri in fase logaritmica (OD600 0,5–0,6) sono state pellettizzate mediante centrifugazione, lavate due volte con PBS e risospese in 1 ml di RPMI-1640. Quindi i batteri sono stati aggiunti al monostrato cellulare a un MOI di 20: 1 e centrifugati per 5 minuti a 1000 rpm. Le cellule infette sono state incubate per 20 minuti a 37 ° C, quindi sono state lavate tre volte con PBS preriscaldato (pH 7,4) e incubate per un’altra ora in un mezzo contenente 100 μg / ml di gentamicina per uccidere i batteri extracellulari. Le cellule sono state lavate e lisate per quantificare il batterico intracellulare come campione di tempo zero (T0). Ulteriori cellule sono state raccolte dopo 12 o 24 ore di incubazione in presenza di terreno di coltura tissutale integrato fresco contenente 12 μg / ml di gentamicina.La crescita dei batteri nelle cellule THP-1 è stata determinata dividendo il numero di batteri intracellulari a 12 ore o 24 ore per il numero al tempo 0 (T12 / T0 o T24 / T0). L’esperimento è stato ripetuto in modo indipendente tre volte.
Rilevazione della secrezione di citochine di macrofagi infettati da ceppi SIHP di S. aureus
I supernatanti di coltura dei macrofagi THP-1 infettati per 12 ore da batteri raccolto. I livelli di citochine sono stati misurati mediante citometria a flusso FACSCalibur (BD) utilizzando un CBA Human Thl / Th2 Cytokine Kit II (BD) secondo le istruzioni del produttore.
Multilocus Sequence Typing and Analysis
Risultati
Fenotipo emolitico di ceppi SIHP su piastre di sangue di agar di pecora
Come mostrato nelle Figure 1A, B, l’anello emolitico completo (fenotipo β-emolitico) è stato osservato nel controllo S . aureus dopo aver coltivato ceppi su piastre di agar sangue per 24 ore. Tuttavia, diversi fenotipi emolitici (chiamati qui fenotipo emolitico incompleto) sono stati visualizzati nei ceppi SIHP. Inoltre, il fenotipo emolitico incompleto potrebbe essere osservato nei ceppi SIHP cresciuti in diversi ambienti ambientali condizioni comprese le condizioni microaerofile, aerobica e anaerobica rispettivamente (Figure 1C – E). Inoltre, dopo 10 passaggi seriali, questo fenotipo emolitico incompleto era ancora mantenuto (Figura 1F).
Relativa Livelli di espressione dell’mRNA di quattro geni dell’emolisina
Come mostrato nella Figura 2, i livelli di espressione dei quattro geni dell’emolisina hla, hlb, hlgC e hld nei ceppi SCHP non hanno mostrato differenze statisticamente significative (p > 0,05) rispetto a quello dei ceppi di controllo ATCC25923. Tuttavia, i livelli di espressione di hla, hlgC e hld nei ceppi SIHP sono stati significativamente soppressi rispettivamente di 50, 16,7 e 8,3 volte (p < 0,05) rispetto a quelli di ceppi di controllo ATCC25923 e ceppi SCHP, mentre l’espressione di hlb nei ceppi SIHP era significativamente aumentata di 7,7 volte rispetto ai controlli (p < 0,05).
Rilevamento dell’α-emolisina mediante Western Blot
L’α-emolisina codificata da il gene hla è una tossina formatrice di pori secreta da S. aureus e il suo peso molecolare è di 33 kDa (Andrey et al., 2015; Al Laham et al., 2015). L’analisi Western blot ha mostrato che l’espressione dell’α-emolisina nei ceppi SIHP era 40 volte inferiore a quella dei ceppi SCHP e di controllo, il che è coerente con i dati qRT-PCR (Figura 3).

Figura 3. Western blot di α-emolisina in S. aureus. ATCC29213: controlla S. aureus con il fenotipo emolitico completo; SCHP: S. aureus con il fenotipo emolitico completo isolato da campioni clinici nello stesso periodo; SIHP: S. aureus con un fenotipo emolitico incompleto.
Resistenza ai farmaci di SIHP
Sensibilità ai farmaci testata utilizzando diluizioni di brodo di microtitolazione hanno dimostrato che i valori MIC per oxacillina e cefoxitina erano tutti > 2 e > 8 μg / mL rispettivamente in 60 colorazioni SIHP . Secondo le linee guida CLSI M100-S24, tutti i 60 ceppi SIHP sono classificati come ceppi MRSA. La PCR ha anche rilevato il gene mecA in tutti i 60 ceppi.
Test per il gene tst
Il gene tst è un importante fattore di virulenza in S. aureus. La PCR ha mostrato che tutti i 50 ceppi SIHP erano portatori di geni tst.
La capacità di sopravvivenza dei ceppi SIHP di S. aureus nei macrofagi è maggiore di quella di S. aureus tst negativo
Abbiamo confrontato le capacità di sopravvivenza intracellulare dei ceppi SIHP e del ceppo SCHP negativo nei macrofagi. Contando il numero di batteri recuperati dalle piastre, abbiamo scoperto che la capacità di sopravvivenza intracellulare del ceppo SIHP era molto più alta di quella del ceppo di S. aureus tst negativo dopo macrofagi derivati da THP-1 infetti 12 o 24 h (Figura 4). In via preliminare, abbiamo ipotizzato che i ceppi SIHP possiedano una potenziale virulenza elevata ed è stato suggerito che SIHP dovrebbe essere prestata maggiore attenzione in ospedale.
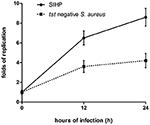
Figura 4. Sopravvivenza di ceppi SIHP e S. aureus tst negativo nei macrofagi derivati da THP-1. Dopo che i macrofagi sono stati infettati dai batteri per 12 e 24 ore, i macrofagi sono stati lisati e i batteri sopravvissuti intracellulari sono stati piastrati su LB agar. Le pieghe di replicazione dei batteri sopravvissuti intracellulari sono state calcolate in base al numero di colonie sulla piastra di agar LB sopra.
Le differenze di secrezione di citochine e chemochine di macrofagi infettati da ceppi SIHP di S. aureus e S. aureus tst negativo
Per confrontare le differenze di secrezione di citochine e chemochine in macrofagi derivati da THP-1 infettati da ceppo SIHP e tst negativo da S.aureus, abbiamo rilevato citochine pro-infiammatorie mediante citometria a flusso nel supernatante di coltura di macrofagi infettati da ceppi SIHP e ceppo di S. aureus tst negativo. I risultati hanno mostrato un’induzione significativamente più alta di IL-2, IL-6 e IL-17A nei ceppi SIHP, ma non da S. aureus tst negativo, suggerendo che i ceppi SIHP inducono risposte di citochine / chemochine nei macrofagi (Figura 5). Le altre citochine IL-4, IL-10, INF-γ e TNF secrete dai macrofagi non presentavano differenze evidenti tra i ceppi SIHP e i gruppi affetti da S. aureus tst negativo.
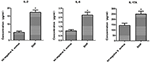
Figura 5. Rilevazione di citochine e chemochine secrete dai macrofagi infettati da S. aureus. * P < 0,05.
Digitazione in sequenza Multilocus
Abbiamo determinato il genotipo multilocus di 60 isolati SIHP raccolti da pazienti ricoverati nel nostro ospedale tra il 2013 e il 2014. È stato applicato lo schema a sette locus raccomandato nel database MLST di S. aureus. L’analisi MLST ha mostrato che tutti i ceppi SIHP sono stati classificati nel clone ST5.
Discussione
L’emolisina è uno dei fattori di virulenza più importanti per S. aureus (Wiseman, 1975). Gli effetti combinati di ciascuno dei quattro tipi di emolisina provocano la distruzione della membrana dei globuli rossi che porta alla formazione dell’anello emolitico completamente trasparente sulle piastre di agar sangue. Negli ultimi anni, SIHP sono stati trovati nei campioni clinici del secondo ospedale affiliato dell’Università di Soochow. In questo studio, abbiamo cercato di identificare questi ceppi e studiarne le caratteristiche in microbiologia. Inizialmente, abbiamo utilizzato diverse piastre di agar sangue di pecora commerciali o auto-preparate per isolare, incubare e passare in serie i ceppi. Abbiamo dimostrato che ci sono alcuni ceppi che mostrano e mantengono un fenotipo emolitico incompleto anche dopo una subcoltura prolungata. Pertanto, si può escludere la possibilità che questo fenotipo sia indotto da fattori non batterici. I nostri studi suggeriscono che SIHP potrebbe essere un sottoinsieme di ceppi unici di S. aureus.
Studi precedenti hanno suggerito che i globuli rossi di coniglio sono altamente sensibili all’α-emolisina (Hildebrand et al., 1991). Berube et al. hanno riferito che l’effetto dell’α-emolisina sulla lisi dei globuli rossi è dipendente dalla concentrazione (Berube e Bubeck Wardenburg, 2013). La γ-emolisina può danneggiare i globuli rossi dell’uomo e degli animali (Kaneko e Kamio, 2004). Mentre la δ-emolisina danneggia i globuli rossi, solo ad alte concentrazioni, forma un poro transmembrana che lisi la membrana cellulare (Verdon et al., 2009). In questo studio, abbiamo dimostrato che l’espressione di quattro emolisine di ceppi SIHP e ceppi SCHP ha profili di espressione trascrizionale significativamente diversi. L’espressione di α-, γ-, δ-emolisina nei ceppi SIHP, che potrebbero danneggiare direttamente i globuli rossi, è molto inferiore a quella dei ceppi SCHP, mentre la β-emolisina ha livelli di espressione molto più alti rispetto ai ceppi SCHP. Inoltre, il livello di espressione proteica dell’α-emolisina è stato ulteriormente convalidato mediante western blot. È stato riportato che la β-emolisina aumenta prevalentemente la sensibilità dei globuli rossi ad altre tossine invece di lisi direttamente le cellule, a meno che le cellule non siano coltivate a temperature più basse (Vandenesch et al., 2012). In questo studio, l’alta espressione di β-emolisina è stata rilevata nei ceppi SIHP, ma l’anello emolitico completo non è mai stato osservato nei ceppi SIHP anche se incubati a 4 ° C. Questi risultati suggeriscono che il fenotipo incompleto osservato dei ceppi SIHP è molto probabilmente l’effetto di tutte e quattro le emolisine che sono espresse in modo diverso rispetto ai ceppi SCHP. Precedenti studi hanno dimostrato che durante la patogenesi cronica, l’effetto combinato di pressioni selettive derivanti da antibiotici inclusi ciprofloxacina e trimetoprim, nonché la risposta immunitaria dell’ospite, può portare a una maggiore espressione di α-emolisina, che è molto importante per la colonizzazione di S aureus nella mucosa, specialmente nelle infezioni del tratto respiratorio (Goerke et al., 2006; Huseby et al., 2010). In questo studio, tutti i pazienti infetti da SIHP hanno ricevuto un trattamento a lungo termine con antibiotici ad ampio spettro, se questa pressione selettiva ha indotto una sovraespressione di geni resistenti ai farmaci e ha interferito con l’espressione dei geni dell’emolisina rimane una possibilità che necessita di ulteriore
Per esplorare le caratteristiche microbiologiche di SIHP, abbiamo condotto test di suscettibilità antimicrobica e scelto il gene di virulenza tst che è associato alla patogenicità di S. aureus. Abbiamo scoperto che tutti i 60 ceppi SIHP potevano essere classificati come ceppi MRSA e portavano il gene mecA. I risultati dei test di sensibilità agli antimicrobici hanno mostrato che anche dopo 10 passaggi, di questi 60 ceppi SIHP, i valori MIC di linezolid e teicoplanina di soli tre ceppi SIHP sono cambiati poco.Tuttavia, questi cambiamenti dei valori MIC non hanno influenzato la valutazione dei risultati della suscettibilità antimicrobica. Il gene della virulenza tst codifica per la tossina della sindrome da shock tossico (TSST-1) (Kreiswirth, 1989). In quanto super antigene, il TSST-1 potenzia le risposte di shock e immunosoppressione indotte dalle endotossine (Kulhankova et al., 2014). Il test PCR ha rilevato che tutti i 60 ceppi SIHP possedevano il gene tst che suggerisce una maggiore virulenza. Recentemente, molti rapporti hanno dimostrato che S. aureus potrebbe sopravvivere nei macrofagi derivati da monociti umani e questi ceppi di S. aureus sono più virulenti (Kubica et al., 2008; Tranchemontagne et al., 2015; Münzenmayer et al., 2016; Nandi e Bishayi, 2016). Pertanto, abbiamo confrontato le capacità di sopravvivenza intracellulare dei ceppi SIHP e dei ceppi SCHP che è S. aureus tst negativo nei macrofagi e abbiamo scoperto che la capacità di sopravvivenza intracellulare del ceppo SIHP era molto più alta di quella del ceppo di S. aureus tst negativo. Inoltre, l’analisi dei dati dei pazienti ha mostrato che l’effetto della terapia anti-infettiva nella maggior parte dei pazienti infettati con ceppi SIHP era peggiore di quello dei pazienti simili infettati con ceppi SCHP (dati non mostrati). Il nostro studio fornisce prove sperimentali preliminari per l’ipotesi che i ceppi SIHP possiedano una potenziale virulenza elevata.
Durante il processo di infezione di S. aureus invasivo, le molecole associate ai patogeni avviano il sistema immunitario innato che porta all’attivazione e al reclutamento di neutrofili e macrofagi e la produzione di citochine proinfiammatorie, in particolare TNF-α, IL-1β e IL-6 (Bekeredjian-Ding et al., 2015; Giai et al., 2016; Zhao et al., 2016 ). È stato riportato che la secrezione di citochine infiammatorie IL-6 è aumentata con l’aumentare delle concentrazioni di S. aureus (Chen et al., 2016). Inoltre, lo S. aureus superantigenico è particolarmente efficiente nello stimolare la produzione di IL-17 (Islander et al., 2010). In questo studio, i ceppi SIHP hanno mostrato un’induzione significativamente maggiore di IL-2, IL-6 e IL-17A dei macrofagi rispetto ai ceppi SCHP negativi al tst, il che suggerisce che i ceppi SIHP potrebbero indurre una maggiore secrezione di citochine contro l’effetto di uccisione dei macrofagi. Inoltre, l’analisi MLST ha mostrato che tutti i ceppi SIHP sono stati classificati nel clone ST5. Inoltre, questi ceppi SIHP sono stati raggruppati nel tipo spa di t2460 (dati non mostrati).
Nel loro insieme, SIHP potrebbe essere un nuovo sottoinsieme di MRSA con potenziale alta virulenza e dovrebbe essere prestata maggiore attenzione controllo e trattamento di questi ceppi negli ospedali.
Contributi dell’autore
Dichiarazione sui conflitti di interesse
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi o relazioni finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Ringraziamenti
Questo studio è stato sostenuto dalla National Natural Science Foundation of China (81572032, 81401636), Natural Science Foundation for Colleges and Universities in Jiangsu Province (16KJB320006), and the Science and Technology Program of Suzhou (SYSD2014094, SYS201551, SS201638).
Clinica e laboratorio Standards Institute (2014). Standard di prestazione M100-S24 per i test di sensibilità antimicrobica; Ventiquattresimo supplemento informativo. Wayne, PA: CLSI.
Nandi, A. e Bishayi, B. (2016). Gli Staphylococcus aureus sopravvissuti intracellulari dopo la fagocitosi sono più virulenti nell’indurre citotossicità nei macrofagi peritoneali murini freschi che utilizzano TLR-2 come possibile bersaglio. Microb. Pathog. 97, 131–147. doi: 10.1016 / j.micpath.2016.06.007
Estratto di PubMed | Testo completo CrossRef | Google Scholar
Wiseman, G. M. (1975). Le emolisine di Staphylococcus aureus. Batteriolo. Rev. 39, 317–344.
Estratto di PubMed | Google Scholar