Frontiere dell’immunologia
Introduzione
La preeclampsia è una malattia specifica della gravidanza che colpisce il 3-5% di tutte le gravidanze (1, 2). Si manifesta con ipertensione di nuova insorgenza dopo 20 settimane di gestazione e proteinuria. La placenta è centrale nella patogenesi della malattia collegando la madre al feto (3). L’interfaccia materno-fetale è la zona in cui il tessuto geneticamente diverso di origine fetale incontra la circolazione materna, l’endotelio e il sistema immunitario. Spesso chiamata la malattia delle teorie, un’intuizione generalmente accettata è che la preeclampsia colpisce l’endotelio materno causando disturbi nella funzione dell’endotelio, che porta a ipertensione e proteinuria (2). Nella sua forma grave, la preeclampsia può portare a ritardo della crescita fetale, prematurità e per la madre potrebbe causare insufficienza d’organo nei reni e nel fegato, nonché eclampsia. Inoltre, la preeclampsia può avere conseguenze cardiovascolari avverse a lungo termine per la madre e il neonato (4). Lo sviluppo della placenta è considerato inadeguato soprattutto nel processo di trasformazione dell’arteria spirale materna, dove le cellule del trofoblasto invadono il lato materno in decidua e trasformano le arterie in condotti a bassa resistenza, sostituendo anche l’endotelio materno (5-7). Tipicamente, questo rimodellamento delle arterie uterine è assente o incompleto soprattutto nella forma grave di preeclampsia. L’elevata resistenza nelle arterie uterine ristrette provoca un flusso sanguigno turbolento nello spazio intervillare della placenta causando stress ossidativo e danni meccanici agli alberi dei villosi placentari. Il danno risultante aumenta la diffusione placentare di microparticelle e mediatori dell’infiammazione con conseguente attivazione e disfunzione endoteliale generalizzata (8, 9). Questi eventi sequenziali nell’interfaccia materno-fetale portano a ipertensione materna e altri sintomi come descritto sopra.
La sindrome HELLP è stata caratterizzata per la prima volta nel 1982 da Weinstein come una sindrome separata, spesso rappresentativa insieme alla preeclampsia ma vista anche da sola (10, 11). La sindrome HELLP è caratterizzata da emolisi, enzimi epatici elevati e piastrine basse. Spesso richiede l’osservazione del livello di terapia intensiva e la terapia sintomatica. La patogenesi della sindrome è ancora nell’ombra. La sindrome HELLP condivide caratteristiche comuni con le microangiopatie trombotiche (TMA) come la porpora trombotica trombocitopenica (TTP) e la sindrome emolitica uremica (SEU). Le MT sono presenti in diversi gruppi di malattie con caratteristiche comuni di emolisi microangiopatica, trombocitopenia e danno d’organo derivante da microtrombi. In TTP, un difetto genetico di, o come nella stragrande maggioranza dei casi, autoanticorpi acquisiti contro una disintegrina e metalloproteinasi con motivo trombospondina tipo 1 13 (ADAMTS13), l’enzima che scinde il fattore di von Willebrand attivato (vWF), causa la formazione di multimeri vWF attivati sulle cellule endoteliali che portano a trombi piastrinici in piccoli vasi ed emolisi. La SEU tipica è causata dall’infezione batterica che produce la tossina Shiga (specialmente Escherichia coli) mentre la SEU atipica (SEUa) si riferisce al tipo di TMA, in cui sono alla base le carenze genetiche nei regolatori della via alternativa del sistema del complemento, che, in presenza di un trigger può causare la malattia clinica (12, 13). Il trattamento approvato dalla FDA per la SEUa è l’infusione dell’antagonista C5 del complemento eculizumab, che previene la formazione del complesso di attacco della membrana (MAC) (Figura 1). Clinicamente HELLP condivide gli stessi sintomi delle TMA classiche: emolisi, trombocitopenia e disturbi d’organo osservati nel fegato. A seconda della classificazione TMA utilizzata, la sindrome HELLP viene solitamente classificata come parte di TMA secondarie o acquisite (Tabella 1).
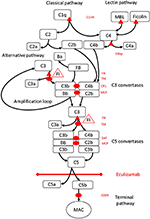
Figura 1. Eculizumab inibisce la via terminale dell’attivazione del complemento. L’attivazione del complemento può essere avviata attraverso tre percorsi di attivazione, che portano tutti alla formazione di convertasi C5 che hanno la capacità di attivare la via terminale che porta alla formazione del MAC sulla superficie bersaglio. Questa illustrazione schematica del sistema del complemento mostra i suoi attivatori più rilevanti (in caratteri neri) e inibitori (in rosso). Gli attivatori possono essere legati alla membrana (ovali) o solubili (triangolo). Il percorso alternativo si attiva spontaneamente su tutte le superfici che non consentono l’inibizione da parte del fattore regolatore solubile H (FH). FH funge da cofattore per l’inattivazione di C3b in iC3b dal fattore I (FI). La trombomodulina (TM) migliora l’attività del cofattore FH. Il fattore B scisso (FB) insieme all’attivatore C3b forma la via alternativa convertasi, che ha la capacità di scindere C3 in C3b creando un loop di amplificazione dell’attivazione della via alternativa.La via classica dell’attivazione del complemento può essere avviata, ad esempio, dal legame di immunocomplessi a C1q, mentre la via della lectina è attivata dalle mannosi che legano la lectina (MBL) o le ficoline che si legano, ad esempio, ai modelli di carboidrati sui microbi. L’attivazione della via della lectina si traduce in serina proteasi 1 e 2 associate al mannosio (MASP-1 e MASP-2, non raffigurate) che scindono i componenti del complemento C4 e C2 per formare la classica via convertasi C4bC2b. L’inibitore C1 (C1inh) e C4bp sono i regolatori solubili della via classica, mentre la proteina cofattore di membrana (MCP) e il recettore del complemento 1 (CR1) sono regolatori legati alla membrana delle prime vie del complemento. La formazione di convertasi C5 avvia il percorso terminale di attivazione del complemento e scissione di C5 in assenza di fattori di accelerazione del decadimento dei regolatori legati alla superficie (DAF) e MCP. L’assemblaggio del MAC è regolato dal regolatore CD59 (protezione). La scissione di C3 nelle prime vie e C5 nella via terminale rilascia anafilatossine C3a e C5a e provoca infiammazione. Eculizumab è un anticorpo ricombinante umanizzato contro la proteina del complemento C5, che inibisce la scissione di C5 da parte delle convertasi C5 regolando in tal modo gli effetti protrombotici e proinfiammatori dell’attivazione del complemento. Il paziente descritto in questo caso clinico è stato testato per mutazioni genetiche nei geni che codificano per Fattore H (CFH), FHR5 e MCP, CFI, CFB, THBD e ADAMTS13 (ADAMTS13), un regolatore del percorso vWF della cascata della coagulazione (non mostrato). I risultati del test genetico sono stati negativi.

Tabella 1. Criteri diagnostici HELLP e aHUS.
In questo caso di studio, riportiamo un paziente con una complicata TMA indotta dalla gravidanza e il trattamento con successo.
Presentazione del caso
Primigravida di 29 anni è stata inviata all’età gestazionale di 34 + 2 anni all’ospedale dell’Università di Helsinki ambulatorio con mal di stomaco superiore. Inizialmente, la sua pressione sanguigna era moderatamente elevata (133/91 mmHg) e l’astina urinaria positiva per le proteine. Il dolore alla parte superiore dello stomaco inizialmente segnalato stava gradualmente migliorando. Nell’ecografia il feto aveva un profilo biofisico normale (BPP), la stima del peso era alla curva di crescita di −2 DS. La cardiotocografia (CTG) era normale. L’emoglobina ematica (Hb) era 115 g / L, le piastrine 158 E9 / L (intervallo normale 150-360 E9 / L), l’alanina aminotransferasi (ALT) era normale (23 U / L). L’astina urinaria era positiva per le proteine (+2) e la proteinuria calcolata era di 1,6 g / 24 h. È stata presa la decisione di iniziare il trattamento con cortisone per facilitare la maturazione polmonare del bambino. Il paziente è stato dimesso con l’intenzione di rientrare il giorno successivo per il controllo di controllo e la seconda dose di cortisone. Come programmato, è venuta per il controllo alla settimana gestazionale 34 + 4. La pressione sanguigna era 147/87 mmHg, ALT 23, piastrine 177, CTG e il BPP del feto nell’ecografia era normale. È stata dimessa ed è stato programmato un altro controllo. Nel pomeriggio dello stesso giorno, il dolore alla parte superiore dello stomaco è tornato e si è progressivamente peggiorato verso la sera. È tornata in ospedale alle 2.20 del mattino.Ha avvertito dolore alla parte superiore dello stomaco, irrequietezza, aveva vomitato due volte e aveva tremore. La pressione sanguigna era chiaramente elevata a 170/94 mmHg, il dipstick proteico urinario era fortemente positivo, l’ALT era elevata a 159, Hb 122 e le piastrine 172. Fu ricoverata nel reparto prenatale. Alle 4 del mattino soffriva di mal di testa. È stato avviato un trattamento antipertensivo (Labetalol 100 mg tre volte). L’escrezione di proteine urinarie ha raggiunto il picco nella notte di 13 g / 24 h. Successivamente, ha iniziato a vomitare, ha avuto dolore alla parte superiore dello stomaco, mal di testa e il monitoraggio CTG ha mostrato decelerazioni. Il paziente è stato trasferito alle 7.11 al reparto parto e poiché la cervice era dilatata di tre centimetri, le membrane fetali sono state rotte artificialmente per l’induzione del travaglio. Allo stesso tempo i test di laboratorio sono stati completati con Hb 122, piastrine 172. La lattato deidrogenasi (LD), tuttavia, era chiaramente elevata a 1231 U / L in questo momento. Nel CTG, le decelerazioni sono continuate e con il proseguimento della bradicardia è stato eseguito un taglio cesareo di emergenza. Un neonato maschio (1960 g, −2 DS) è nato alle 7,25 del mattino con un pH dell’arteria ombelicale di 7,05, BE -6,80, Apgar 1/6/8. La perdita di sangue durante l’operazione era di 400 ml.
Alle 9 del mattino dopo il taglio cesareo le piastrine della madre erano basse a 49, con Hb di 102. Nel pomeriggio l’ALT era salito a 1800, LD 3570 , il livello di creatinina sierica era 153 (μmol / L), mentre le piastrine sono scese a 33. Sono stati riscontrati disturbi nella coagulazione indicati da bassi livelli di fibrinogeno (1,1 g / L, valori di riferimento 2-4 g / L) e alti livelli di D -dimer della fibrina (30,2 mg / L, < 0,5 mg / L) Si è verificato un certo sanguinamento dalla ferita del taglio cesareo, in cui sono state posizionate ulteriori suture.A questo punto sono state somministrate otto unità di piastrine. Il livello di potassio è passato da 4,7 a 5,6 (mmol / L). L’emolisi è stata chiaramente osservata. Il test di Coombs è risultato negativo. L’escrezione urinaria era di soli 10 ml / h. Il test di laboratorio ha mostrato chiaramente una malattia grave con segni di danni sia ai reni che al fegato. Inoltre, c’era un disturbo nel sistema di coagulazione che presentava simultaneamente una significativa coagulazione e una marcata fibrinolisi. L’infusione di solfato di magnesio è stata iniziata a causa dell’iperreflessia, che è considerata un segno predittivo di convulsioni, una grave complicanza della preeclampsia. È stato avviato il desametasone per via endovenosa 10 mg e il paziente è stato trasferito in unità di terapia intensiva (ICU).
Inoltre, sono stati emessi test di laboratorio per scopi diagnostici differenziali di altre emergenze mediche (Tabella 2). L’attività di ADAMTS13 era normale del 62% (40-130%), il che esclude il TTP. I livelli sierici di C3 del complemento (0,52 g / L, 0,71–1,41 g / L) e C4 (0,07 g / L, 0,12–0,34 g / L) erano bassi. Il livello del complesso terminale solubile del complemento (C5b-9, 971 ng / mL, < 366 ng / mL) era elevato il primo giorno dopo il parto. Gli anticorpi antifosfolipidi non sono stati rilevati, la sierologia dell’infezione relativa all’epatite B e C e l’HIV era negativa. Dal campione di feci, i patogeni che causano la SEU tipica sono risultati negativi.

Tabella 2. Sequenza temporale della diagnostica e del trattamento della malattia.
Il paziente è stato trattato con plasmaferesi il primo e il secondo giorno dopo il parto ed è stata emodializzata complessivamente tre volte nel corso del trattamento (giorni 2, 4 e 6 dopo il parto).
Il terzo giorno dopo il parto la paziente era stabile e trasferita di nuovo alla sala di risveglio del Women “s Hospital sono stati osservati e la terapia sintomatica è stata continuata. L’ipertensione è stata trattata con Amlodipina 10 mg due volte al giorno e Labetalol 200 mg tre volte al giorno. Il quarto giorno dopo il parto, le piastrine hanno continuato a diminuire e al paziente è stata diagnosticata la SEUa. Spesso la diagnosi differenziale con sindrome HELLP e aHUS risiede nel recupero spontaneo dei pazienti HELLP di solito il terzo giorno dopo il parto. È stato iniziato il trattamento con eculizumab (900 mg EV). ent ha ricevuto una vaccinazione pneumococcica ed è stata avviata la profilassi antibiotica (penicillina). La paziente ha ricevuto complessivamente quattro dosi settimanali di eculizumab (900 mg) e ha iniziato a riprendersi rapidamente. Non ha richiesto ulteriore emodialisi dopo la sua terza emodialisi il sesto giorno dopo il parto (Figura 2). La funzionalità renale è stata corretta gradualmente, la conta piastrinica è aumentata e l’emolisi si è risolta. Quattro settimane dopo il parto i livelli plasmatici di C3 e C4 sono stati normalizzati.
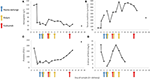
Figura 2. Valori di laboratorio selezionati osservati durante le prime fasi della malattia e tempi di scambio plasmatico, emodialisi e somministrazione di eculizumab. Nel pannello (A) è rappresentato lo sviluppo delle misurazioni dell’emoglobina nel sangue, nel pannello (B) il livello di creatinina sierica, nel pannello (C) il numero di piastrine e nel pannello (D) D-dimero dei valori di fibrina nell’arco di 17 giorni periodo di follow-up.
Nei test genetici non sono stati identificati polimorfismi genetici noti. È stata testata per mutazioni nei regolatori del complemento Fattore H (CFH), proteina 5 correlata al fattore H (FHR5) e proteina cofattore di membrana (MCP), fattore I (CFI) inattivatore della via alternativa del complemento, fattore B attivatore della via alternativa (CFB) ) e i seguenti componenti della cascata della coagulazione: ADAMTS13, trombomodulina (THBD) e un enzima intracellulare, diacilglicerolo chinasi E (DGKE), le cui mutazioni sono una causa nota di SEUa (14). Inoltre, non sono stati rilevati nemmeno gli anticorpi contro il fattore H. Non è stata rilevata alcuna carenza di C4.
In sintesi, il nostro paziente aveva una grave preeclampsia e soddisfaceva i criteri diagnostici per la sindrome HELLP. Sebbene i test genetici per la SEUa rimanessero negativi, il decorso clinico della malattia (in particolare, grave danno renale acuto) e la risposta al trattamento (in particolare, eculizumab) suggerivano che la nostra paziente avesse la SEUa indotta dalla gravidanza.
Discussione
Alla primigravida sopra descritta è stata diagnosticata una grave preeclampsia, sindrome HELLP e SEUa indotta dalla gravidanza. Non sono state scoperte mutazioni geniche conosciute, che potrebbero predisporre a SEUa. La diagnosi differenziale tra i tipi di TMA, TTP, SEU / SEU e MTA secondarie come la sindrome HELLP è importante. Soprattutto la PTT deve essere identificata precocemente, poiché la malattia viene trattata con un rapido scambio plasmatico quotidiano fino alla remissione (15).
Attualmente, i metodi di analisi di laboratorio per testare le mutazioni genetiche che potenzialmente causano la SEUa sono in grado di mostrare mutazioni nella SEUa solo fino al 40-60% dei casi di SEUa, lasciando la possibilità di falsi negativi. Pertanto, un risultato negativo del test per le mutazioni non esclude una vera SEUa (16).Raramente la SEUa è stata indotta dopo la gravidanza e il parto. In questi casi, durante i tre anni successivi, circa il 50% ha sviluppato una malattia renale cronica (CKD), alcune anche malattie renali allo stadio terminale (ESKD). Quando sono state osservate mutazioni genetiche, fino all’85% può sviluppare CKD o ESKD (17).
È generalmente accettato che nei disturbi ipertensivi della gravidanza, l’infiammazione placentare si traduca in una disfunzione endoteliale. Se l’integrità dell’endotelio è disturbata, ciò determina l’attivazione del complemento e della coagulazione (18). È stato anche ipotizzato che l’endotelio materno interrotto contribuisca alla morbilità materna nella vita successiva associata a grave preeclampsia e ad altri disturbi ipertensivi della gravidanza (2, 19). È stato dimostrato che l’endotelio danneggiato funziona in modo anomalo anche anni dopo la scomparsa dei sintomi diagnostici iniziali (20-23).
Fino al 46% dei pazienti HELLP, le mutazioni geniche sono state descritte nei regolatori del percorso alternativo del sistema del complemento (24, 25). Nelle prime fasi della gravidanza, quando la placenta si sta sviluppando, l’attivazione del sistema del complemento è vista in livelli elevati di Bb nel siero in pazienti che successivamente hanno sviluppato preeclampsia (26). L’attivazione del sistema del complemento è stata osservata nella preeclampsia grave e nella sindrome HELLP e sono stati rilevati livelli elevati di complesso terminale (C5b-9) nelle urine di pazienti con preeclampsia grave. Nei pazienti con sindrome HELLP, è stata dimostrata una maggiore attivazione del sistema del complemento dai test funzionali e, inoltre, da deficienze di espressione in CD55 e CD59, che hanno portato a una diminuzione della regolazione e ad una esacerbata attivazione del sistema del complemento (27-29).
Ci sono molte somiglianze condivise tra la sindrome HELLP e la SEUa. In entrambe le condizioni, il disturbo dell’endotelio è chiaramente coinvolto, seguito dall’attivazione del complemento e della coagulazione. Nella preeclampsia grave e nella sindrome HELLP, eculizumab somministrato ai primi segni di malattia grave e TMA sarebbe utile per la protezione dei reni e dell’endotelio materno (30). Preservare l’integrità endoteliale può potenzialmente proteggere il paziente da rischi per la salute a lungo termine come le malattie cardiovascolari. In genere, nelle TMA correlate alla gravidanza, i segni clinici di emolisi e trombocitopenia si risolvono in ~ 3 giorni. Se l’attività della malattia dura più a lungo, la diagnostica differenziale deve essere continuata e solo allora viene preso in considerazione un trattamento alternativo (ad es. Eculizumab). L’introduzione anticipata del trattamento con eculizumab gioverebbe alle donne prevenendo il danno renale e riducendo al minimo la turbolenza nell’endotelio e l’infiammazione sistemica. Eculizumab, somministrato abbastanza presto e anche solo una o due dosi, potrebbe essere sufficiente per fermare la turbolenza ed essere sufficiente per fermare la cascata di eventi (31). Da un lato, eculizumab è un farmaco molto costoso, ma dall’altro il costo del trattamento di terapia intensiva, scambio di plasma, emodialisi, possibile trapianto di rene, per non parlare delle conseguenze emotive per le madri e le famiglie rimangono inestimabili.
In conclusione, il nostro paziente era gravemente malato, presentava emolisi, disturbi della coagulazione, danni al fegato e insufficienza renale che necessitavano di ricovero in terapia intensiva ed emodialisi. È possibile che eculizumab, se iniziato prima, ai primi segni della sindrome HELLP, possa essere stato utile durante il decorso successivo della malattia, potenzialmente mitigando il danno renale e prevenendo così la necessità di emodialisi e successiva CKD. Pertanto, in questa era della moderna medicina immunologica, potremmo fare di più per le madri e le famiglie oltre ad aspettare e sperare per il meglio?
Dichiarazione etica
La revisione etica e l’approvazione non lo erano richiesto per lo studio sui partecipanti umani in conformità con la legislazione locale e i requisiti istituzionali. I pazienti / partecipanti hanno fornito il loro consenso informato scritto per partecipare a questo studio.
Contributi dell’autore
AL e JH-E hanno sviluppato l’idea del manoscritto e hanno scritto il manoscritto. JH-E e MH sono stati coinvolti nella cura diagnostica e terapeutica del paziente. Tutti gli autori hanno esaminato e modificato il manoscritto e approvato la sua versione finale per la pubblicazione.
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbe essere interpretato come un potenziale conflitto di interessi.
4. Hauspurg A, Ying W, Hubel CA, Michos ED, Ouyang P. Esiti avversi della gravidanza e future malattie cardiovascolari materne. Clin Cardiol. (2018) 41: 239–46. doi: 10.1002 / clc.22887
Estratto di PubMed | Testo completo di CrossRef | Google Scholar
5. Brosens I, Pijnenborg R, Vercruysse L, Romero R. The ” great Obstetical Syndromes “sono associate a disturbi della placenta profonda. Am J Obstet Gynecol. (2011) 204: 193–201. doi: 10.1016 / j.ajog.2010.08.009
Estratto di PubMed | Testo completo di CrossRef | Google Scholar
8. Germain SJ, Sacks GP, Soorana SR, Sargent IL, Redman CW . Priming infiammatorio sistemico in gravidanza normale e preeclampsia: il ruolo delle microparticelle di sinciziotrofoblasto circolanti. J Immunol. (2007) 178: 5949–56. doi: 10.4049 / jimmunol.178.9.5949
Estratto di PubMed | Testo completo di CrossRef | Google Scholar
9. Tannetta D, Masliukaite I, Vatish M, Redman C, Sargent I Aggiornamento di vescicole extracellulari derivate da sinciziotrofoblasti in gravidanza normale e preeclampsia. J Reprod Immunol. (2017) 119: 98-106. doi: 10.1016 / j.jri.2016.08.008
Abstract su PubMed | Testo completo di CrossRef | Google Scholar
10. Sindrome di Weinstein L. dell’emolisi, aumento degli enzimi epatici e basso numero di piastrine contare: una grave conseguenza dell’ipertensione in gravidanza. Sono J Obstet Gynecol. (1982) 142: 159–67. doi: 10.1016 / S0002-9378 (16) 32330-4
Estratto di PubMed | Testo completo di CrossRef | Google Scholar
15. Pourrat O, Coudroy R, Pierre F. Differenziazione tra sindrome HELLP grave e microangiopatia trombotica, porpora trombotica trombocitopenica e altri imitatori. Eur J Obstet Gynecol Reprod Biol. (2015) 189: 68-72. doi: 10.1016 / j.ejogrb.2015.03.017
Abstract su PubMed | Testo completo di CrossRef | Google Scholar
20. Agatisa PK, Ness RB, Roberts JM, Costantino JP, Kuller LH , McLaughlin MK. Compromissione della funzione endoteliale nelle donne con una storia di preeclampsia: un indicatore del rischio cardiovascolare. Am J Physiol Ascolta Circ Physiol. (2004) 286: 1–3. doi: 10.1152 / ajpheart.00298.2003
Estratto di PubMed | Testo completo di CrossRef | Google Scholar
22. Kvehaugen AS, Dechend R, Ramstad HB, Troisi R, Fugelseth D , Staff AC. La funzione endoteliale e i biomarcatori circolanti sono disturbati nelle donne e nei bambini dopo la preeclampsia. Ipertensione. (2011) 58: 63–9. doi: 10.1161 / HYPERTENSIONAHA.111.172387
Estratto di PubMed | Testo completo di CrossRef | Google Scholar
23. Stanhewicz AE. Disfunzione vascolare residua nelle donne con una storia di preeclampsia. Sono J Physiol Regul Integr Comp Physiol. (2018) 315: R1062 – R71. doi: 10.1152 / ajpregu.00204.2018
Estratto di PubMed | Testo completo di CrossRef | Google Scholar
25. Vaught AJ, Braunstein EM, Jasem J, Yuan X, Makhlin I , Eloundou S, et al. Mutazioni germinali nella via alternativa del complemento predispongono alla sindrome HELLP. JCI insight. (2018) 3: 0-13. doi: 10.1172 / jci.insight.99128
Abstract su PubMed | Testo completo di CrossRef | Google Scholar
31. Elabd H, Elkholi M, Steinberg L, Acharya A. Eculizumab, un nuovo potenziale trattamento per il danno renale acuto associato alla sindrome preeclampsia / HELLP. BMJ Case Rep. (2019) 12: e228709. doi: 10.1136 / bcr-2018-228709
Estratto di PubMed | Testo completo di CrossRef | Google Scholar