Geologia fisica (Italiano)
La stragrande maggioranza dei minerali che compongono le rocce della crosta terrestre sono minerali silicati. Questi includono minerali come quarzo, feldspato, mica, anfibolo, pirosseno, olivina e una grande varietà di minerali argillosi. L’elemento costitutivo di tutti questi minerali è il tetraedro di silice, una combinazione di quattro atomi di ossigeno e un atomo di silicio. Questi sono disposti in modo tale che i piani disegnati attraverso gli atomi di ossigeno formino un tetraedro (Figura 2.6). Poiché lo ione di silicio ha una carica di +4 e ciascuno dei quattro ioni di ossigeno ha una carica di -2, il tetraedro di silice ha una carica netta di -4.
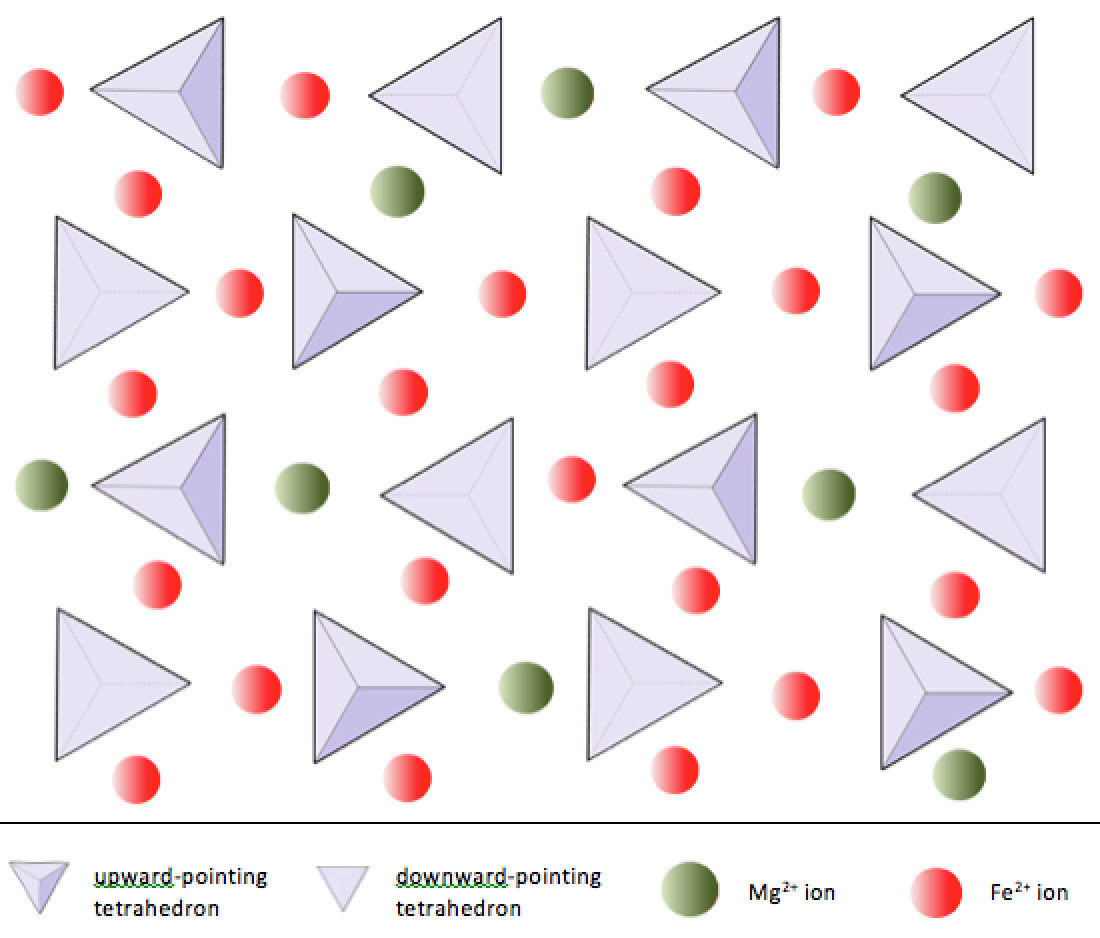
Nei minerali di silicato, questi tetraedri sono disposti e collegati tra loro in vari modi, da singole unità a framework complessi (Figura 2.9). La struttura più semplice del silicato, quella del minerale olivina, è composta da tetraedri isolati legati a ioni di ferro e / o magnesio. Nell’olivina, la carica –4 di ciascun tetraedro di silice è bilanciata da due cationi bivalenti (cioè +2) di ferro o magnesio. L’olivina può essere Mg2SiO4 o Fe2SiO4 o una combinazione dei due (Mg, Fe) 2SiO4. I cationi bivalenti di magnesio e ferro hanno un raggio abbastanza vicino (0,73 contro 0,62 angstrom). A causa di questa somiglianza dimensionale e poiché sono entrambi cationi bivalenti (entrambi hanno una carica di +2), il ferro e il magnesio possono facilmente sostituirsi l’uno con l’altro nell’olivina e in molti altri minerali.
| Configurazione del tetraedro | Minerali di esempio | |
|---|---|---|
 |
Isolato (nesosilicati) | Olivina, granato, zircone, cianite |
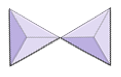 |
Coppie (sorosilicati) | Epidote, zoisite |
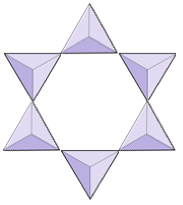 |
Anelli (ciclosilicati) | Tormalina |
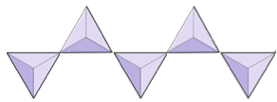 |
Catene singole (inosilicati) | Pirosseni, wollastonite |
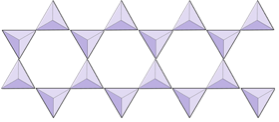 |
Doppie catene (inosilicati) | Anfiboli |
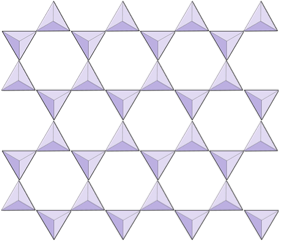 |
Fogli (fillosilicati) | Micas, minerali argillosi, serpentine, clorite |
| 3-dimensionale struttura | Framework (tettosilicati) | Feldspati, quarzo, zeolite |
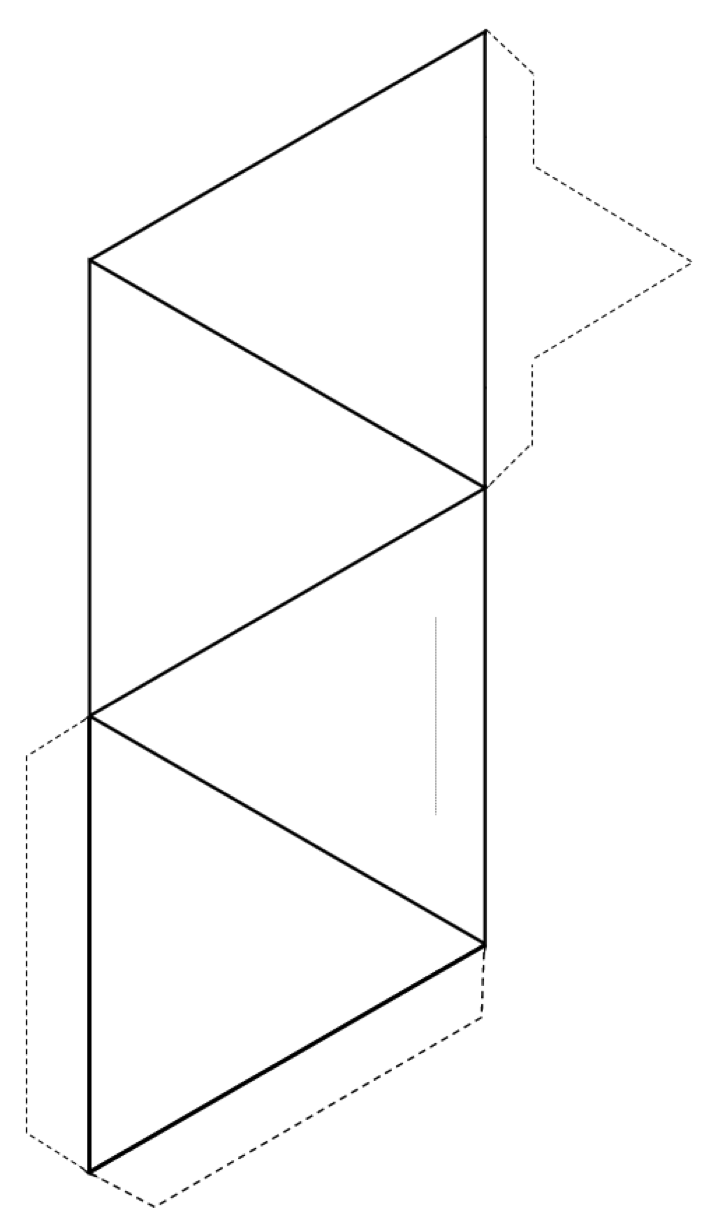
Esercizio 2.3 Crea un tetraedro
Taglia intorno alla parte esterna della forma (linee continue e linee tratteggiate), quindi piega lungo le linee continue per formare un tetraedro.
Se hai della colla o del nastro, fissa il linguette al tetraedro per tenerlo insieme. Se non hai colla o nastro adesivo, fai una fetta lungo la sottile linea grigia e inserisci la linguetta appuntita nella fessura.
Se lo fai in una classe, prova a unire il tuo tetraedro con gli altri coppie, anelli, catene singole e doppie, fogli e persino strutture tridimensionali.
Nell’olivina, a differenza della maggior parte degli altri minerali di silicato, i tetraedri di silice non sono legati a ciascuno altro. Tuttavia, sono legati al ferro e / o al magnesio come mostrato nella Figura 2.10.
Come già notato, gli ioni +2 di ferro e magnesio sono di dimensioni simili (sebbene non esattamente uguali). Ciò consente loro di sostituirsi a vicenda in alcuni minerali di silicato. In effetti, gli ioni comuni nei minerali silicati hanno una vasta gamma di dimensioni, come mostrato nella Figura 2.11. Tutti gli ioni mostrati sono cationi, ad eccezione dell’ossigeno. Nota che il ferro può esistere sia come ione +2 (se perde due elettroni durante la ionizzazione) sia come ione +3 (se perde tre). Fe2 + è noto come ferro ferroso. Fe3 + è noto come ferro ferrico. I raggi ionici sono fondamentali per la composizione dei minerali di silicato, quindi faremo nuovamente riferimento a questo diagramma.

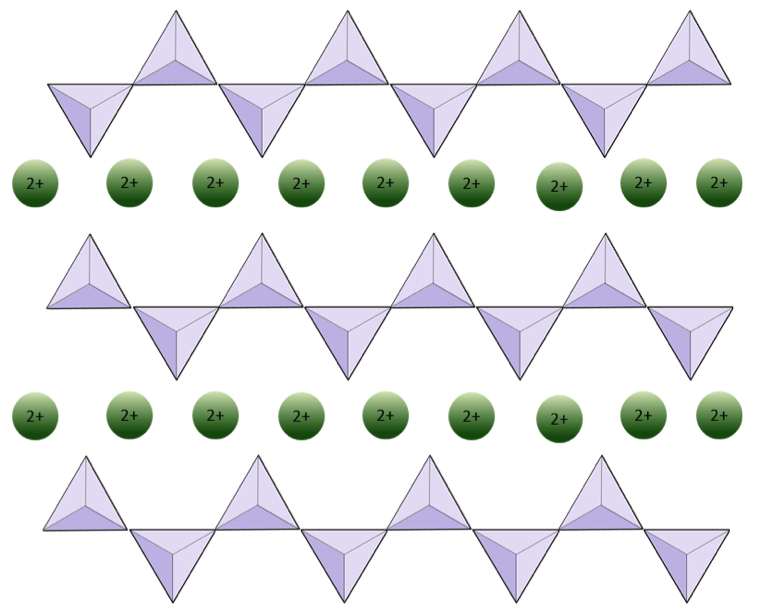
La struttura della catena singola il pirosseno di silicato è mostrato nelle Figure 2.12 e 2.13. Nel pirosseno, i tetraedri di silice sono collegati insieme in una singola catena, dove uno ione ossigeno da ciascun tetraedro è condiviso con il tetraedro adiacente, quindi ci sono meno ossigeni nella struttura.Il risultato è che il rapporto ossigeno / silicio è inferiore a quello dell’olivina (3: 1 invece di 4: 1) e la carica netta per atomo di silicio è inferiore (–2 invece di –4), poiché sono necessari meno cationi per bilanciare quella carica. Le composizioni di pirosseno sono del tipo MgSiO3, FeSiO3 e CaSiO3, o una combinazione di questi. Il pirosseno può anche essere scritto come (Mg, Fe, Ca) SiO3, dove gli elementi tra parentesi possono essere presenti in qualsiasi proporzione. In altre parole, il pirosseno ha un catione per ogni tetraedro di silice (ad esempio, MgSiO3) mentre l’olivina ha due (ad esempio, Mg2SiO4). Poiché ogni ione di silicio è +4 e ogni ione di ossigeno è –2, i tre ossigeni (–6) e l’unico silicio (+4) danno una carica netta di –2 per la singola catena di tetraedri di silice. Nel pirosseno, l’unico catione bivalente (2+) per tetraedro bilancia quella carica –2. Nell’olivina, sono necessari due cationi bivalenti per bilanciare la carica -4 di un tetraedro isolato.
La struttura del pirosseno è più “permissiva” di quella dell’olivina, il che significa che i cationi con una gamma più ampia di raggi ionici possono entrare. Ecco perché i pirosseni possono avere cationi ferro (raggio 0,63 Å) o magnesio (raggio 0,72 Å) o calcio (raggio 1,00 Å).
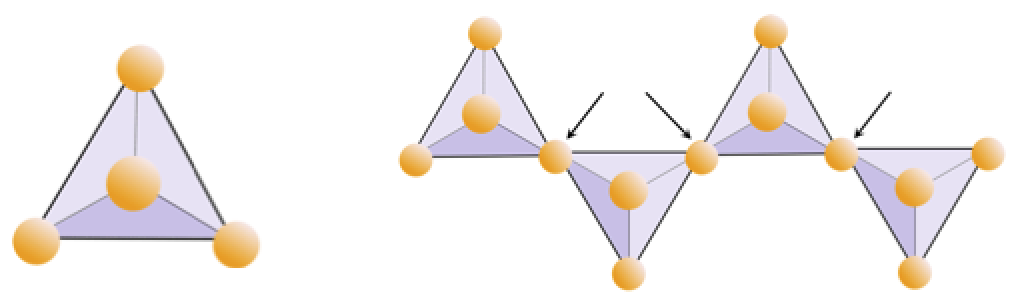
Esercizio 2.4 Deprivazione dell’ossigeno
Il diagramma seguente rappresenta una singola catena in un minerale silicato. Contare il numero di tetraedri rispetto al numero di ioni di ossigeno (sfere gialle). Ogni tetraedro ha uno ione di silicio, quindi questo dovrebbe fornire il rapporto tra Si e O nei silicati a catena singola (ad esempio, pirosseno).
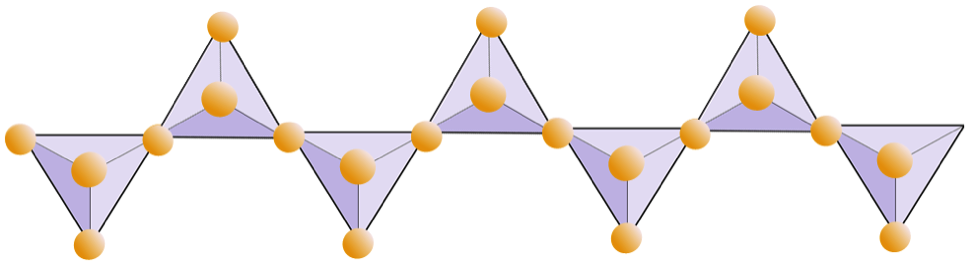
Il diagramma seguente rappresenta una doppia catena in un minerale silicato. Di nuovo, conta il numero di tetraedri rispetto al numero di ioni di ossigeno. Questo dovrebbe darti il rapporto tra Si e O nei silicati a doppia catena (ad esempio, anfibolo).
Nelle strutture degli anfiboli, i tetraedri di silice sono legati in una doppia catena che ha un rapporto ossigeno-silicio inferiore a quello del pirosseno, e quindi sono necessari ancora meno cationi per bilanciare la carica. L’anfibolo è ancora più permissivo del pirosseno e le sue composizioni possono essere molto complesse. L’orneblenda, ad esempio, può includere sodio, potassio, calcio, magnesio, ferro, alluminio, silicio, ossigeno, fluoro e lo ione idrossile (OH–).
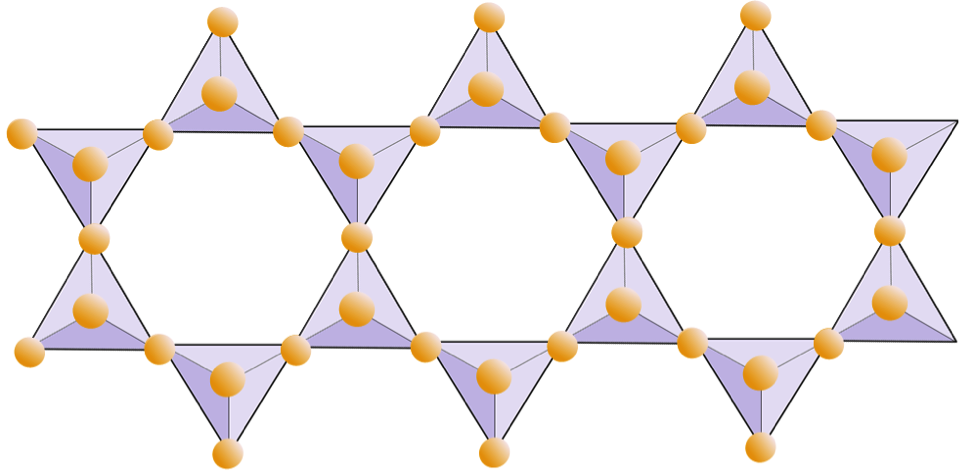
Nelle strutture di mica, il i tetraedri di silice sono disposti in fogli continui, dove ogni tetraedro condivide tre anioni di ossigeno con i tetraedri adiacenti. C’è ancora più condivisione di ossigeni tra tetraedri adiacenti e quindi sono necessari meno cationi di bilanciamento della carica per i minerali di silicato in fogli. Il legame tra i fogli è relativamente debole e questo spiega la scissione unidirezionale ben sviluppata (Figura 2.14). La mica biotite può contenere ferro e / o magnesio e questo la rende un minerale silicato ferromagnesiano (come olivina, pirosseno e anfibolo). Il clorito è un altro minerale simile che comunemente include il magnesio. Nella mica muscovite gli unici cationi presenti sono l’alluminio e il potassio; quindi è un minerale di silicato non ferromagnesiano.

Oltre a muscovite, biotite e clorite, ci sono molti altri silicati in fogli (o fillosilicati), che di solito esistono come frammenti delle dimensioni di argilla (cioè, meno di 0,004 mm). Questi includono i minerali argillosi caolinite, illite e smectite e, sebbene siano difficili da studiare a causa delle loro dimensioni molto ridotte, sono componenti estremamente importanti delle rocce e soprattutto dei terreni.
Tutto il silicato del foglio i minerali hanno anche l’acqua nella loro struttura.
I tetraedri di silice sono legati in strutture tridimensionali sia nei feldspati che nel quarzo. Questi sono minerali non ferromagnesiani: non contengono ferro o magnesio.Oltre ai tetraedri di silice, i feldspati includono i cationi alluminio, potassio, sodio e calcio in varie combinazioni. Il quarzo contiene solo tetraedri di silice.
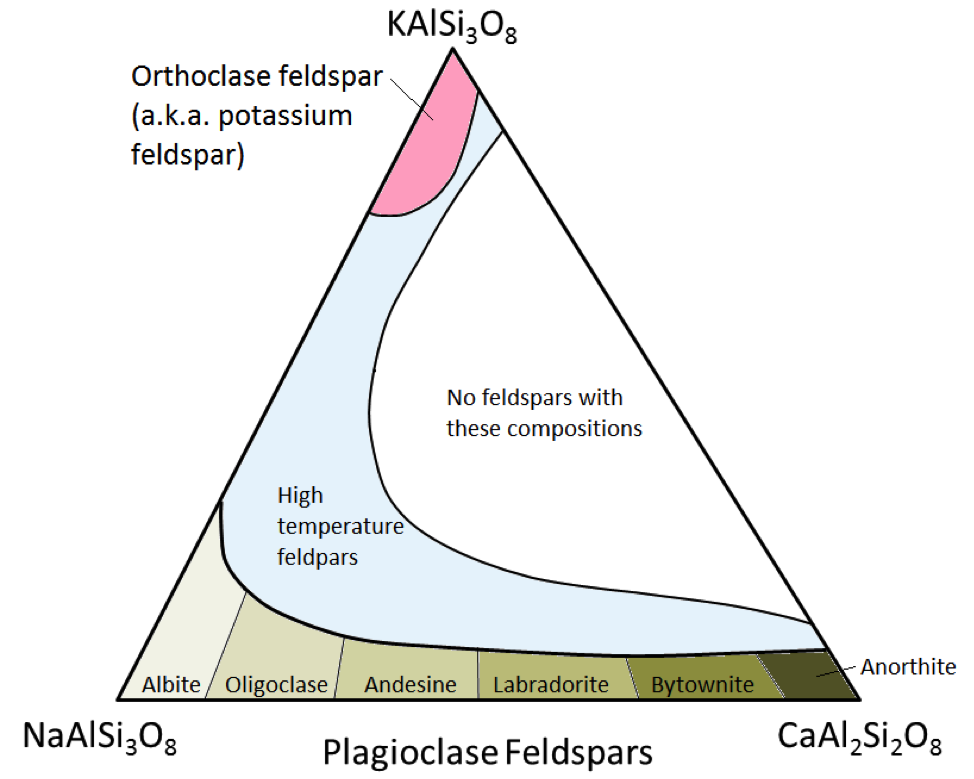
I tre minerali feldspatici principali sono il feldspato di potassio (noto anche come K-feldspato o K-spar) e due tipi di plagioclasio feldspato: albite (solo sodio) e anortite (solo calcio) . Come nel caso del ferro e del magnesio nell’olivina, esiste una gamma continua di composizioni (serie di soluzioni solide) tra albite e anortite in plagioclasio. Questo perché gli ioni calcio e sodio hanno dimensioni quasi identiche (1,00 Å contro 0,99 Å). Può esistere qualsiasi composizione intermedia tra CaAl2Si3O8 e NaAlSi3O8 (Figura 2.15). Questo è un po ‘sorprendente perché, sebbene siano di dimensioni molto simili, gli ioni calcio e sodio non hanno la stessa carica (Ca2 + contro Na +). Questo problema è spiegato dalla corrispondente sostituzione di Al3 + per Si4 +. Pertanto, l’albite è NaAlSi3O8 (un Al e tre Si) mentre l’anortite è CaAl2Si2O8 (due Al e due Si), ei feldspati di plagioclasio di composizione intermedia hanno proporzioni intermedie di Al e Si. Questa è chiamata “sostituzione accoppiata”.
I feldspati di plagioclasio a composizione intermedia sono oligoclasi (dal 10% al 30% di Ca), andesina (dal 30% al 50% di Ca), labradorite (dal 50% al 70 % Ca), e bytownite (dal 70% al 90% Ca). K-feldspato (KAlSi3O8) ha una struttura leggermente diversa da quella del plagioclasio, a causa della maggiore dimensione dello ione potassio (1,37 Å) e per questa grande dimensione , il potassio e il sodio non si sostituiscono facilmente, tranne che ad alte temperature. Questi feldspati ad alta temperatura si trovano probabilmente solo nelle rocce vulcaniche perché le rocce ignee intrusive si raffreddano abbastanza lentamente fino a basse temperature affinché i feldspati si trasformino in uno dei forme a temperatura più bassa.
Nel quarzo (SiO2), i tetraedri di silice sono legati in una struttura tridimensionale “perfetta”. Ogni tetraedro è legato ad altri quattro tetraedri (con un ossigeno condiviso ad ogni angolo di ciascun tetraedro) e, di conseguenza, il rapporto tra silicio e ossigeno è 1: 2. Poiché il catione di silicio ha una carica +4 e i due anioni dell’ossigeno hanno ciascuno una carica –2, la carica è bilanciata. Non è necessario l’alluminio o altri cationi come il sodio o il potassio. La durezza e la mancanza di scissione nel quarzo derivano dai forti legami covalenti / ionici caratteristici del tetraedro di silice.
Esercizio 2.5 Silicati ferromagnesiani?
I minerali silicati sono classificati come ferromagnesiani o non ferromagnesiani a seconda che abbiano o meno ferro (Fe) e / o magnesio (Mg) nella loro formula. Di seguito sono elencati numerosi minerali e le loro formule. Per ciascuno, indica se si tratta di un silicato ferromagnesiano.
| Minerale | Formula | Silicato ferromagnesiano? |
|---|---|---|
| olivine | (Mg, Fe) 2SiO4 | |
| pirite | FeS2 | |
| plagioclasio | CaAl2Si2O8 | |
| pirosseno | MgSiO3 | |
| ematite | Fe2O3 | |
| orthoclase | KAlSi3O8 | |
| quarzo | SiO2 |
| Minerale | Formula * | Silicato ferromagnesiano? |
|---|---|---|
| amphibole | Fe7Si8O22 (OH) 2 | |
| muscovite | K2Al4 Si6Al2O20 (OH) 4 | |
| magnetite | Fe3O4 | |
| biotite | K2Fe4Al2Si6Al4O20 (OH) 4 | |
| dolomite | (Ca, Mg) CO3 | |
| garnet | Fe2Al2Si3O12 | |
| serpentine | Mg3Si2O5 (OH) 4 |
* Alcune delle formule, specialmente quelle più complicate, sono state semplificate.
- Un angstrom è l’unità comunemente usata per l’espressione di atomico -dimensioni in scala. Un angstrom è 10-10 mo 0,0000000001 m. Il simbolo per un angstrom è Å. ↵