Informazioni sugli elementi di polonio
L’elemento chimico polonio è classificato come calcogeno e metalloide. Fu scoperto nel 1898 da Marie e Pierre Curie.

Zona dati
| Classificazione: | Il polonio è un calcogeno e un metalloide |
| Colore: | grigio-argento |
| Peso atomico : | (209), senza isotopi stabili |
| Stato: | solido |
| Punto di fusione: | 254 oC, 527 K |
| Punto di ebollizione: | 960 oC, 1233 K |
| Elettroni: | 84 |
| Protoni: | 84 |
| Neutroni nell’isotopo più abbondante: | 125 |
| Gusci di elettroni: | 2,8 , 18,32,18,6 |
| Configurazione elettronica: | 4f14 5d10 6s2 6p4 |
| Densità a 20oC: | 9,4 g / cm3 |
Mostra altro, tra cui: Calore, Energie, Bue idazione,
reazioni, composti, raggi, conduttività
| Volume atomico: | 22,23 cm3 / mol |
| Struttura: | cubico semplice |
| Durezza: | – |
| Capacità termica specifica | 0,12 J g-1 K-1 0,12 |
| Calore di fusione | 13 kJ mol-1 |
| Calore di atomizzazione | 142 kJ mol-1 |
| Calore di vaporizzazione | 120 kJ mol-1 |
| 1a energia di ionizzazione | 812 kJ mol-1 |
| 2a energia di ionizzazione | – |
| 3a energia di ionizzazione | – |
| Affinità elettronica | 180 kJ mol-1 |
| Numero minimo di ossidazione | -2 |
| Min. numero di ossidazione comune | -2 |
| Numero di ossidazione massimo | 6 |
| Max. ossidazione comune n. | 4 |
| Elettronegatività (scala Pauling) | 2.0 |
| Polarizzabilità volume | 6,8 Å3 |
| Reazione con l’aria | lieve, ⇒ PoO2 |
| Reazione con 15 M HNO3 | – |
| Reazione con 6 M HCl | lieve, ⇒ PoCl2 |
| Reazione con NaOH 6 M | nessuno |
| Ossido / i | PoO2, PoO2 |
| Idruro / i | PoH2 |
| Cloruro / i | PoCl2 |
| Raggio atomico | 190 pm |
| Raggio ionico (1+ ione) | – |
| Raggio ionico (2+ ioni) | – |
| Ionico raggio (3+ ioni) | – |
| Raggio ionico (1- ioni) | – |
| Raggio ionico (2 ioni) | – |
| Raggio ionico (3 ioni) | – |
| Conduttività termica | 0.2 W m-1 K-1 |
| Conduttività elettrica | 0,7 x 106 S m-1 |
| Punto di congelamento / fusione: | 254 oC, 527 K |

Marie Curie nel 1883, 16 anni. Il polonio è stato il primo elemento che ha scoperto, 15 anni dopo.
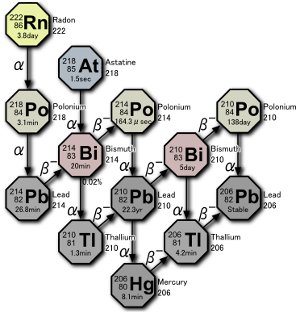
Parte del serie di decadimento dell’uranio. Tre isotopi del polonio sono prodotti in natura, o dal decadimento del gas radon stesso o dal decadimento degli atomi risultante dal decadimento del radon. Immagine di Tosaka.
Discovery of Polonium
Il polonio è stato il primo elemento scoperto da Marie e Pierre Curie.
Hanno scoperto il polonio e poi il radio nel 1898 a Parigi, mentre studiavano la radioattività nella pechblenda (ossido di uranio).
Hanno scritto: “Crediamo che la sostanza che abbiamo estratto dalla pechblenda contenga un metallo mai conosciuto prima, simile al bismuto nelle sue proprietà analitiche. Se l’esistenza di questo nuovo metallo è confermata, suggeriamo che dovrebbe essere chiamato polonio dal nome del paese di origine di uno di noi “.
Secondo i desideri dei Curie, il polonio prende il nome dalla Polonia, dove Marie Curie è nata e cresciuta.
I pericoli del lavoro con elementi radioattivi non erano noti quando i Curie hanno fatto le loro scoperte. I loro quaderni di laboratorio di questo periodo sono così radioattivi che ora sono conservati in una custodia rivestita di piombo. (1)
Aspetto e caratteristiche
Effetti dannosi:
Il polonio è nocivo sia per la sua tossicità chimica che per la sua radioattività.Il polonio-210 è un emettitore alfa, come tale è molto pericoloso se ingerito o inalato.L’esposizione al polonio aumenta il rischio di contrarre vari tipi di cancro.
Caratteristiche:
Il polonio è un metalloide raro, grigio-argenteo, radioattivo, a basso punto di fusione.
Il polonio reagisce prontamente con gli acidi diluiti, ma solo leggermente con gli alcali.
Tutti i suoi isotopi sono radioattivi.
210Po emette un bagliore blu, poiché l’aria circostante è eccitata dal decadimento prodotti. 1 grammo di Po emette tante particelle alfa quanti 5 chilogrammi di radio.
L’energia rilasciata dal decadimento alfa del polonio è considerevole e riscalda lo spazio circostante. L’energia rilasciata è così grande (140 W / g) che una capsula contenente circa mezzo grammo raggiunge una temperatura superiore a 500 ° C.
Usi del Polonio
I raggi alfa emessi da il polonio può essere utilizzato per eliminare l’elettricità statica prodotta durante processi come la laminazione di carta, fili e lamiere. Tuttavia, le sorgenti di raggi beta sono più comunemente utilizzate in quanto sono meno pericolose.
210Po può essere utilizzato come fonte di calore atomica, ma a causa della breve emivita dell’isotopo (138,4 giorni), non fornisce energia per usi a lungo termine.
Il polonio viene anche utilizzato nei pennelli antistatici per eliminare la polvere sulla pellicola fotografica. È sigillato in spazzole per controllare le emissioni radioattive.
Abbondanza e isotopi
Abbondanza crosta terrestre: dell’ordine di 1 parte per quadrilione.
Abbondanza sistema solare: trascurabile
Costo , puro: per 100 g
Costo, sfuso: per 100 g
Fonte: il polonio è un elemento molto raro a causa della breve emivita di tutti i suoi isotopi. Si trova nei minerali di uranio in quantità minime. Può essere ottenuto bombardando il bismuto naturale, 209Bi, con neutroni per dare 210Bi, che poi decade a 210Po tramite decadimento β. Ogni anno vengono sintetizzati circa 100 g di polonio.
Isotopi: il polonio ha 29 isotopi le cui emivite sono note, con numeri di massa da 190 a 218. Nessuno è stabile. L’isotopo più stabile è 209Po, con un’emivita di 102 anni.

Cita questa pagina
Per il collegamento in linea, copia e incolla uno dei seguenti:
<a href="https://www.chemicool.com/elements/polonium.html">Polonium</a>
o
<a href="https://www.chemicool.com/elements/polonium.html">Polonium Element Facts</a>
Per citare questa pagina in un documento accademico, utilizza la seguente citazione conforme MLA:
"Polonium." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/polonium.html>.