Informazioni sull’elemento cadmio
L’elemento chimico cadmio è classificato come metallo di transizione. Fu scoperto nel 1817 da Friedrich Stromeyer.

Zona dati
| Classificazione: | Cadmio è un metallo di transizione |
| Colore: | bianco-bluastro |
| Peso atomico: | 112,41 |
| Stato: | solido |
| Punto di fusione: | 321,1 oC, 594,3 K |
| Punto di ebollizione: | 765 oC, 1038 K |
| Elettroni: | 48 |
| Protoni: | 48 |
| Neutroni nell’isotopo più abbondante: | 66 |
| Gusci di elettroni: | 2,8,18,18,2 |
| Configurazione elettronica: | 4d10 5s2 |
| Densità a 20oC: | 8,65 g / cm3 |
Mostra altro, tra cui: riscaldamenti, energie, ossidazione, reazioni,
composti, raggi, Conduttività
| Volume atomico: | 13,1 cm3 / mol |
| Struttura: | hcp: esagonale chiuso |
| Durezza: | 2.0 mohs |
| Capacità termica specifica | 0,23 J g-1 K-1 |
| Calore di fusione | 6,192 kJ mol-1 |
| Calore di atomizzazione | 112 kJ mol-1 |
| Calore di vaporizzazione | 99,87 kJ mol-1 |
| 1a energia di ionizzazione | 867,7 kJ mol-1 |
| 2a energia di ionizzazione | 1631,4 kJ mol-1 |
| 3a energia di ionizzazione | 3616,2 kJ mol-1 |
| Affinità elettronica | – |
| Numero minimo di ossidazione | 0 |
| Min. numero di ossidazione comune | 0 |
| Numero massimo di ossidazione | 2 |
| Max. ossidazione comune n. | 2 |
| Elettronegatività (scala Pauling) | 1,69 |
| Polarizzabilità volume | 7.2 Å3 |
| Reazione con l’aria | lieve, w / ht ⇒ CdO |
| Reazione con 15 M HNO3 | lieve ⇒ Cd (NO3) 2, NOx |
| Reazione con 6 M HCl | lieve, ⇒ H2, CdCl2 |
| Reazione con NaOH 6 M | nessuno |
| Ossido (i) | CdO, CdO2 |
| Idruro / i | CdH2 |
| Cloruro / i | CdCl2 |
| Raggio atomico | 151 pm |
| Raggio ionico (1+ ioni) | – |
| Raggio ionico (2+ ioni) | 109 pm |
| Raggio ionico (3+ ioni) | – |
| Raggio ionico (1 ione) | – |
| Raggio ionico (2 ioni) | – |
| Raggio ionico (3 ioni) | – |
| Il Conduttività termica | 96,6 W m-1 K-1 |
| Conduttività elettrica | 14,7 x 106 S m-1 |
| Punto di congelamento / fusione: | 321,1 oC, 594,3 K |

Una piccola palla di cadmio metallico, con una moneta per riferimento alle dimensioni.

Friedrich Stromeyer, che scoprì il cadmio nel 1817.
Tavola periodica del cadmio di prossimità
| Gruppo 11 |
Gruppo 12 | Gruppo 13 | |
| 4 | 29 Cu |
30 Zn |
31 Ga |
| 5 | 47 Ag |
48 Cd |
49 In |
| 6 | 79 Au |
80 Hg |
81 Tl |
Scoperta del cadmio
Il cadmio fu scoperto dal chimico tedesco Friedrich Stromeyer nel 1817 come impurità nell’ossido di zinco. (1)
Stromeyer ha fatto la sua scoperta dopo una richiesta del governo di ispezionare le farmacie della città di Hildesheim, in Germania.
A quei tempi l’ossido di zinco veniva usato, così com’è, per curare le malattie della pelle. Per qualche ragione, le farmacie di Hildesheim vendevano carbonato di zinco invece del solito ossido di zinco.
Stromeyer sapeva che riscaldare il carbonato di zinco fino a quando non diventava rovente lo avrebbe convertito in ossido. Lo ha fatto con i campioni delle farmacie. Ha scoperto che il carbonato bianco brillante si è trasformato in un ossido che avrebbe dovuto essere bianco, ma in realtà era giallo / arancione.
Normalmente questo colore suggerisce una contaminazione da ferro o piombo, ma Stromeyer non è riuscito a trovare alcuna traccia di questi elementi.
Ha visitato la fabbrica di Salzgitter dove le farmacie avevano acquistato il carbonato di zinco. Ha chiesto perché stessero vendendo carbonato di zinco invece del solito ossido.
Il manager gli ha spiegato che il loro carbonato di zinco era del colore previsto – bianco – ed era facile da vendere.
Quando hanno cercato di convertire il carbonato in ossido mediante riscaldamento, è sempre diventato giallo. Poiché l’ossido di zinco doveva essere bianco, non potevano venderlo. Lo avevano analizzato attentamente per la contaminazione da ferro, ma non ne trovarono.
Quindi Stromeyer decise che avrebbe analizzato attentamente questo ossido di zinco giallo lui stesso. Ha scoperto che il colore giallo era causato dalla “presenza di un particolare ossido metallico, la cui esistenza non era stata fino ad allora sospettata”.
Ha estratto questo nuovo ossido di metallo dall’ossido di zinco e poi lo ha ridotto per isolare il primo cadmio metallico al mondo. Ha paragonato il suo aspetto a quello del platino e ha misurato la sua densità come 8,75 g / cm3, molto vicino a quella odierna valore accettato.
Ha lavorato ulteriormente e ha scoperto che anche altri composti di zinco contenevano il suo nuovo metallo. Ha analizzato il metallo di zinco “puro” e ha scoperto che il suo nuovo metallo era presente anche in questo.
Ha stimato che il nuovo metallo fosse presente tra lo 0,1% e l’1% nello zinco e nei suoi composti, da cui è stato in grado di isolare 3 grammi di cadmio metallico puro.
Stromeyer ha suggerito il nome di cadmio dopo “cadmia”, il nome latino della calamina. Calamina è un vecchio nome per un minerale di zinco.
Il cadmio è stato scoperto indipendentemente dal chimico tedesco Karl Hermann nel 1818. Hermann aveva notato un inaspettato colore giallo nel solfuro di zinco Si presumeva che il giallo provenisse da impurità di arsenico, ma Hermann si rese conto che era effettivamente dovuto a un ele ment. (2)


Il tellururo di cadmio viene utilizzato per produrre celle solari a film sottile, che possono assorbe più del 90% della luce visibile. Immagine: NREL
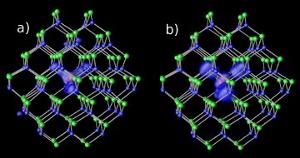
Impurità di magnesio nei nanocristalli di cadmio-selenio a due diversi livelli di gap : (a) risonante e (b) ibrido. Immagine: NERSC
Aspetto e caratteristiche
Effetti nocivi:
Cadmio e suoi composti sono altamente tossici.
Caratteristiche:
Il cadmio è un metallo bianco-bluastro morbido, malleabile, duttile, che può essere facilmente tagliato con un coltello. È un eccellente conduttore elettrico e mostra una buona resistenza alla corrosione e all’attacco di sostanze chimiche.
È simile per molti aspetti allo zinco nelle sue proprietà chimiche.
Il cadmio si appanna nell’aria ed è solubile negli acidi ma non negli alcali.
Il metallo brucia nell’aria per formare ossido di cadmio marrone (CdO).
Usi del cadmio
L’uso principale del cadmio è nelle batterie (in particolare nichel-cadmio ricaricabili, NiCad, batterie).
A causa del suo basso coefficiente di attrito e della sua elevata resistenza alla fatica, il cadmio viene utilizzato nelle leghe per cuscinetti. Il cadmio è utilizzato nelle leghe a basso punto di fusione ed è un componente di molti tipi di saldatura. Viene anche utilizzato nella galvanica.
I composti contenenti cadmio vengono utilizzati nei fosfori televisivi in bianco e nero e nei fosfori blu e verdi per i tubi catodici dei televisori a colori. Il solfuro di cadmio è usato come pigmento giallo e il seleniuro di cadmio è usato come pigmento rosso, spesso chiamato rosso di cadmio.
Il cadmio e il tellurio possono essere combinati in moduli fotovoltaici a film sottile CdTe le cui caratteristiche fisiche sono ideali per produzione di celle solari. Hanno un costo relativamente basso e un bandgap quasi perfetto per la raccolta di energia solare.
Abbondanza e isotopi
Abbondanza della crosta terrestre: 150 parti per miliardo in peso, 30 parti per miliardo in moli
Abbondanza del sistema solare: 6 parti per miliardo in peso, 70 parti per trilione in moli
Costo, puro: $ 46 per 100 g
Costo, all’ingrosso: $ 0,77 per 100 g
Fonte: il cadmio si trova molto spesso in piccole quantità associate ai minerali di zinco, come la sfalerite (ZnS). Greenockite (CdS) è l’unico minerale di cadmio di qualsiasi conseguenza. Quasi tutto il cadmio è ottenuto come sottoprodotto delle operazioni di raffinazione di zinco, rame e piombo.

- Friedrich Stromeyer, Annals of Philosophy, a cura di Thomas Thomson, Volume XIII, 1819, Robert Baldwin, p108
- JW Mellor, A Comprehensive Treatise in Inorganic and Theoretical Chemistry, Volume IV, 1929, Longmans, Green and Co. Ltd., p404
Cita questa pagina
Per il collegamento in linea , copia e incolla uno dei seguenti:
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium</a>
o
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium Element Facts</a>
A cita questa pagina in un documento accademico, utilizza la seguente citazione conforme MLA:
"Cadmium." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cadmium.html>.