Informazioni sull’elemento Francium
L’elemento chimico francio è classificato come un metallo alcalino. Fu scoperto nel 1939 da Marguerite Perey.

Zona dati
| Classificazione: | Francium è un metallo alcalino |
| Colore: | grigio argento metallizzato (presunto) |
| Atomico peso: | (223), senza isotopi stabili |
| Stato: | solido |
| Punto di fusione: | 27 oC, 300 K |
| Punto di ebollizione: | 677 oC, 950 K |
| Elettroni: | 87 |
| Protoni: | 87 |
| Neutroni nell’isotopo più abbondante: | 136 |
| Gusci di elettroni: | 2, 8,18,32,18,8,1 |
| Configurazione elettronica: | 7s1 |
| Densità a 20oC: | 1,873 g / cm3 |
Mostra altro, tra cui: Calore, Energie, Ossidazione,
Reazioni, composti, raggi, conduttività
| Volume atomico: | 71,07 cm3 / mol |
| Struttura: | ritenuta bcc: cubica centrata sul corpo |
| Durezza: | – |
| Capacità termica specifica | – |
| Calore di fusione | 2 kJ mol-1 |
| Calore di atomizzazione | 73 kJ mol-1 |
| Calore di vaporizzazione | 64 kJ mol-1 |
| 1a energia di ionizzazione | 384 kJ mol-1 |
| 2a energia di ionizzazione | – |
| 3a energia di ionizzazione | – |
| Affinità elettronica | – |
| Numero minimo di ossidazione | 0 |
| Min. numero di ossidazione comune | 0 |
| Numero massimo di ossidazione | 1 |
| Max. ossidazione comune n. | 1 |
| Elettronegatività (scala Pauling) | 0,7 |
| Polarizzabilità volume | 48,7 Å3 |
| Reazione con l’aria | – |
| Reazione con 15 M HNO3 | – |
| Reazione con 6 M HCl | vigoroso, ⇒ H2, FrCl |
| Reazione con NaOH 6 M | vigoroso, ⇒ H2, FrOH |
| Ossido / i | – |
| Idruro / i | – |
| Cloruro / i | – |
| Raggio atomico | – |
| Raggio ionico (1+ ione) | 194 pm |
| Raggio ionico (2+ ioni) | – |
| Raggio ionico (3+ ioni) | – |
| Raggio ionico (1 ione) | – |
| Raggio ionico (2 ioni) | – |
| Raggio ionico (3 ioni) | – |
| Conduttività termica | 3,61 W m-1 K-1 |
| Conduttività elettrica | – |
| Punto di congelamento / fusione: | 27 oC, 300 K |

Questo campione di minerale di uranio contiene circa 100.000 atomi di francio-223 (3,3 x 10-20 g). Il Francium è radioattivo; ne esistono meno di 30 g in un dato momento. Immagine rif. (1)
Scoperta di Francium
Francium è stato scoperto da Marguerite Perey nel 1939 mentre stava studiando il decadimento radioattivo dell’attinio-227.
La scoperta è avvenuta presso l’Istituto Curie di Parigi. L’elemento prende il nome dal paese della sua scoperta, la Francia.
La scoperta iniziò, nel 1935, quando Perey, 26 anni, lesse un documento di ricerca in cui affermava che gli scienziati americani avevano scoperto particelle beta emesse dall’attinio che aveva una quantità di energia maggiore del normale.
Perey era curiosa di questa scoperta e, essendo già un’esperta di lavori relativi all’attinio, decise di condurre i suoi esperimenti sull’attinio. Ha prodotto un campione di attinio ultra puro e ne ha studiato la radiazione. Perey scoprì che circa l’1% della radioattività dell’attinio era causata dall’emissione di particelle alfa, non di particelle beta.
Perey aveva scoperto che l’attinio-227 poteva decadere emettendo un nucleo di elio (chiamato anche particella alfa) da il proprio nucleo. Il nucleo figlia formato era un elemento precedentemente sconosciuto che ha scelto di chiamare francio per onorare il suo paese natale, la Francia.
227Ac → 223Fr + 4He
Con 87 protoni il nuovo elemento apparteneva a Gruppo 1 della tavola periodica, che unisce gli altri cinque metalli alcalini: litio, sodio, potassio, rubidio e cesio.
La scoperta del francio ha completato le scoperte dell’umanità di elementi presenti in natura.
Tutti gli elementi scoperti da allora sono stati scoperti quando l’elemento è stato prodotto in laboratorio.

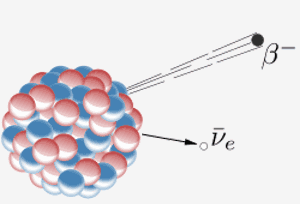
Un nucleo emette una particella beta ( un elettrone) e un antineutrino. Il risultato di ciò è che un neutrone nel nucleo si trasforma in un protone. Quando l’elemento 87 nella tavola periodica (francio) fa questo, il protone in più significa che diventa l’elemento 88 (radio).
Aspetto e caratteristiche
Effetti nocivi:
Il Francium è altamente radioattivo.
Caratteristiche:
Il Francium è un metallo pesante, instabile e radioattivo con un’emivita massima di soli 22 minuti. Ha un punto di fusione basso (27 oC, 81 oF) e, se si potesse accumulare una quantità sufficiente, sarebbe liquido in una stanza calda.
Il francio è il secondo elemento più raro nella crosta terrestre, accanto all’astato. Esistono meno di trenta grammi di francio sulla Terra in un dato momento.
Il francio è il meno elettronegativo di tutti gli elementi, quindi dovrebbe essere il metallo alcalino più chimicamente reattivo. Sfortunatamente, non è disponibile in quantità sufficienti per mostrare che reagisce con l’acqua: è prodotto in piccole quantità in acceleratori di particelle. In teoria, la sua reazione con l’acqua sarebbe più violenta del cesio e molto più violenta di quella del sodio.
Il francium è stato studiato di recente alla Stony Brook University di New York. Gli scienziati hanno intrappolato fino a diecimila atomi di francio alla volta utilizzando raggi laser in un campo magnetico per misurare le loro proprietà.
Usi di Francium
Commercialmente, non ci sono usi per Francium, a causa della sua rarità e instabilità. Viene utilizzato solo a scopo di ricerca.
Decadimento del Francium
Gli isotopi del Francium, con numeri di massa compresi tra 200 e 232, più comunemente subiscono il decadimento alfa o beta.
Di seguito sono riportati solo alcuni esempi dei percorsi di decadimento del francio:
Il francio-223 è l’isotopo dell’elemento più longevo. Ha un’emivita di 22 minuti. Può emettere una particella alfa (un nucleo di elio) per formare l’astato-219 o una particella beta per formare il radio-223. (Una particella beta è un elettrone che viene emesso da un nucleo quando un neutrone si converte in un protone.)
Francium-221 ha un’emivita di 5 minuti. Può emettere una particella alfa per formare l’astato-217 o una particella beta per diventare radio-221.
Il francio-216 ha un’emivita di 0,7 microsecondi. Può emettere una particella alfa per formare l’astato-212 o un positrone per formare il radon-216.
Il francio-212 ha un’emivita di 19 minuti. Può emettere una particella alfa per formare l’astato-208 o catturare un elettrone orbitale per formare il radon-212. (2) (Durante la cattura degli elettroni orbitali, il nucleo cattura uno degli elettroni dell’atomo ed emette un neutrino.)
Abbondanza e isotopi
Abbondanza crosta terrestre: ~ 0 parti per milione , ~ 0 parti per milione
Abbondanza del sistema solare: ~ 0 parti per miliardo in peso, ~ 0 parti per miliardo in moli
Costo, puro: $ per 100 g
Costo, sfuso: $ per 100 g
Fonte: il Francium si trova naturalmente a causa del decadimento radioattivo alfa dell’attinio.
Isotopi: Il Francium ha 33 isotopi la cui emivita sono noti, con numeri di massa da 200 a 232. Nessuno è stabile. 223Fr ha l’emivita più lunga a 21,8 minuti.

- Foto di Konrad Roeder
- EK Hyde, a. Ghiorso, G.T. Seaborg, Physical Review., 1950, 77, p765, numero 6.
Cita questa pagina
Per il collegamento in linea, copia e incolla uno dei seguenti:
<a href="https://www.chemicool.com/elements/francium.html">Francium</a>
o
<a href="https://www.chemicool.com/elements/francium.html">Francium Element Facts</a>
Per citare questa pagina in un documento accademico, utilizza il seguente citazione conforme MLA:
"Francium." Chemicool Periodic Table. Chemicool.com. 11 Jan. 2015. Web. <https://www.chemicool.com/elements/francium.html>.