Riviste | Politica | Autorizzazione alla ricerca in gastroenterologia
Prevedibilità della metaplasia intestinale gastrica da eritema chiazzato chiazzato visto in endoscopia
Naoyoshi Nagataa, g, Takuro Shimbob, Junichi Akiyamaa, Ryo Nakashimaa, Hyung Hun Kimc, Takeichi Yoshidad, Kazufusa Hoshimotoe, Naomi Uemuraf
aDepartment of Gastroenterology and Hepatology, National Center for Global Health and Medicine (NCGM), Tokyo, Giappone
bDipartimento di ricerca clinica e informatica International Clinical Research Center Research Institute, NCGM, Tokyo, Giappone
cDivisione di medicina interna, Kosin University College of Medicine, Busan, Corea
dDipartimento di gastroenterologia ed epatologia, Wakayama Medical University, Wakayama, Giappone
eDepartment of Clinical Laboratory Pathological Division, NCGM, Tokyo, Giappone
fDepartment of Gastroenterology and Hepatology, NCGM, Kohnodai Hospital, Chiba, Giappone
gAutore corrispondente: Naoyoshi Nagata, Department of G astroenterology and Hepatology, National Center for Global Health and Medicine, 1-21-1 Toyama, Shinjuku-ku, Tokyo 162-8655, Giappone
Manoscritto accettato per la pubblicazione 26 settembre 2011
Titolo breve: Diagnosi endoscopica della metaplasia intestinale
doi: https://doi.org/10.4021/gr357w
- Astratto
- Introduzione
- Metodi
- Risultati
- Discussione
| Astratto | ▴Top |
Background: la metaplasia intestinale (IM) è considerata una lesione premaligna. Tuttavia, la diagnosi endoscopica di IM è stata considerata difficile. Utilizzando l’endoscopia, abbiamo trovato un modello unico di eritema, “eritema a chiazze chiazzato (MPE)”, che include IM grave. L’infezione da Helicobacter pylori (Hp) stessa può causare eritema, che riflette i cambiamenti istologici nella mucosa gastrica. Pertanto abbiamo arruolato l’eradicazione dell’Hp pazienti per convalidare la relazione tra MPE e risultati patologici.
Metodi: Abbiamo arruolato pazienti con gastrite cronica che sono stati sottoposti con successo all’eradicazione dell’Hp almeno 6 mesi prima dello studio. Abbiamo definito MPE come lesioni eritematose multiple piatte o depresse. Quando abbiamo riscontrato l’errore massimo tollerato all’endoscopia, abbiamo eseguito una biopsia sia sul sito MPE che sul sito non MPE. Il sito non MPE è stato definito come una mucosa adiacente situata entro 3 cm dal sito MPE. Tutti i campioni bioptici sono stati valutati immunoistochimicamente per il sottotipo IM utilizzando Colorazioni MUC2, MUC5AC, MUC6, CD10 e CDX2. Il grado di IM è stato definito secondo il Sistema Sydney aggiornato. È stata calcolata l’accuratezza diagnostica dei risultati MPE per IM patologico. è stata valutata anche la relazione tra MPE e sottotipo IM.
Risultati: per lo studio sono stati selezionati un totale di 102 pazienti. Di questi, 55 (54%) pazienti hanno avuto MPE. I campioni bioptici sono stati prelevati dai siti MPE e non MPE da questi 55 pazienti. Le percentuali di IM e i punteggi mediani di IM erano entrambi significativamente più alti nei siti MPE (P < 0,001) rispetto ai siti non MPE. La sensibilità e la specificità per l’errore massimo tollerato nella rilevazione dell’IM istologico erano rispettivamente del 72,7% e dell’84,1%. Non sono state osservate associazioni significative nell’espressione di MUC2, MUC5AC, MUC6, CD10 e CDX2 tra i siti MPE e non MPE. Non c’erano differenze significative nei rapporti (completo / incompleto) dei sottotipi IM tra i due gruppi.
Conclusioni: MPE è un utile reperto endoscopico per rilevare IM istologico senza l’uso di cromoendoscopia e ingrandimento endoscopico. Tuttavia, il sottotipo IM è difficile da identificare. Nell’era dell’eradicazione dell’Hp, MPE ha il potenziale per diventare un reperto predittivo per il rischio di cancro gastrico.
Parole chiave: metaplasia intestinale; Lesione premaligna; Reperto endoscopico; Eritema; Endoscopia a luce bianca; Sottotipo, eradicazione; Helicobacter pylori
| Introduzione | ▴Top |
Si ritiene che lo sviluppo del cancro gastrico implichi un processo in più fasi, tra cui infezione da Helicobacter pylori (Hp), gastrite cronica, atrofia ghiandolare, metaplasia intestinale (IM) e displasia. La IM e l’atrofia gastrica sono considerate insieme fattori di rischio per lo sviluppo del cancro gastrico di tipo intestinale e sono considerate lesioni precancerose.L’atrofia gastrica può essere riconosciuta mediante endoscopia e si correla con la valutazione istologica. Tuttavia, la diagnosi di IM utilizzando l’endoscopia a luce bianca standard è stata considerata difficile a causa della mancanza di distinzione di colore nella IM e della sua presenza come lesioni multiple piatte.
Recentemente , abbiamo scoperto che un unico reperto eritematoso all’endoscopia poteva essere osservato anche dopo l’eradicazione dell’Hp. Descriviamo questo risultato come “eritema a chiazze chiazzate (MPE)”. L’errore massimo tollerato può essere riconosciuto come lesioni eritematose multiple piatte o leggermente depresse sotto l’endoscopia a luce bianca standard; patologicamente, include IM grave. L’infezione da HP stessa può causare eritema, osservato all’endoscopia, che riflette cambiamenti istologici come infiltrazione di cellule infiammatorie ed edema. Pertanto , abbiamo arruolato pazienti sottoposti a eradicazione dell’Hp al fine di convalidare la relazione tra MPE e risultati patologici.
| Metodi | ▴Top |
Selezione paziente
I pazienti con gastrite cronica che sono stati sottoposti con successo all’eradicazione dell’Hp almeno 6 mesi prima dello studio sono stati arruolati prospetticamente per lo studio presso il National Center for Global Health and Medicine (NCGM) tra gennaio 2008 e dicembre 2008. Criteri di esclusione i ncluso l’uso di farmaci antinfiammatori non steroidei (FANS), antiacidi e farmaci antitrombotici durante le 4 settimane prima dell’endoscopia. Sono stati inoltre esclusi i pazienti con una storia di chirurgia gastrica, malattia emorragica, cirrosi epatica, insufficienza renale, insufficienza cardiaca e cancro gastrico precoce o avanzato. Il consenso informato scritto è stato ottenuto dai partecipanti in conformità con la Dichiarazione di Helsinki e la sua successiva revisione. Il protocollo dello studio è stato approvato dal Comitato Etico dell’NCGM.
Eradicazione dell’Helicobacter pylori
I pazienti con gastrite cronica e ulcera peptica indotta da infezione da Hp sono stati sottoposti a terapia di eradicazione. I pazienti sono stati trattati con un regime di 7 giorni composto da amoxicillina, claritromicina e un inibitore della pompa protonica (PPI) due volte al giorno, che era il regime standard di prima linea approvato in Giappone. Se l’eradicazione non ha avuto successo, è stato somministrato un secondo regime costituito da amoxicillina, metronidazolo e PPI. L’eradicazione è stata confermata da un esame istologico negativo delle biopsie gastriche, insieme a un test del respiro dell’urea 13C negativo (13C-UBT) da 2 a 3 mesi dopo il completamento della terapia di eradicazione. Quando tutti i test erano negativi, un paziente è stato definito negativo per l’infezione da HP.
Valutazione endoscopica
Almeno 6 mesi dopo l’eradicazione dell’Hp, i pazienti sono stati sottoposti a esame endoscopico. Abbiamo utilizzato un endoscopio ad alta risoluzione senza ingrandimento (videoscopio Olympus, modello GIF-H260) per osservare la presenza di MPE nella mucosa gastrica. Abbiamo definito MPE come lesioni eritematose multiple piatte o leggermente depresse che erano distinguibili da mucosa congestionata, emorragia, angioectasia, eritema macchiato ed eritema lineare (Fig. 1A, B). Abbiamo anche distinto tra MPE e mucosa rossastra con un epitelio rigenerante accompagnato da ulcera o cicatrice dell’ulcera.
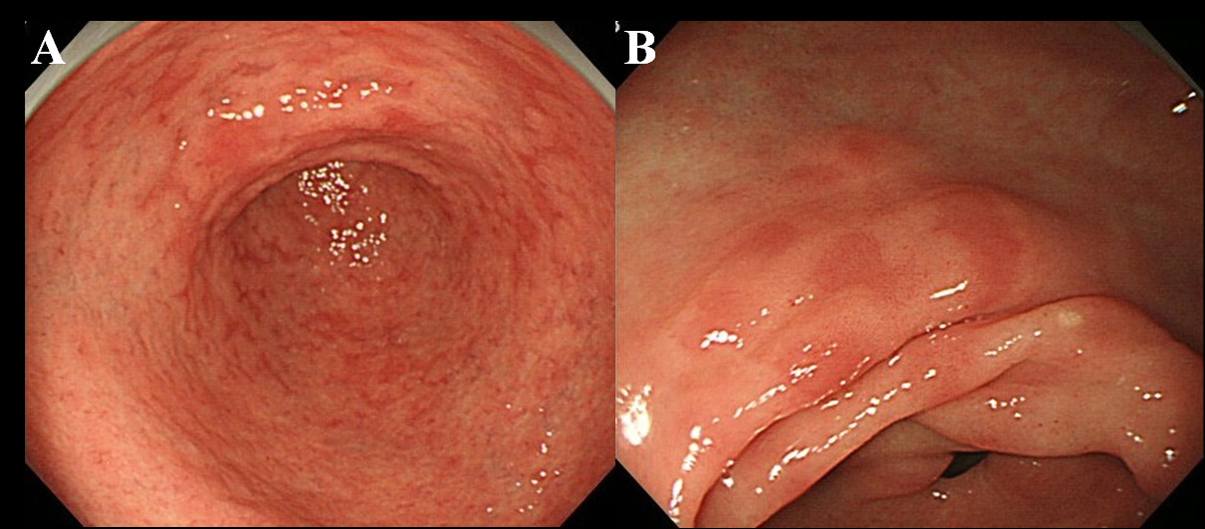 Fare clic per un’immagine grande |
Figura 1. Rilevamento endoscopico di MPE. (A) eritema multiplo e piatto nell’antro; (B) Eritema piatto e depresso nella curvatura minore dell’antro. |
Quando abbiamo riscontrato un rilevamento di MPE all’endoscopia, abbiamo eseguito la biopsia sia del sito MPE che del sito non MPE. Il sito non MPE è stato definito come una mucosa adiacente situata entro 3 cm dal sito MPE (Fig. 2).
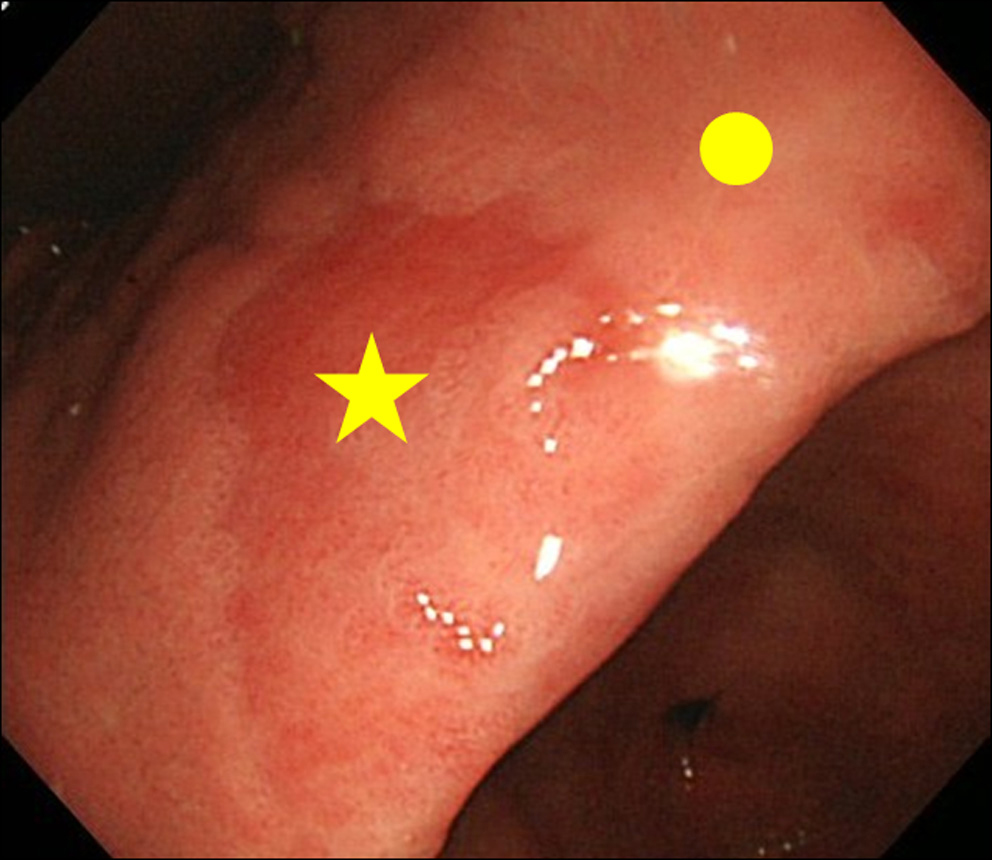 Fare clic per un’immagine grande |
Figura 2. Sito di biopsia. (★) Sito di biopsia di MPE; (•) Sito di biopsia di non MPE. Il sito non MPE è stato definito come una mucosa adiacente situata entro 3 cm dal sito MPE. |
L’estensione del confine atrofico è stata classificata in 3 fasi: lieve, moderata e grave, come definito da Kimura e Takemoto.
Valutazione istologica
I campioni bioptici sono stati inviati al nostro laboratorio, fissati in formalina tamponata al 10%. I campioni sono stati processati, incorporati in paraffina e tagliati in sezioni da 4 µm. I vetrini di ciascun campione sono stati colorati utilizzando ematossilina-eosina (HE) (Fig.3A) e colorazione immunoistochimica. Le colorazioni immunoistochimiche includevano: (1) MUC2, un marker della mucina intestinale utile per rilevare le cellule caliciformi (Fig. 3B), (2) MUC5AC, un marker della mucina gastrica, che è espresso nelle cellule del collo mucoso e nel epitelio foveolare (Fig. 3C), (3) MUC6, un marker per la mucina gastrica, che è espresso nelle cellule mucose della zona del collo del corpo e nelle ghiandole piloriche dell’antro (Fig. 3D), (4) CD10, a marker utile per rilevare il bordo del pennello dell’intestino tenue (Fig. 3E) e (5) CDX2, un marker per la presenza di IM (Fig. 3F). Abbiamo utilizzato CDX2 perché studi recenti hanno dimostrato che l’espressione di CDX2 poteva essere osservata ampiamente nelle ghiandole IM e non è scomparsa dopo l’eradicazione dell’Hp. La presenza di IM è stata confermata sia dall’HE che dalla colorazione immunoistochimica.
I sottotipi di IM sono stati classificati come tipi completi o incompleti. Il tipo completo è stato definito come ridotta espressione di mucina gastrica (MUC5AC o MUC6) e co-espressione di mucina intestinale (MUC2) e CD10 (Fig. 3A-F). Il tipo incompleto è stato definito come l’espressione di mucina gastrica (MUC5AC o MUC6) e MUC2. Poiché non esistono criteri stabiliti per classificare un caso come contenente sia il tipo completo che quello incompleto in una sezione, abbiamo assegnato i sottotipi IM come tipo prevalente.
Il grado di IM è stato valutato in base al sistema Sydney aggiornato (0: nessuno, 1: lieve, 2: moderato, 3: contrassegnato).
Analisi statistica
Abbiamo diviso i pazienti in due gruppi in base al fatto che i pazienti fossero positivi o negativi per MPE. Abbiamo utilizzato il test t di Student per confrontare età e periodo di eradicazione. Il test chi-quadrato o il test di probabilità esatta di Fisher sono stati utilizzati per i rapporti tra i sessi e il grado di atrofia endoscopica nei due gruppi.
Abbiamo anche confrontato i risultati istologici tra i siti di MPE e i siti non MPE. Per confrontare le differenze tra i due siti di biopsia, abbiamo utilizzato il Wilcoxon Matched-Pairs Signed-Ranks Test per l’IM punteggio mediano e il test esatto di Fisher per la prevalenza di IM, sottotipi IM e fenotipi IM. Sono stati calcolati sensibilità, specificità, valori predittivi positivi e negativi e rapporti di probabilità positivi e negativi di MPE osservati all’endoscopia per la rilevazione di IM patologico. I valori P < 0,05 sono stati considerati significativi. Tutte le analisi statistiche sono state eseguite con il software Stata, versione 10 (StataCorp LP, College Station, TX, USA).
| Risultati | ▴Top |
Caratteristiche del paziente
Durante il periodo di studio, 157 pazienti che sono stati sottoposti a endoscopia superiore e hanno ricevuto l’eradicazione dell’Hp sono stati esaminati. Sono stati esclusi 52 dei 157 pazienti dall’analisi per uno qualsiasi dei seguenti criteri: uso di antiacidi (31), farmaci antitrombotici (17) o FANS (3); o storia di cirrosi epatica (5), insufficienza cardiaca (1) o cancro gastrico in fase iniziale (2). Ad alcuni pazienti è stato applicato più di un criterio di esclusione.
Un totale di 102 pazienti sono stati quindi selezionati per l’analisi dopo l’esclusione. Di questi, c’erano 55 (54%) pazienti con MPE. Non sono state osservate differenze significative nell’età e nel sesso medi tra i pazienti MPE-positivi e negativi (Tabella 1). Non c’erano differenze significative tra i due gruppi dopo il periodo di eradicazione dell’Hp. Tuttavia, l’atrofia gastrica con una gravità più elevata (da moderata a grave) è apparsa significativamente più frequentemente nel gruppo MPE-positivo rispetto al gruppo MPE-negativo (positivo 65,6% contro negativo 45,0%, P = 0,035).
 Fare clic per visualizzare |
Tabella 1. Caratteristiche demografiche dei pazienti (n = 102) |
Reperti endoscopici e caratteristiche patologiche
 Fai clic per visualizzare |
Tabella 2. Confronto del punteggio IM tra MPE e sito non MPE (n = 55) |
Non sono state osservate associazioni significative nell’espressione di MUC2, MUC5AC, MUC6, C D10 e CDX2 tra i siti MPE e i siti non MPE (Tabella 3). Non c’era alcuna differenza significativa nei rapporti (completo / incompleto) dei sottotipi IM tra i due gruppi (MPE: 18/30 versus non-MPE: 8/10, P = 0,778).
 Fare clic per visualizzare |
Tabella 3. Fenotipi e sottotipi di metaplasia intestinale |
| Discussione | ▴Top |
In questo studio, ci siamo concentrati su un aspetto eritematoso unico osservato in endoscopia dopo l’eradicazione dell’Hp. Abbiamo chiamato questo risultato “MPE” e abbiamo scoperto che la presenza di MPE osservata in endoscopia era tipicamente caratteristica dell’IM patologico.
La diagnosi di IM con l’endoscopia convenzionale ha è stato considerato difficile perché l’IM di solito appare nella mucosa piatta e mostra pochi cambiamenti morfologici Kaminishi et al hanno riportato “cambiamenti nodulari color cenere” come indicatore per IM; l’accuratezza dei risultati di questi ricercatori era alta, con una specificità del 98-99%, ma la sensibilità era bassa (6-12%). Kaminishi et al hanno notato che l’endoscopia convenzionale è meno utile per confermare la diagnosi di IM. Sono emersi studi recenti riguardanti la scoperta endoscopica della IM utilizzando l’endoscopia ingrandente. È stato riportato che i segni distintivi di fosse gastriche osservati con la cromoendoscopia con blu di metilene e l ‘”aspetto simile ai villi” osservato con l’endoscopia confocale sono stati utili per la diagnosi della IM. Uedo et al hanno riferito che l’aspetto di “una cresta azzurra” ( LBC) è un segno accurato della presenza di IM, come si è visto con l’endoscopia di ingrandimento delle immagini a banda stretta (NBI). Tuttavia, a causa degli elevati costi delle apparecchiature e delle competenze e del tempo aggiuntivi necessari per un esame più approfondito utilizzando strumenti speciali come l’NBI o l’endoscopia ingrandente, lo screening con questa apparecchiatura non è pratico nella pratica clinica quotidiana. Inoltre, aumenta il rischio di danni al DNA nella mucosa gastrointestinale quando si utilizza la cromoendoscopia con blu di metilene seguito da luce bianca, che richiede cautela nel suo utilizzo. Pertanto, è più vantaggioso diagnosticare la IM trovando MPE senza l’uso della cromoendoscopia e dell’endoscopia con ingrandimento. I risultati del nostro studio suggeriscono che la presenza di IM può essere diagnosticata con un’endoscopia standard senza biopsia.
Perché è possibile osservare l’errore MPE anche dopo l’eradicazione dell’Hp? Ciò potrebbe essere attribuibile ai cambiamenti istologici all’interno della mucosa gastrica. I notevoli cambiamenti istologici conseguenti all’eradicazione includono miglioramenti nell’infiltrazione di cellule infiammatorie, iperplasia epiteliale ed edema. Le immagini endoscopiche della mucosa eritematosa ed edematosa che sembrano essere migliorate riflettono questi cambiamenti istologici. Pertanto, ipotizziamo che MPE sia costituito da un’area rimanente di IM eritematosa persistente e un’area non IM rapidamente recuperata risultante dall’eradicazione di Hp riuscita. L’eradicazione di Hp ha reso più chiaro il contrasto tra l’area dell’errore massimo tollerato e le aree non MPE. Tuttavia, non è noto il motivo per cui solo il sito dell’errore massimo tollerato viene osservato come mucosa eritematosa. Si può probabilmente dedurre che un’area molto densa di microvasi circonda le ghiandole metaplastiche; questo non è stato chiarito in questo studio. Inoltre, il punteggio IM nel sito MPE era significativamente più alto del punteggio nel sito non MPE. Si ipotizza che la comparsa della mucosa eritematosa sia associata alla presenza di molte ghiandole metaplastiche.
Il presente studio ha dimostrato che il sottotipo IM completo è stato trovato prevalentemente nella mucosa gastrica . I sottotipi di IM sono stati classificati nel tipo completo o incompleto; questi sono i sottotipi più utilizzati. Diversi studi hanno dimostrato che il tipo completo non presenta alcun aumento del rischio di sviluppare carcinoma, mentre il tipo incompleto è associato a un aumento del rischio di trasformazione maligna. Tuttavia, l’associazione tra i sottotipi e il rischio di cancro gastrico non è ampiamente accettata. Al momento, è difficile identificare uno dei sottotipi utilizzando l’endoscopia standard.
È stato riportato che la terapia di eradicazione dell’Hp è efficace nel prevenire sia l’ulcera gastrointestinale che lo sviluppo del cancro gastrico. Questi usi della terapia per l’eradicazione dell’Hp emergeranno probabilmente nella pratica clinica nel prossimo futuro. Tuttavia, è necessario prestare attenzione contro il rischio di sviluppo di cancro gastrico dopo l’eradicazione dell’Hp. È stato riportato che le caratteristiche del cancro gastrico dopo l’eradicazione includono IM patologicamente grave al corpo e grave atrofia gastrica rilevata all’endoscopia. Pertanto, è necessario osservare attentamente la presenza di IM anche dopo l’eradicazione dell’Hp.
In conclusione, la presenza di MPE all’esame endoscopico è caratteristica della IM patologica.Sarebbe utile nella pratica clinica essere in grado di diagnosticare l’IM patologica senza cromoendoscopia o endoscopia ingrandente. L’MPE ha il potenziale per diventare una scoperta predittiva del rischio di cancro gastrico nell’era dell’eradicazione dell’Hp.
Ringraziamenti
Ringraziamo il Dr. Hidenobu Watanabe e il Dr. Hiroyoshi Ota per i loro servizi di consulenza a questo studio riguardo alle valutazioni patologiche. Desideriamo esprimere la nostra gratitudine a Hisae Kawashiro, coordinatrice della ricerca clinica, per l’aiuto nella raccolta dei dati.
Concedi supporto
Questo lavoro è stato sostenuto dal Grant of National Center for Global Health and Medicine (21-108).
Conflicts of Interest
Gli autori dichiarano di non avere conflitti di interesse.
| ▴Top |
- Correa P. Carcinogenesi gastrica umana: un processo a più fasi e multifattoriale – Prima conferenza del premio American Cancer Society sul cancro Epidemiologia e prevenzione. Cancer Res. 1992; 52 (24): 6735-6740.
pubmed - Leung WK, Sung JJ. Articolo di revisione: metaplasia intestinale e carcinogenesi gastrica. Aliment Pharmacol Ther. 2002; 16 (7): 1209-1216.
pubmed doi - Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, et al. Infezione da Helicobacter pylori e sviluppo del cancro gastrico. N Engl J Med. 2001; 345 (11): 784-789.
pubmed doi - Kimura K, Takemoto T. Un riconoscimento endoscopico del confine atrofico e del suo significato nella gastrite cronica. Endoscopia. 1969; 1: 1-3.
- Satoh K, Kimura K, Taniguchi Y, Kihira K, Takimoto T, Saifuku K, Kawata H, et al. Siti di biopsia idonei per la diagnosi dell’infezione da Helicobacter pylori e per la valutazione dell’entità della gastrite atrofica. Sono J Gastroenterol. 1998; 93 (4): 569-573.
pubmed doi - Kaminishi M, Yamaguchi H, Nomura S, Oohara T, Sakai S, Fukutomi H, Nakahara A, et al. Classificazione endoscopica della gastrite cronica basata su uno studio pilota della Research Society for Gastritis. Digest Endosc. 2002; 14: 138-151.
- Rugge M, Leandro G, Farinati F, Di Mario F, Sonego F, Cassaro M, Guido M, et al. Displasia epiteliale gastrica. Come il background clinico-patologico si riferisce alla gestione. Cancro. 1995; 76 (3): 376-382.
pubmed doi - Nagata N, Akiyama J, Uemura N. Diagnosi endoscopica della metaplasia intestinale gastrica dopo l’eradicazione dell’Helicobacter pylori. Endoscopia. 2009; 41 (suppl I): A212.
- Dixon MF, Genta RM, Yardley JH, Correa P. Classificazione e classificazione della gastrite. Il Sydney System aggiornato. Seminario internazionale sull’istopatologia della gastrite, Houston 1994. Am J Surg Pathol. 1996; 20 (10): 1161-1181.
pubmed doi - Ho SB, Shekels LL, Toribara NW, Kim YS, Lyftogt C, Cherwitz DL, Niehans GA. Espressione genica della mucina nell’epitelio gastrico umano normale, preneoplastico e neoplastico. Cancer Res. 1995; 55 (12): 2681-2690.
pubmed - Silva E, Teixeira A, David L, Carneiro F, Reis CA, Sobrinho-Simoes J, Serpa J, et al. Mucine come molecole chiave per la classificazione della metaplasia intestinale dello stomaco. Virchows Arch. 2002; 440 (3): 311-317.
pubmed doi - Reis CA, David L, Correa P, Carneiro F, de Bolos C, Garcia E, Mandel U, et al. La metaplasia intestinale dello stomaco umano mostra modelli distinti di espressione di mucina (MUC1, MUC2, MUC5AC e MUC6). Cancer Res. 1999; 59 (5): 1003-1007.
pubmed - Groisman GM, Amar M, Livne E. CD10: uno strumento prezioso per la diagnosi microscopica ottica della malattia da inclusione microvillosa (atrofia microvillosa familiare). Sono J Surg Pathol. 2002; 26 (7): 902-907.
pubmed doi - Carl-McGrath S, Lendeckel U, Ebert M, Wolter AB, Roessner A, Rocken C. Le ectopeptidasi CD10, CD13, CD26 e I CD143 sono sovraregolati nel cancro gastrico. Int J Oncol. 2004; 25 (5): 1223-1232.
pubmed - Bai YQ, Yamamoto H, Akiyama Y, Tanaka H, Takizawa T, Koike M, Kenji Yagi O, et al. Espressione ectopica della proteina omeodominio CDX2 nella metaplasia intestinale e nei carcinomi dello stomaco. Cancro Lett. 2002; 176 (1): 47-55.
pubmed doi - Satoh K, Mutoh H, Eda A, Yanaka I, Osawa H, Honda S, Kawata H, et al. Espressione aberrante di CDX2 nella mucosa gastrica con e senza metaplasia intestinale: effetto di eradicazione dell’Helicobacter pylori. Helicobacter. 2002; 7 (3): 192-198.
pubmed doi - Dinis-Ribeiro M, da Costa-Pereira A, Lopes C, Lara-Santos L, Guilherme M, Moreira-Dias L, Lomba- Viana H, et al. Cromoendoscopia a ingrandimento per la diagnosi di metaplasia e displasia intestinale gastrica. Gastrointest Endosc. 2003; 57 (4): 498-504.
pubmed doi - Areia M, Amaro P, Dinis-Ribeiro M, Cipriano MA, Marinho C, Costa-Pereira A, Lopes C, et al. Validazione esterna di una classificazione per la cromoendoscopia con ingrandimento del blu di metilene nelle lesioni gastriche premaligne. Gastrointest Endosc. 2008; 67 (7): 1011-1018.
pubmed doi - Yang JM, Chen L, Fan YL, Li XH, Yu X, Fang DC. Pattern endoscopici della mucosa gastrica e suo significato clinico-patologico. World J Gastroenterol. 2003; 9 (11): 2552-2556.
pubmed - Uedo N, Ishihara R, Iishi H, Yamamoto S, Yamada T, Imanaka K, Takeuchi Y, et al. Un nuovo metodo per diagnosticare la metaplasia intestinale gastrica: imaging a banda stretta con endoscopia ingrandente. Endoscopia. 2006; 38 (8): 819-824.
pubmed doi - Kiesslich R, Jung M. Ingrandimento dell’endoscopia: migliora l’analisi della superficie della mucosa per la diagnosi delle neoplasie gastrointestinali ?. Endoscopia. 2002; 34 (10): 819-822.
pubmed doi - Olliver JR, Wild CP, Sahay P, Dexter S, Hardie LJ. Cromoendoscopia con blu di metilene e danni al DNA associati nell’esofago di Barrett. Lancet. 2003; 362 (9381): 373-374.
pubmed doi - Oda Y , Miwa J, Kaise M, Matsubara Y, Hatahara T, Ohta Y. Studio di follow-up quinquennale sulle alterazioni istologiche ed endoscopiche nella mucosa gastrica dopo l’eradicazione dell’Helicobacter pylori. Dig Endosc.2004; 16: 213-18.
- Tepes B, Kavcic B, Zaletel LK, Gubina M, Ihan A, Poljak M, Krizman I. Follow-up istologico da due a quattro anni della mucosa gastrica dopo Helicobacter pylori eradicazione. J Pathol. 1999; 188 (1): 24-29.
pubmed doi - Jass JR, Filipe MI. I profili di mucina dello stomaco normale mucosa, metaplasia intestinale e sue varianti e carcinoma gastrico. Histochem J. 1981; 13 (6): 931-939.
pubmed doi - Filipe MI, Munoz N, Matko I, Kato I, Pompe-Kirn V, Jutersek A, Teuchmann S, et al.Tipi di metaplasia intestinale e rischio di cancro: uno studio di coorte in Slovenia. Int J Cancer. 1994; 57 (3): 324-329.
pubmed doi - Rokkas T, Filipe MI, Sladen GE. Rilevazione di un’aumentata incidenza di carcinoma gastrico precoce in pazienti con metaplasia intestinale di tipo III che sono seguiti da vicino. Intestino. 1991; 32 (10): 1110-1113.
pubmed doi - Genta RM, Rugge M. Articolo di revisione: stati pre-neoplastici della mucosa gastrica: un approccio pratico per il medico perplesso. Aliment Pharmacol Ther. 2001; 15 (Suppl 1): 43-50.
pubmed - Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, Terao S, et al. Effetto dell’eradicazione dell’Helicobacter pylori sull’incidenza del carcinoma gastrico metacrono dopo resezione endoscopica del carcinoma gastrico precoce: uno studio in aperto, randomizzato e controllato. Lancetta. 2008; 372 (9636): 392-397.
pubmed doi - Tashiro J, Miwa J, Tomita T; Matsubara Y, Oota Y. Cancro gastrico rilevato dopo l’eradicazione dell’Helicobacter pylori. Endoscopia digestiva. 2007; 19: 167-173.
Questo è un articolo ad accesso aperto distribuito secondo i termini della Creative Commons Attribution License, che consente l’uso, la distribuzione e la riproduzione senza restrizioni con qualsiasi mezzo, a condizione che il lavoro originale sia citato correttamente.
Gastroenterology Research è pubblicato da Elmer Press Inc.