Soluzioni
Proprietà colligative
Depressione della pressione di vapore
Le proprietà fisiche possono essere suddivise in due categorie. Le proprietà estese (come massa e volume) dipendono dalle dimensioni del campione. Le proprietà intense (come densità e concentrazione) sono proprietà caratteristiche della sostanza; non dipendono dalla dimensione del campione in esame. Questa sezione introduce una terza categoria che è un sottoinsieme delle proprietà intensive di un sistema. Questa terza categoria, nota come proprietà colligative, può essere applicata solo alle soluzioni. Per definizione, una delle proprietà di una soluzione è una proprietà colligativa se dipende solo dal rapporto del numero di particelle di soluto e solvente nella soluzione, non dall’identità del soluto.
Pochissime proprietà fisiche di una soluzione sono proprietà colligative. Come esempio di questo insieme limitato di proprietà fisiche, consideriamo cosa accade alla pressione di vapore del solvente quando aggiungiamo un soluto per formare una soluzione. Definiremo Po come la pressione di vapore del liquido puro ![]() il solvente
il solvente ![]() e P come pressione di vapore del solvente dopo l’aggiunta di un soluto.
e P come pressione di vapore del solvente dopo l’aggiunta di un soluto.
Po = pressione di vapore del liquido puro, o solvente
P = pressione di vapore del solvente in una soluzione
Quando la temperatura di un liquido è inferiore al punto di ebollizione punto, possiamo supporre che le uniche molecole che possono fuoriuscire dal liquido per formare un gas sono quelle che giacciono vicino alla superficie del liquido.
Quando un soluto viene aggiunto al solvente, alcune delle solutemolecole occupano lo spazio vicino alla superficie del liquido, come mostrato nella figura sotto. Quando un soluto viene sciolto in un solvente, il numero di molecole di solvente vicino alla superficie diminuisce e la pressione di vapore del solvente diminuisce.

Ciò non ha alcun effetto sulla velocità con cui le molecole di solvente nella fase gassosa si condensano per formare un liquido. Ma diminuisce la temperatura alla quale le molecole di solvente nel liquido possono fuoriuscire nella fase gassosa. Di conseguenza, la pressione di vapore del solvente che fuoriesce da una soluzione dovrebbe essere inferiore alla pressione di vapore del solvente puro.
| P | < | Po | ||
| tensione di vapore della solvente sopra una soluzione |
tensione di vapore del solvente puro |
Tra il 1887 e il 1888, Francois-Marie Raoult ha dimostrato che la pressione di vapore di una soluzione è uguale alla frazione molare del solvente moltiplicata per la tensione di vapore del liquido puro.
| P | = | Csolvent Po | ||||
| tensione di vapore del solvente sopra una soluzione |
tensione di vapore del solvente puro |
Questa equazione, nota come legge di Raoult, è di facile comprensione. Quando il solvente è puro e la frazione molare del solvente è uguale a 1, P è uguale a Po. Poiché la frazione molare del solvente si riduce , anche la pressione di vapore del solvente che fuoriesce dalla soluzione diventa più piccola.
Supponiamo, per il momento, che il solvente sia l’unico componente della soluzione che è abbastanza volatile da avere una pressione di vapore misurabile. Se questo è vero, la tensione di vapore della soluzione sarà uguale alla tensione di vapore del solvente che fuoriesce dalla soluzione. La legge di Raoult suggerisce che la differenza tra la tensione di vapore del solvente puro e la soluzione aumenta al diminuire della frazione molare del solvente.
La variazione della tensione di vapore che si verifica quando si aggiunge un solvente a un solvente è quindi una proprietà colligativa. Se dipende dalla frazione molare del soluto, allora deve dipendere dal rapporto tra il numero di particelle di soluto e solvente nella soluzione ma non dall’identità del soluto.
![]()
Elevazione del punto di ebollizione e depressione del punto di congelamento
La figura seguente mostra le conseguenze del fatto che i soliti abbassano la tensione di vapore di un solvente. i punti di collegamento della linea B e C in questo diagramma di fase contengono le combinazioni di temperatura e pressione alle quali il solvente puro e il suo vapore sono in equilibrio. Ogni punto su questa linea descrive quindi la tensione di vapore del solvente purissimo a quella temperatura. La linea tratteggiata in questa figura descrive le proprietà es di una soluzione ottenuta sciogliendo una soluzione assoluta nel solvente.A qualsiasi data temperatura, la pressione di vapore del solvente che fuoriesce dalla soluzione è inferiore alla pressione di vapore del solvente puro. La linea tratteggiata si trova quindi al di sotto della linea continua.
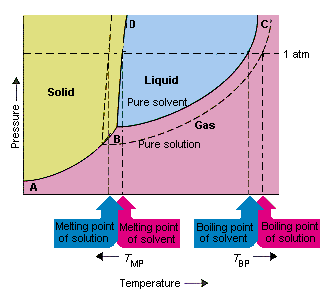
La diminuzione la tensione di vapore del solvente che si verifica quando un soluto viene aggiunto al solvente provoca un aumento del punto di ebollizione e una diminuzione del punto di fusione della soluzione.
Secondo questa figura, la soluzione non può “bollire alla stessa temperatura del solvente puro. Se la tensione di vapore di il solvente che fuoriesce dalla soluzione è inferiore alla pressione di vapore del solvente puro a una data temperatura, la soluzione deve essere riscaldata a una temperatura più alta prima che bolle L’abbassamento della tensione di vapore del solvente che si verifica quando viene utilizzato per formare una soluzione quindi aumenta il punto di ebollizione del liquido.
Quando sono stati introdotti i diagrammi di fase, il punto triplo è stato definito come l’unica combinazione di temperatura e pressione alla quale possono esistere contemporaneamente gas, liquido e solido. La figura sopra mostra che il punto triplo della soluzione si verifica a una temperatura inferiore al punto triplo del solvente puro. Di per sé, il cambiamento nel punto triplo non è importante. Ma si traduce in un cambiamento nella temperatura alla quale la soluzione si congela o si scioglie. Per capire perché, dobbiamo guardare con attenzione completamente sulla linea che separa le regioni solide e liquide nel diagramma di fase. Questa linea è quasi verticale perché il punto di fusione di una sostanza non è molto sensibile alla pressione.
L’aggiunta di un soluto a un solvente non cambia il modo in cui il punto di fusione dipende dalla pressione. La linea che separa le regioni solide e liquide della soluzione è quindi parallela alla linea che ha la stessa funzione per il solvente puro . Questa linea deve passare per il punto triplo per la soluzione, tuttavia. La diminuzione del punto triplo che si verifica quando un soluto viene disciolto in un solvente diminuisce quindi il punto di fusione della soluzione.
La figura sopra mostra come il la variazione della tensione di vapore che si verifica quando un soluto si dissolve in un solvente porta a cambiamenti anche nel punto di fusione e nel punto di ebollizione del solvente, poiché la variazione nella tensione di vapore è una proprietà colligativa, che dipende solo dal numero relativo di soluto e particelle di solvente , anche le variazioni del punto di ebollizione e del punto di fusione del solvente sono proprietà colligative.
![]()
Calcoli delle proprietà colligative
Il modo migliore per i demoni L’importanza delle proprietà colligative è esaminare le conseguenze della legge di Raoult. Raoult ha scoperto che la tensione di vapore del solvente che fuoriesce da una soluzione è proporzionale alla frazione molare del solvente.
P = CsolventPo
Ma la pressione di vapore di un solvente non è una proprietà colligativa. Tra le proprietà colligative di una soluzione può essere inclusa solo la variazione della tensione di vapore che si verifica quando un soluto viene aggiunto al solvente.
Poiché la pressione è una funzione di stato, la variazione della pressione di vapore del solvente che si verifica quando un soluto viene aggiunto al solvente può essere definita come la differenza tra la pressione di vapore del solvente puro e la tensione di vapore del solvente sfuggire alla soluzione.
P = Po – P
Sostituendo la legge di Raoult in questa equazione si ottiene il seguente risultato.
P = Po – Csolvent Po = (1 – Csolvent) Po
Questa equazione può essere semplificata ricordando la relazione tra la frazione molare del soluto e la frazione molare del solvente.
Csolute + Csolvent = 1
Sostituendola relazione nell’equazione che definisce Pgives un’altra forma della legge di Raoult.
P = CsolutePo
Questa equazione ci ricorda che la variazione della tensione di vapore del solvente che si verifica quando un soluto viene aggiunto al solvente è proporzionale alla frazione molare del soluto. Man mano che una quantità maggiore di solvente viene disciolta nel solvente, la tensione di vapore del solvente diminuisce e la variazione della pressione di vapore del solvente aumenta.
Poiché i cambiamenti nel punto di ebollizione del solvente (TBP) che si verificano quando un soluto viene aggiunto a un solvente risultano dai cambiamenti nella tensione di vapore del solvente, anche l’entità del cambiamento nel punto di ebollizione è proporzionale alla molefrazione del soluto.
![]() TBP = kbsolute
TBP = kbsolute
Nelle soluzioni diluite, la frazione molare del soluto è proporzionale alla molalità della soluzione, come mostrato in la figura sotto.

L’equazione che descrive l’entità dell’elevazione del punto di ebollizione che si verifica quando un soluto viene aggiunto a un solvente è quindi spesso scritta come segue.
![]() TBP = kbm
TBP = kbm
Qui, ![]() TBP è l’elevazione del punto di ebollizione – il cambiamento nel punto di ebollizione che si verifica quando un soluto si dissolve nel solvente
TBP è l’elevazione del punto di ebollizione – il cambiamento nel punto di ebollizione che si verifica quando un soluto si dissolve nel solvente ![]() e kb è una costante di proporzionalità nota come costante di elevazione del punto di ebollizione molale per il solvente.
e kb è una costante di proporzionalità nota come costante di elevazione del punto di ebollizione molale per il solvente.
Un’equazione simile può essere scritta per descrivere cosa accade al punto di congelamento (o punto di fusione) di un solvente quando un soluto viene aggiunto al solvente.
![]() TFP = -kfm
TFP = -kfm
In questa equazione, ![]() TFP è il punto di congelamento depressione
TFP è il punto di congelamento depressione ![]() la variazione del punto di congelamento che si verifica quando il soluto si dissolve nel solvente – e kf è la costante di depressione del punto di congelamento molale per il solvente. Un segno negativo viene utilizzato in questa equazione per indicare che il punto di congelamento del solvente diminuisce quando viene aggiunto un soluto.
la variazione del punto di congelamento che si verifica quando il soluto si dissolve nel solvente – e kf è la costante di depressione del punto di congelamento molale per il solvente. Un segno negativo viene utilizzato in questa equazione per indicare che il punto di congelamento del solvente diminuisce quando viene aggiunto un soluto.
I valori di kf e kbas così come i punti di congelamento e di ebollizione per un certo numero di solventi puri sono riportati nelle tabelle seguenti.
Costanti di depressione del punto di congelamento
Costanti di elevazione del punto di ebollizione
Problema pratico 6:
Calcola il peso molecolare dello zolfo se 35,5 grammi di zolfo si sciolgono in 100,0 grammi di CS2 per produrre una soluzione che abbia un punto di ebollizione di 49,48oC.
Fai clic qui per verificare la tua risposta al problema pratico 6
Fai clic qui per vedere una soluzione al problema pratico 6
Problema pratico 7:
Determina il peso molecolare dell’acido acetico se una soluzione che contiene 30,0 grammi di acido acetico per chilogrammo di acqua si congela a -0,93oC. Questi risultati concordano con l’ipotesi che l’acido acetico abbia la formula CH3CO2H?
Fai clic qui per verificare la tua risposta al problema pratico 7
Fai clic qui per vedere una soluzione al problema pratico 7
Cosa accadrebbe nel calcolo inPractice Problem 7 è stato ripetuto con un acido più forte, come l’acido cloridrico?
Problema pratico 8:
Spiega perché una soluzione di 0,100 m di HCl disciolta in benzene ha una depressione del punto di congelamento di 0,512oC, mentre una soluzione di 0,100 m di HCl in acqua ha una depressione del punto di congelamento di 0,352oC.
Fai clic qui per verificare la tua risposta al problema pratico 8
Nel 1884 Jacobus Henricus van “t Hoff ha introdotto un altro termine nelle espressioni di depressione del punto di congelamento e di elevazione del punto di ebollizione per spiegare le proprietà colligative delle soluzioni di composti che si dissociano quando si dissolvono in acqua.
![]() TFP = – kf (i) m
TFP = – kf (i) m
Sostituendo il valore sperimentale per la depressione del punto di congelamento di una soluzione di 0,100 m HCl in questa equazione si ottiene un valore per il termine i di 1,89. Se HCl non si dissocia in acqua, i sarebbe 1. Se si dissocia completamente, sarei 2. Il valore sperimentale di 1,89 suggerisce che almeno il 95% delle molecole di HCl si dissociano in questa soluzione.
Pratica Problema 9:
Spiega perché 0,60 grammi di acido acetico si dissolvono in 200 grammi di benzene per formare una soluzione che abbassa il punto di congelamento del benzene a 5,40 oC.
Fare clic qui per verificare la risposta a Problema pratico 9
![]()
Pressione osmotica
Nel 1784, il fisico e ecclesiastico francese Jean AntoineNollet scoprì che la vescica di un maiale piena di una soluzione concentrata di alcol in acqua si espandeva quando veniva immersa nell’acqua. La vescica ha agito come una membrana semipermeabile, che ha permesso alle molecole d’acqua di entrare nella soluzione, ma ha impedito alle molecole di alcol di muoversi nella direzione opposta. Il movimento di un componente di una soluzione attraverso una membrana per diluire la soluzione è chiamato osmosi, e la pressione che produce è chiamata pressione osmotica ().
La pressione osmotica può essere dimostrata con l’apparato mostrato nella figura sotto. Una membrana semipermeabile è legata all’estremità aperta di un tubo di cardo. Il tubo viene quindi riempito parzialmente con una soluzione di zucchero o alcool in acqua e immerso in un bicchiere d’acqua. L’acqua scorrerà nel tubo finché la pressione sulla colonna d’acqua dovuta alla forza di gravità non equilibra la pressione osmotica che guida l’acqua attraverso la membrana.

L’acqua scorre attraverso la membrana semipermeabile per diluire la soluzione alcolica fino a quando la forza di gravità che abbassa la colonna di questa soluzione bilancia la pressione osmotica spingendo l’acqua attraverso la membrana.
Lo stesso anno in cui Raoult scoprì la relazione tra la tensione di vapore di una soluzione e la tensione di vapore di un solvente purissimo, Jacobus Henricus van “t Hoff ha scoperto che la pressione osmotica di una soluzione diluita () obbediva a un’equazione analoga all’equazione del gas ideale.
| |
= | nRT | ||
| V |
Questa equazione suggerisce che la pressione osmotica è un altro esempio di una proprietà colligativa, perché questo la pressione dipende dal rapporto tra il numero di particelle di soluto e il volume della soluzione ![]() n / V
n / V ![]() non dall’identità delle particelle di soluto. ci ricorda anche l’entità della pressione osmotica Secondo questa equazione, a 1.00 M s oluzione ha una pressione osmotica di 22,4 atm a 0oC.
non dall’identità delle particelle di soluto. ci ricorda anche l’entità della pressione osmotica Secondo questa equazione, a 1.00 M s oluzione ha una pressione osmotica di 22,4 atm a 0oC.

Ciò significa che una soluzione di 1,00 M dovrebbe essere in grado di supportare una colonna d’acqua alta 670 pollici o quasi 56 piedi !
Biologi e biochimici spesso traggono vantaggio dalla pressione osmotica quando isolano i componenti di una cellula. Quando una cellula viene aggiunta a una soluzione acquosa che contiene una concentrazione di ioni molto più alta del liquido all’interno della cellula, l’acqua lascia la cellula scorrendo attraverso la membrana cellulare finché la cellula si restringe così tanto che la membrana si rompe. In alternativa, quando una cellula viene posta in una soluzione che ha una forza ionica molto più piccola, l’acqua si riversa nella cellula e la cellula si espande fino a quando la membrana cellulare esplode.
![]()