生理学の最前線
はじめに
動脈圧受容器は、血流中の血圧変化を検出する最前線のセンサーとして機能します。血圧の変化は、動脈壁に局在する機械感受性神経終末を刺激します。機械的な力は神経終末で電気信号に変換され、圧受容器ニューロンで圧力依存性の活動電位発火を引き起こします。次に、神経信号は、血圧の圧反射調節のために脳幹の心臓血管制御センターに伝播します(Levy MN、2007年)。さらに、中脳クネイフォーム核および腹側内側前頭前頭皮質を含む延髄上構造も、圧反射調節において抑制的役割を果たします(Verberne et al。、1997)。
2つの動脈圧受容器があります。大動脈弓と頸動脈のアドベンチティア層にそれぞれ位置する大動脈圧受容器と頸動脈圧受容器。大動脈圧受容器は、大動脈の血圧を検出します。大動脈圧受容器の細胞体(相馬)は、結節神経節(NG)にあります(図1)。大動脈圧受容器神経終末からの神経信号は、大動脈圧受容神経(ADN)と呼ばれる感覚神経を介して結節神経節に伝達されます(図1)。頸動脈圧受容器は、脳に血液を供給する頸動脈の血圧を検出します。頸動脈圧受容器の神経終末は、内頸動脈に近い頸動脈分岐部の両側に位置しています。頸動脈圧受容器からの神経信号は、頸動脈洞神経(CSN)に沿って、錐体神経節(PG)に局在する体細胞に伝わります。石油神経節は頸静脈孔を越えて突き出ています(図1)(マクドナルド、1983; Shoukas et al。、1991; Vander et al。、1998; Sato et al。、1999; Donnelly and Rigual、2000; Weijnen et al。、2000) 。大動脈圧受容器は、全身循環全体に血液を供給する大動脈内の血圧を感知するため、全身血圧の維持に重要な機能を果たすことが期待されています。一方、頸動脈圧受容器は、脳に送られている血液の圧力を検出します。これらの圧受容器は、安定した脳血圧と脳血流を維持するためにより重要である可能性があります。
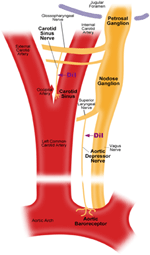
図1.大動脈および頸動脈圧受容器の末端と神経の概略図。大動脈および頸動脈圧受容器の神経終末、それらの神経線維および体細胞領域の解剖学的位置を示す図。大動脈圧受容器末端は大動脈弓にあります。その求心性神経線維は大動脈抑制神経です。相馬は結節神経節(NG)にあります。頸動脈圧受容器は、頸動脈分岐部の隣の内頸動脈に配置されます。その求心性神経は頸動脈洞神経です。体細胞は石油神経節(PG)にあります。
どの圧受容器、大動脈圧受容器、または頸動脈に関して矛盾する報告があります。圧受容器は、血圧の変化に対してより敏感です。一部の研究者は、頸動脈圧受容器が圧力に対してより敏感であると報告しましたが(Donald and Edis、1971; Fadel et al。、2003)、他の研究者は大動脈圧受容器が圧力に対してより敏感であると信じています(Glick and Covell、1968; Pickering et al。、 2008)、さらに他の人は、これら2つの圧受容器間の圧力感度に差がないことを報告しています(Hainswor et al。、1970; James and Daly、1970)。ただし、これらの以前の研究のほとんどすべては、圧受容器感度アッセイのエンドポイントとして圧反射反応(心拍数や腎交感神経活動など)のみを使用していました。大動脈圧受容器ニューロンと頸動脈圧受容器ニューロン自体の圧力感度を直接記録して比較する研究はまだありません。
ここでは、高速圧力クランプを使用して圧受容器ニューロン内の静水圧を変更し、測定しました。全細胞パッチクランプ法によるこれらのニューロンの対応する電気生理学的応答。また、一軸ストレッチチャンバーを使用して圧受容器ニューロンをストレッチし、これらのニューロンの細胞質ゾルCa2 +の対応する変化を測定しました。さらに、in vivo動物実験では、大動脈圧受容器と頸動脈圧受容器の感覚神経である大動脈圧受容器と頸動脈洞神経の圧力誘発活動電位発火を測定しました。
材料と方法
動物
すべての動物実験は、香港特別行政区政府が発行したライセンスの権限と、中国香港大学の動物実験倫理委員会の承認の下で実施されました。オスのSprague-Dawley(S / D)ラット(180〜200 g)は、香港中文大学の実験動物サービスセンターから提供されました。
初代培養
S / Dラットをペントバルビタールナトリウム(100mg / kg)で麻酔した。左頸部は、滅菌条件下で正中切開により露出された。図1に示すように、大動脈抑制神経または頸動脈洞神経が露出し、鈍的切開によって神経の2〜3mmが周囲の組織から注意深く切り離されました。蛍光親油性トレーサー1,1-ジオクタデシル-3,3,3 ‘、3’-テトラメチルインドカルボシアニン(DiI)結晶(Invitrogen)を神経の周りに塗布し、Kwik-Sil(World Precision Instruments、USA)で覆った。その後、切開部を縫合した。ラットを5〜7日間回復させて、DiI色素が大動脈抑制神経または頸動脈洞神経に沿って逆行性に拡散し、それぞれ結節神経節または石油神経節にある体細胞に到達しました。
結節神経節または石油神経節ニューロンはDiI標識ラットから分離され、氷冷EBSSで細かく切断されました。それらをトリプシン(1mg / ml)およびコラゲナーゼIA(1mg / ml)で37℃で1時間消化した。 Glass Pasteurピペットによる穏やかな粉砕とそれに続く遠心分離により、単一ニューロンを分散させた。ニューロンを再懸濁し、5%FBS、1%抗生物質-抗真菌剤および7S NGF(100 ng / ml)を添加したDMEM / F-12培地で培養しました。シトシンアラビノフラノシド(Ara-C;10μM)は、分裂中の細胞の増殖を阻害するために培地に含まれていました。ニューロンは実験前に少なくとも3日間培養されました。活動電位を記録するために、ニューロンを新たに分離し、実験の少なくとも30分前にF12でインキュベートしました。シリコンチャンバーが2%ゼラチンでプレコートされた細胞伸長実験を除いて、すべての実験で、細胞は0.1 mg / mlポリ-L-リジンでプレコートされたスライドガラス上でインキュベートされました。
パッチクランプ
全細胞電流クランプ記録は、EPC7パッチクランプ増幅器(HEKA、ドイツ)によって達成されました。抵抗が3〜5MΩのパッチピペットにピペット溶液(mM)を充填しました:KOHにより、130 K-グルコン酸塩、10 KCl、2 MgCl2、2 Na2ATP、0.4 Tris GTP、1 EGTA、10 HEPES、pH7.25-7.3。細胞を人工脳脊髄液(ACSF)(mM)に浸しました:120 NaCl、2 KCl、1.2 MgSO4・7H2O、1.2 KH2PO4、26 NaHCO3、2.5 CaCl2、11グルコース、カルボゲン(95%O2および5 %CO2)。電流クランプ記録では、細胞は静止膜電位に保たれていました。高速圧力クランプシステム(HSPC-1、ALA Scientific Instruments、USA)を使用して、マイクロピペットを介してセルに陽圧を供給しました。録音は50kHzでサンプリングされ、5kHzでフィルタリングされました。データはPulseFit(HEKA)で分析されました。すべての実験は室温で実施されました。
カルシウムイメージング
サイトゾルCa2 +測定は、他の場所で説明されているように実施されました(Wong et al。、2010)。簡単に説明すると、細胞に5μMのFluo-4 / AMを40分間ロードしました。サイトゾルCa2 +測定は、HEPES緩衝液(mM)を使用して実施しました:140 NaCl、2.5 KCl、1 MgCl2、1 CaCl2、10 HEPES、10グルコース、NaOHによるpH7.4。一軸伸長に応答したサイトゾルCa2 +変化は、STREX Cell Stretching System(ST-150、B-Bridge International、Inc。)を使用して実行されました。細胞は、10、20、または30%の一方向ストレッチによって1秒間刺激されました。サイトゾルCa2 +応答は室温で測定された。 Fluo-4の蛍光は、FV1000レーザー走査型共焦点イメージングシステムによって記録および分析されました。サイトゾルCa2 +蛍光応答の変化は、リアルタイム蛍光の比率(Fx / F0)として表されました。ここで、Fxはリアルタイムfluo-4 / AMシグナルであり、F0はストレッチ前のベースラインfluo-4 / AMシグナルです。
神経活動の記録
ラットを100mg / kgのペントバルビタールナトリウムで麻酔しました。頸部は正中切開により露出した。血圧を記録するために、圧力変換器(ML221、ADInstruments、USA)に接続されたカテーテルによって右頸動脈を分離し、カニューレを挿入しました。フェニレフリンおよびSNP注射のために左大腿静脈にカニューレを挿入した。左大動脈抑制神経または頸動脈洞神経を双極銀電極に接続し、続いて増幅器(モデル1700差動AC増幅器、A-M Systems Inc.、米国)を接続しました。血圧と神経活動の両方がチャート5.0(AD Instruments)によって継続的に記録されました。神経活動は10,000倍に増幅され、100〜5000Hzのバンドパスでフィルタリングされました。フェニレフリンに反応した平均動脈圧、心拍数、スパイク頻度の値は、Chart5.0ソフトウェアによって分析されました。フェニレフリン注射時の最大血圧変化(フェニレフリン後の平均動脈圧-フェニレフリン前の平均動脈圧)に応じたスパイク頻度(フェニレフリン後のスパイク頻度-フェニレフリン前のスパイク頻度)の変化を計算しました(Lau et al。、2016) 。
統計分析
代表的なトレースは、時間経過のトレースとしてプロットされました。すべての実験からのデータは、個々の実験の平均±semで表された棒グラフに要約されました。統計分析にはスチューデントのt検定を使用しました。必要に応じてペアワイズt検定を使用しました。
結果
大動脈抑制ニューロンと頸動脈洞ニューロンの特性
Dilは、大動脈抑制神経または頸動脈洞神経のいずれかに適用されたため、結節神経節のDil標識ニューロンには、大動脈弓を神経支配する圧受容器ニューロンと大動脈体を神経支配する化学受容体ニューロンが含まれていました。石油神経節には、頸動脈洞を神経支配する圧受容器ニューロンと頸動脈体を神経支配する化学受容体ニューロンが含まれていました。最初に、これらのDil標識ニューロンの基本的な特性を調査しました。結節と石油神経節のDiI標識ニューロンを別々に培養し、脱分極電流にさらしました。図2に示すように、2種類の応答が記録されました。1つは単一の作用電位で応答し、もう1つは脱分極電流後の連続作用電位で応答しました(図2)(Belmonte and Gallego、1983)。これらのニューロンは、静水圧の変化に対する感度をテストするために、その後静水圧プロトコルにかけられました。活動電位が誘発されるまで、高速圧力クランプシステム(HSPC-1、ALA Scientific Instruments、USA)により、ガラス製マイクロピペットを介して細胞内に正の静水圧ランプを適用しました。結果は、大動脈圧受容器ニューロンの45%が脱分極電流に応答して連続活動電位を発火したことを示しました(表1A)。その中で、91%(41%/ 45%)も静水圧の変化に反応し、圧力依存の活動電位発火を示しました(表1A)。大動脈圧受容器ニューロンの残りの55%は、脱分極電流に応答して単一の活動電位のみを発火し(表1A)、そのうち40%(22%/ 55%)は圧力変化に応答できました(表1A)。頸動脈圧受容器ニューロンの場合、細胞の45%は、脱分極電流によって刺激されたときに継続的な活動電位を示しました(表1B)。その中で、82%(37%/ 45%)も圧力変化に敏感でした(表1B)。さらに、脱分極電流に応答して単一の活動電位のみを発火した頸動脈圧受容器ニューロンのうち、24%(13%/ 55%)が圧力変化に応答できました(表1B)。
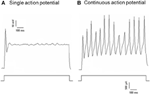
図2.培養大動脈圧受容器および頸動脈洞ニューロンからの活動電位記録。示されているのは、脱分極電流の際に2つの代表的な大動脈抑制剤/頸動脈洞ニューロンから記録された活動電位の痕跡です。 (A)現在の刺激で単一の活動電位のみを発火させる代表的なニューロン。 (B)現在の刺激で継続的な活動電位のみを発火させる代表的なニューロン。下のパネル:電流注入のプロトコル。スケールバー、水平、100 ms、垂直、10 mV(上のトレース)、および500 pA(下のトレース)。大動脈圧受容器ニューロンと頸動脈洞ニューロンの場合、それぞれn = 27とn = 38です。

表1.大動脈圧受容器と頸動脈洞ニューロンの特性。
単一の作用電位または連続作用電位のどちらを発火したかに関係なく、Dil標識大動脈圧受容器ニューロンの63%が圧力変化に敏感であるのに対し、Dil標識頸動脈圧受容器ニューロンの50%のみが圧力変化(表1)。
大動脈圧受容器ニューロンと頸動脈圧受容器ニューロンのストレッチ感度
作用電位放電の圧力しきい値を分析しました。図3に示すように、大動脈圧受容器ニューロンの圧力しきい値は、頸動脈圧受容器ニューロンの圧力しきい値(39±4 mmHg)よりも低かった(24±4 mmHg)。

図3.静水圧に対する大動脈圧受容器ニューロンと頸動脈圧受容器ニューロンの感度。 (A、B)上のパネル、大動脈(A)および頸動脈(B)圧受容器ニューロンにおける圧力依存性活動電位発火を示す代表的な時間経過トレース。圧力ランプ(下のパネル)は、高速圧力クランプシステム(HSPC)を使用してマイクロピペットを介してセルの内部に適用されました。スケールバー水平、1秒、垂直、20mVおよび20mmHg。 (C)大動脈および頸動脈圧受容器ニューロンの活動電位発火を開始する圧力閾値を示す要約。大動脈圧受容器ニューロンの場合はn = 13、頸動脈圧受容器ニューロンの場合はn = 15。 *** p < 0.01、スチューデントのt検定による。
圧受容器ニューロンにおける伸展誘発性Ca2 +応答
培養大動脈抑制因子または頸動脈洞ニューロンがSTREX Cell Stretching Systemによる一軸ストレッチの10、20、または30%。血圧下での血管ストレッチを模倣しようとします。結果は、20%の一軸ストレッチが大動脈圧受容器ニューロンでは細胞質ゾルCa2 +蛍光の顕著な増加を誘発したが、頸動脈圧受容器ニューロンでは誘発しなかったことを示した(図4A–C)。さらに、30%の一軸伸長に応答して上昇するCa2 +蛍光の大きさは、頸動脈圧受容器ニューロンよりも大動脈圧受容器ニューロンの方がはるかに高かった(図4A–C)。
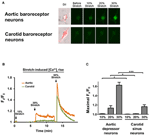
図4.一軸伸展に対する大動脈圧受容器と頸動脈洞ニューロンの感度。細胞にCa2 +感受性蛍光色素Fluo-4 / AMをロードしました。示されているのは、大動脈抑制因子および頸動脈洞ニューロンにおける細胞長の10、20、および30%の一軸伸長に応答して上昇する相対的な細胞質ゾルCa2 +の代表的な画像(A)および経時的トレース(B)です。 (C)異なる程度の伸長に応答した最大の細胞質ゾルCa2 +上昇の要約。サイトゾルCa2 +の変化は、Fx / F0として表されました。ここで、Fxはリアルタイムのfluo-4 / AMシグナルであり、F0はストレッチ前のベースラインfluo-4 / AMシグナルです。平均値±s.e.m。 (n = 5)。 * p < 0.05、*** p < 0.01、対応するコントロールと比較、ペアワイズt検定による。
invivoでの圧受容器の神経活動
2つの圧受容器の神経活動をinvivoで調査しました。フェニレフリンを静脈内注射した。フェニレフリン適用時の血圧の変化は、図5A、Bの上部パネルに示されています。圧受容器神経活動のサブシーケンスの変化は、下のパネルに示されています(図5A、B)。圧力誘発神経活動は、頸動脈洞神経よりも大動脈抑制神経の方がはるかに高かった(図5A、B)。 mmHgの増加あたりのスパイク周波数の変化を図5Cに要約します。結果は、大動脈圧受容器が生体内の頸動脈圧受容器よりも静水圧に敏感であることを示しました。
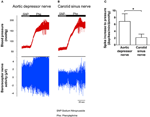
図5.invivoでのラットの圧受容器神経活動。 (A、B)血圧上昇時の大動脈抑制神経(A)および頸動脈洞神経(B)の活動の変化を示す代表的なトレース。両方の(A、B)で、上のパネルは、水平バーで示されているように、Phe適用前後の血圧の変化でした。下のパネルは、神経活動の対応する変化でした。 (C)単位血圧変化あたりの神経活動の変化を示す要約データ。平均値±s.e.m。 (n = 8)。 * p < 0.05、大動脈圧受容器のコントロールと比較、ペアワイズt検定による。
TRPチャネルの発現
TRPC1、-C3、-C5、-C6、-V1、-V4、-P2(O)など、いくつかのTRPチャネルは機械的感受性があると報告されています。 “Neil and Heller、2005; Christensen and Corey、2007; Pedersen and Nilius、2007; Patel et al。、2010; Lau et al。、2016)。ここでは、大動脈との関係におけるこれらの機械感受性TRPチャネルの可能な役割を調査しました。結節およびペトロサル神経節におけるこれらのチャネルのmRNA発現を比較した。TRPV4およびTRPC6の発現は、ペトロサル神経節と比較して結節神経節でより高いことが見出された(図6)。結節神経節における機械感受性チャネルの発現は、より高い感度に寄与する可能性があります。
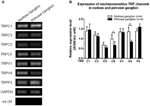
図6.の表現結節および石油神経節における機械感受性TRPチャネル。 (A)節状神経節ニューロンと石油神経節ニューロンの間の機械感受性TRPチャネル(TRPC1、-C3、-C5、-C6、-V1、-V4、-P2)のmRNA発現レベルを比較する代表的なゲル画像。半定量的RT-PCR分析を使用して、GAPDHmRNA発現と比較したいくつかのTRPチャネルのmRNA発現レベルを比較しました。 9回の実験結果を(B)にまとめた。値は平均±semでした。 * p < 0.05、ペアワイズt検定による。
ディスカッション
本研究では、大動脈圧受容器と頸動脈圧受容器の機械的感受性を比較しました。全細胞パッチクランプ研究は、頸動脈洞ニューロンと比較して、より高い割合の大動脈抑制ニューロンがストレッチ感受性であったことを示した。さらに、活動電位発火を開始する可能性のある圧力閾値は、頸動脈圧受容器ニューロンよりも大動脈圧受容器ニューロンの方が低いことがわかった。一軸伸展誘発性の細胞質ゾルCa2 +上昇も、大動脈抑制剤と頸動脈洞ニューロンの間で比較された。一軸伸長に応答したサイトゾルCa2 +上昇の大きさは、頸動脈圧受容器ニューロンよりも大動脈圧受容器ニューロンの方がはるかに高かった。大動脈圧受容器ニューロンはまた、一軸伸展に対する細胞質ゾルCa2 +応答のより低い閾値を示した。別の一連の実験では、活動電位発火の圧力誘発性の増加は、頸動脈洞神経よりも大動脈抑制神経の方が高かったことがわかりました。まとめると、私たちのデータは、大動脈圧受容器が頸動脈圧受容器よりも血圧に敏感であるという強力な証拠を提供します。
以前は、2つの圧受容器の感度の違いを理解するために多くの努力が払われてきました。ただし、結果は物議を醸しています。一部の報告では、大動脈圧受容器は圧力変化に対してより敏感であると結論付けていますが(Glick and Covell、1968; Fan et al。、1996; Pickering et al。、2008)、他の報告では頸動脈圧受容器は圧力変化に対してより敏感であると述べています(DonaldおよびEdis、1971; Fadel et al。、2003)。ただし、これらの以前の研究のほとんどすべては、非常に複雑な外科的処置を含み、最終的には、圧受容器感度アッセイのエンドポイントとして、心拍数や腎交感神経出力などの圧反射反応を利用していました。複雑な外科的処置は実験誤差をもたらす傾向があり、物議を醸す結論をもたらす可能性があります。さらに、圧受容器感受性の動物種依存性変動も可能です。さらに、圧反射反応は、圧受容器の感度だけでなく、神経伝導、中枢媒介、血管収縮性、心臓機能などの他の複数の要因によっても影響を受けます。したがって、以前の研究からの証拠は間接的であり、ほとんど理想的ではありません。現在まで、大動脈弁狭窄症ニューロンと頸動脈圧受容器ニューロンの圧力感受性を比較する直接的な研究は不足しています。この研究では、機械的感受性が圧受容器ニューロンで直接研究されました。データは、大動脈圧受容器が頸動脈圧受容器よりも圧力に敏感であることを強く示唆しています。この情報は、血圧調節に重要な生理学的関連性がある可能性があります。
大動脈圧受容器と頸動脈圧受容器の圧力感受性の違いの根底にあるメカニズムは不明です。いくつかの機械感受性TRPチャネルの発現レベルを比較しました(図6)(O “Neil and Heller、2005; Christensen and Corey、2007; Pedersen and Nilius、2007; Patel et al。、2010)。我々の結果は、大動脈圧受容器ニューロンがTRPV4およびTRPC6を含むいくつかの機械感受性TRPチャネルの発現が高い。TRPV4および/またはTRPC6の発現が高いと、大動脈圧受容器の高圧感受性に寄与する可能性がある。これらのイオンチャネルの役割を検証するには、さらなる研究が必要である。
結節神経節と石油神経節には2種類のニューロンが含まれていることが以前に報告されました(Belmonte and Gallego、1983)。一方は電気刺激時に連続作用電位を与え、もう一方は単一作用を与えるだけです。著者らは、前者を感圧ニューロンとして割り当て、後者を化学感受性ニューロンとして割り当てました。我々の結果は、それが適切ではない可能性があることを示しています。脱分極電流に応答して、単一活動電位または連続活動電位のどちらを発火するかに基づいて、感圧ニューロンと感圧ニューロンを割り当てる必要があります。実際、電気刺激に応答して単一の活動電位を発する細胞の大部分は圧力にも敏感であるため、それらは圧力感知圧受容器ニューロンに属します(図2および表1)。
要約すると、本研究は、大動脈圧受容器が頸動脈圧受容器よりも圧力に敏感であるという証拠を提供し、基本的な生理学の理解に新しい情報を追加します。
著者の貢献
EL XYは実験を設計し、原稿をドラフトします。 EL、CL、およびYYが実験を実行します。 XY、YH、AM、LJが原稿を改訂しました。すべての著者が原稿の最終版を承認しました。
資金提供
この作品は、香港研究助成委員会CUHK478710、CUHK478413、AoE / M-05 / 12からの助成金によってサポートされました。 TBRS / T13-706 / 11、中国国立科学財団助成金31470912およびRGC-NSFC共同助成金N_CUHK439 / 13。
利益相反声明
著者は、研究が実施されたことを宣言します。潜在的な利益相反と解釈される可能性のある商業的または金銭的関係がない場合。
James、JEA、およびDaly、MDB(1970)。犬の拍動性および非拍動性圧力による頸動脈洞および大動脈弓圧受容器の個別および複合刺激に対する反射性血管運動反応の比較。 J.Physiol。 209、257〜293。土井:10.1113 /jphysiol.1970。sp009165
PubMed要約| CrossRef全文| Google Scholar
Levy MN、P。A.(2007)。 循環器系の生理学。 ペンシルベニア州フィラデルフィア:モスビーエルゼビア。
Vander、A。J.、Sherman、J。H.、およびLuciano、D。S.(1998)。 人類生理学:身体機能のメカニズム。 マサチューセッツ州ボストン:WCBMcGraw-Hill。