シクロヘキサン分子
シクロヘキサンは、分子式C6H12のシクロアルカンです。シクロヘキサンは、化学工業の無極性溶媒として、またナイロンの製造に使用される中間体であるアジピン酸とカプロラクタムの工業生産の原料として使用されています。工業規模では、シクロヘキサンはベンゼンを水素と反応させることによって生成されます。シクロヘキサンは、その独特の化学的および立体配座特性により、ラボでの分析や標準としても使用されます。
Jsmolを使用したシクロヘキサン分子-3D構造については、
シクロヘキサンの構造を参照してください。分子
6つの頂点を持つリングは、完全な六角形の形状に適合していません。平らな2D平面六角形の立体配座は、その結合が109.5度ではないため、かなりの角度ひずみがあります。すべての重なり型結合のため、ねじれひずみもかなり大きくなります。したがって、ねじりひずみを低減するために、シクロヘキサンは椅子の立体配座として知られる三次元構造を採用しています。新しいコンフォメーションは、炭素を109.5°の角度に配置します。水素の半分はリングの平面(赤道)にあり、残りの半分は平面に垂直(軸)です。このコンフォメーションにより、シクロヘキサンの最も安定した構造が可能になります。ボートの立体配座として知られるシクロヘキサンの別の立体配座が存在しますが、それはわずかにより安定した椅子の形成に相互変換します。シクロヘキサンが大きな置換基で一置換されている場合、これはわずかに安定したコンフォメーションであるため、置換基は赤道位置に結合していることがわかります。
シクロヘキサンの角度とねじれひずみはすべてのシクロアルカン、その結果、シクロヘキサンは、角度とねじりひずみの組み合わせである総環ひずみが0と見なされています。これにより、シクロヘキサンはシクロアルカンの中で最も安定しているため、他のシクロアルカンと比較して、燃焼時に発生する熱量が最小になります。
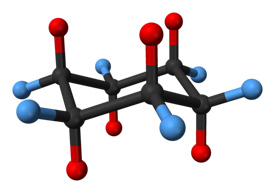
チェアコンフォメーションのシクロヘキサン分子。軸方向の位置にある水素原子は赤で示され、赤道方向の位置にある水素原子は青で示されています。
シクロヘキサンとの反応
純粋なシクロヘキサン自体はかなり非反応性であり、非極性です。疎水性炭化水素。超酸系HF + SbF5などの非常に強い酸と反応して、強制プロトン化と「炭化水素クラッキング」を引き起こす可能性があります。ただし、置換シクロヘキサンはさまざまな条件下で反応する可能性があり、その多くは有機化学にとって重要です。シクロヘキサンは非常に可燃性です。
シクロヘキサン誘導体
シクロヘキサン誘導体、実際にはほとんどのシクロアルカン分子における官能基の特定の配置は、化学反応、特に求核試薬が関与する反応において非常に重要です。リング上の置換基は、他の分子と反応するために軸方向に形成されている必要があります。たとえば、ブロモシクロヘキサンと一般的な求核試薬である水酸化物アニオンとの反応により、シクロヘキセンが生成されます。
この反応は、一般に脱離反応または脱ハロゲン化(具体的にはE2)として知られ、臭素置換基が軸方向の形成では、反応する別の軸方向のH原子に対抗します。ブロモシクロヘキサンが反応するのに適切な形成状態にあると仮定すると、E2反応は次のように開始されます。
- C-Br間の電子対結合がBrに移動し、Brを形成して設定します。シクロヘキサンを含まない
- 求核試薬(-OH)は、隣接する軸方向のHに電子対を与え、Hを自由に設定し、それに結合してH2Oを生成します。
- 隣接する軸間の電子対結合軸方向のHは、2つのCC間の結合に移動し、C = Cになります。
注:3つのステップはすべて同時に発生し、すべてのE2反応の特徴です。
上記の反応主にE2反応を生成し、その結果、生成物は主に(〜70%)シクロヘキセンになります。ただし、パーセンテージは条件によって異なり、通常、2つの異なる反応(E2とSn2)が競合します。上記の反応では、Sn2反応は代わりにヒドロキシル(OH-)基の代わりに臭素を使用しますが、ここでも、Brは反応するために軸方向にある必要があります。 SN2置換が完了すると、新しく置換されたOH基はより安定した赤道位置にすばやく(約1ミリ秒)戻ります。用途
商業的に生成されたシクロヘキサンのほとんどは、触媒作用によってシクロヘキサノン-シクロヘキサノール混合物に変換されます。酸化。その後、KAオイルはアジピン酸とカプロラクタムの原料として使用されます。実際には、KAオイルのシクロヘキサノール含有量がシクロヘキサノンよりも高い場合、アジピン酸に変換される可能性が高く(経済的)、逆の場合、カプロラクタムが生成される可能性が高くなります。 KA油におけるそのような比率は、適切な酸化触媒を選択することによって制御することができる。シクロヘキサンの一部は有機溶媒として使用されます。
研究中のシクロヘキサン
この環状炭化水素についてはすでに多くのことが知られていますが、照射時の混合物の水素収率を決定するために、シクロヘキサンとベンゼンの混合物および固相シクロヘキサンについて研究が行われています。 195°Cで。
歴史
ベンゼンのような化合物とは異なり、シクロヘキサンは石炭などの天然資源から簡単に入手することはできません。 19世紀の終わりに向けて、初期の化学研究者は有機合成に依存しなければなりませんでした。詳細を具体化するのに30年かかりました。 1867年、マルセランベルテロは、高温でヨウ化水素酸を用いてベンゼンを還元しました。彼は、沸点(69°C)が便利に一致しているだけでなく、ベンゼンが環状分子(現代のアウグストケクレのように)であるとは考えていなかったため、反応生成物をn-ヘキサンとして誤って識別しました。アセチレンの。 1870年に彼の懐疑論者の1人であるアドルフフォンバイヤーが反応を繰り返し、同じ反応生成物であるヘキサヒドロベンゼンを発音し、1890年にウラジミールマルコフニコフはコーカサス石油から同じ化合物を蒸留して調合ヘキサナフテンと呼ぶことができると信じました
1894年にバイヤーピメリン酸のディークマン縮合で始まり、複数の還元が続く合成シクロヘキサン。そして同じ年にE.ハワースとW.H. Perkin Jr.(1860-1929)は、1,6-ジブロモヘキサンのウルツ反応でも同じことをしました。驚くべきことに、それらのシクロヘキサンは、ヘキサヒドロベンゼンまたはヘキサナフテンよりも10°C高く沸騰しましたが、この謎は1895年にマルコフニコフ、NMキシュナー、ニコライによって解決されました。 Zelinskyがヘキサヒドロベンゼンとヘキサナフテンをメチルシクロペンタンと再診断したとき、予期しない転位反応の結果でした。