免疫学の最前線
はじめに
子癇前症は、すべての妊娠の3〜5%に影響を与える妊娠特有の疾患です(1、2)。それは、妊娠20週後の新たに発症した高血圧とタンパク尿を示します。胎盤は、母親を胎児に接続することにより、病気の病因の中心です(3)。母体と胎児の境界面は、胎児由来の遺伝的に異なる組織が母体の循環、内皮、および免疫系と出会うゾーンです。しばしば理論の病気と呼ばれる、一般的に受け入れられている洞察の1つは、子癇前症が母体の内皮に影響を及ぼし、内皮の機能に障害を引き起こし、高血圧とタンパク尿を引き起こすというものです(2)。その重症型では、子癇前症は胎児の成長遅延、未熟児につながる可能性があり、母親にとっては子癇だけでなく腎臓や肝臓の臓器不全を引き起こす可能性があります。さらに、子癇前症は、母親と新生児に長期的な心血管系の悪影響をもたらす可能性があります(4)。胎盤の発達は、特に母体のらせん状動脈の形質転換の過程では不十分であると考えられており、栄養膜細胞が母体側に侵入して脱落膜になり、動脈を低抵抗の導管に変換し、母体の内皮も置き換えます(5–7)。通常、この子宮動脈のリモデリングは、特に重度の子癇前症では見られないか、不完全です。狭窄した子宮動脈の高い抵抗は、胎盤の絨毛間腔への乱流の血流を引き起こし、酸化ストレスおよび胎盤絨毛樹への機械的損傷を引き起こす。結果として生じる損傷は、微粒子および炎症性メディエーターの胎盤脱落を増加させ、一般的な内皮の活性化および機能不全をもたらす(8、9)。母体と胎児の境界面におけるこれらの連続したイベントは、上記のように母体の高血圧やその他の症状を引き起こします。
HELLP症候群は、1982年にWeinsteinによって別の症候群として最初に特徴づけられ、子癇前症と一緒に現れることがよくありますが、単独でも見られます(10、11)。 HELLP症候群は、溶血、肝酵素の上昇、血小板減少を特徴としています。多くの場合、集中治療レベルの観察と対症療法が必要です。症候群の病因はまだ影になっています。 HELLP症候群は、血栓性血小板減少性紫斑病(TTP)や溶血性尿毒症症候群(HUS)などの血栓性微小血管症(TMA)と共通の特徴を共有しています。 TMAは、微小血管障害性溶血、血小板減少症、および微小血栓に起因する臓器損傷の共通の特徴を持つさまざまなグループの疾患に存在します。 TTPでは、血栓性血小板減少症1型モチーフ13(ADAMTS13)を伴うディスインテグリンおよびメタロプロテイナーゼに対する自己抗体の遺伝的欠陥、または大多数の場合と同様に、活性化フォンウィルブランド因子(vWF)を切断する酵素が異常に大きな形成を引き起こします内皮細胞上の活性化されたvWF多量体は、小血管内の血小板血栓と溶血を引き起こします。典型的なHUSは、志賀毒素産生細菌感染症(特に大腸菌)によって引き起こされますが、非定型HUS(aHUS)は、補体系の代替経路の調節因子の遺伝的欠陥が根底にあるTMAのタイプを指します。トリガーの発生は臨床疾患を引き起こす可能性があります(12、13)。 FDAが承認したaHUSの治療法は、補体C5拮抗薬エクリズマブの注入であり、膜侵襲複合体(MAC)の形成を防ぎます(図1)。臨床的にHELLPは、古典的なTMAと同じ症状を共有します:溶血、血小板減少症、および肝臓で見られる臓器障害。使用されるTMA分類に応じて、HELLP症候群は通常二次または後天性TMAの一部として分類されます(表1)。
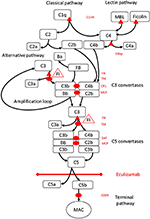
図1.エクリズマブは補体活性化の最終経路を阻害します。補体活性化は、活性化の3つの経路を介して開始することができ、それらはすべて、標的表面でのMACの形成につながる末端経路を活性化する能力を有するC5コンバターゼの形成につながる。補体系のこの概略図は、最も関連性の高い活性化因子(黒のフォント)と阻害剤(赤)を示しています。活性剤は、膜結合型(楕円形)または可溶性(三角形)であり得る。代替経路は、可溶性レギュレーター因子H(FH)による阻害を可能にしないすべての表面で自発的に活性化します。 FHは、因子I(FI)によるC3bからiC3bへの不活性化の補因子として機能します。トロンボモジュリン(TM)はFH補因子活性を増強します。切断された因子B(FB)は、活性化因子C3bとともに代替経路転換酵素を形成し、これはC3をC3bに切断して、代替経路活性化の増幅ループを作成する能力を持っています。補体活性化の古典的経路は、例えば免疫複合体のC1qへの結合によって開始され、レクチン経路は、マンノース結合レクチン(MBL)またはフィコリンが例えば微生物上の炭水化物のパターンに結合することによって活性化されます。レクチン経路の活性化により、マンノース関連セリンプロテアーゼ1および2(MASP-1およびMASP-2、写真にはありません)が補体成分C4およびC2を切断して、古典的経路転換酵素C4bC2bを形成します。 C1阻害剤(C1inh)とC4bpは古典的経路の可溶性調節因子であり、膜補因子タンパク質(MCP)と補体受容体1(CR1)は初期補体経路の膜結合調節因子です。 C5コンバターゼの形成は、表面に結合したレギュレーターの崩壊促進因子(DAF)およびMCPの非存在下で、補体活性化およびC5の切断の最終経路を開始します。 MACの組み立ては、表面結合レギュレーターCD59(プロテクチン)によって制御されます。初期経路でのC3と終末経路でのC5の切断は、アナフィラトキシンC3aとC5aを放出し、炎症を引き起こします。エクリズマブは、補体タンパク質C5に対するヒト化組換え抗体であり、C5コンバターゼによるC5の切断を阻害し、それによって補体活性化の血栓形成促進作用および炎症誘発作用を調節します。この症例報告に記載されている患者は、H因子(CFH)、FHR5、MCP、CFI、CFB、THBD、および凝固カスケードのvWF経路の調節因子であるADAMTS13(ADAMTS13)をコードする遺伝子の遺伝子変異についてテストされました(示されている)。遺伝子検査の結果は陰性でした。

表1.HELLPおよびaHUSの診断基準。
このケーススタディでは、複雑な妊娠誘発性TMAと治療の成功したコースを持つ患者。
症例提示
29歳の初産婦は妊娠34 + 2歳でヘルシンキ大学病院に紹介されました。上腹部の痛みを伴う外来診療。当初、彼女の血圧は適度に上昇し(133/91 mmHg)、尿試験紙はタンパク質陽性でした。最初に報告された上腹部の痛みは徐々に改善していました。超音波スキャンでは、胎児は正常な生物物理学的プロファイル(BPP)を示し、体重の推定値は-2SD成長曲線でした。心臓トコグラフィー(CTG)は正常でした。血中ヘモグロビン(Hb)は115 g / L、血小板は158 E9 / L(正常範囲150〜360 E9 / L)、アラニンアミノトランスフェラーゼ(ALT)は正常(23 U / L)でした。尿試験紙はタンパク質に対して陽性(+2)であり、計算されたタンパク尿は1.6 g / 24時間でした。赤ちゃんの肺の成熟を促進するためにコルチゾン治療を開始することが決定されました。患者は、コントロールチェックとコルチゾンの2回目の投与のために翌日戻る計画で退院しました。予定通り、彼女は妊娠週34 +4にコントロールのために来ました。血圧は147 / 87mmHg、ALT 23、血小板177、CTGであり、超音波スキャンでの胎児のBPPは正常でした。彼女は退院し、別の検査が予定されていました。同日の午後、上腹部の痛みが再発し、夕方になると着実に悪化した。彼女は午前2時20分に病院に戻った。彼女はきつい上腹部の痛みと落ち着きのなさを経験しており、2回嘔吐し、震えを感じていた。血圧は170 / 94mmHgで明らかに上昇し、尿タンパク尿試験紙は強く陽性であり、ALTは159、Hb 122、血小板172で上昇しました。彼女は出生前病棟に入院しました。午前4時に彼女は頭痛を経験していました。降圧薬を開始しました(ラベタロール100mgを3回)。尿タンパク排泄は、13 g / 24時間の夜にピークに達しました。その後、彼女は嘔吐を開始し、上腹部の痛み、頭痛があり、CTGモニタリングは減速を示した。患者は午前7時11分に分娩病棟に移送され、子宮頸部が3センチメートル拡張したため、陣痛誘発のために胎児の膜が人為的に破壊された。同時に、Hb 122、血小板172を使用して臨床検査が完了しました。ただし、この時点で乳酸デヒドロゲナーゼ(LD)は1231 U / Lで明らかに上昇していました。 CTGでは、減速が続き、徐脈が続くと緊急帝王切開が行われました。男性の乳児(1960 g、-2 SD)は、午前7時25分に生まれ、臍帯動脈のpH値は7.05、BE -6.80、アプガー1/6/8でした。手術での失血は400mlでした。
帝王切開後の午前9時、母親の血小板は49で低く、Hbは102でした。午後までにALTは1800、LD3570に上昇しました。 、血清クレアチニンレベルは153(μmol/ L)でしたが、血小板は33に減少しました。低レベルのフィブリノーゲン(1.1 g / L、参照値2〜4 g / L)と高レベルのDによって示される凝固障害がありました。 -フィブリンの二量体(30.2 mg / L、< 0.5 mg / L)。帝王切開の傷から出血があり、追加の縫合糸が配置されました。このとき、8単位の血小板が投与されました。カリウムレベルは4.7から5.6(mmol / L)に上昇しました。溶血がはっきりと観察された。クームス試験は陰性でした。尿中排泄量はわずか10ml / hでした。臨床検査では、腎臓と肝臓の両方に損傷の兆候がある重篤な疾患が明らかに示されました。さらに、凝固系に障害があり、顕著な凝固と顕著な線維素溶解を同時に示した。硫酸マグネシウムの注入は、子癇前症の重篤な合併症であるけいれんの予測徴候と考えられている反射亢進のために開始されました。デキサメタゾン10mgの静脈内投与が開始され、患者は集中治療室(ICU)に移送されました。
さらに、他の救急措置の鑑別診断目的で臨床検査が行われました(表2)。 ADAMTS13の活動は正常な62%(40〜130%)で、TTPを除きます。血清補体C3(0.52 g / L、0.71〜1.41 g / L)およびC4(0.07 g / L、0.12〜0.34 g / L)レベルは低かった。補体の可溶性末端複合体(C5b-9、971 ng / mL、< 366 ng / mL)のレベルは、産後最初の日に上昇しました。抗リン脂質抗体は検出されず、B型およびC型肝炎に関する感染血清学、およびHIVは陰性でした。便サンプルから、典型的なHUSを引き起こす病原体は陰性でした。

表2.疾患の診断と治療のタイムライン。
患者は、分娩後1日目と2日目に血漿交換治療を受けました。治療期間中(産後2、4、6日目)に全部で3回溶血されました。
産後3日目に患者は安定し、女性病院の回復室に戻されました。高血圧は1日2回アムロジピン10mg、1日3回ラベタロール200mgで治療されました。分娩後4日目に血小板は減少し続け、患者はaHUSと診断されました。多くの場合、HELLP症候群との鑑別診断とaHUSは、通常、分娩後3日目にHELLP患者の自然回復にあります。エクリズマブによる治療が開始されました(900 mg IV)。 entは肺炎球菌ワクチン接種を受け、予防的抗生物質(ペニシリン)が開始されました。患者はエクリズマブ(900 mg)を週4回投与され、急速に回復し始めました。彼女は、産後6日目の3回目の血液透析の後、それ以上の血液透析を必要としませんでした(図2)。腎機能は徐々に矯正され、血小板数は増加し、溶血は解消しました。産後4週間で、C3とC4の血漿レベルが正常化されました。
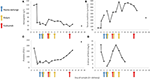
図2.疾患の初期段階で観察された選択された検査値と、血漿交換、血液透析、およびエクリズマブの投与のタイミング。パネル(A)は血中ヘモグロビン測定値の推移、パネル(B)は血清クレアチニンレベル、パネル(C)は血小板数、パネル(D)は17日間のフィブリン値のD-ダイマーを表しています。フォローアップ期間。
遺伝子検査では、既知の遺伝子多型は確認されませんでした。彼女は、補体調節因子H因子(CFH)、H因子関連タンパク質5(FHR5)、および膜補体タンパク質(MCP)、補体代替経路不活性化因子I(CFI)、代替経路活性化因子B(CFB)の変異についてテストされました。 )、および凝固カスケードの次の成分:ADAMTS13、トロンボモジュリン(THBD)、および細胞内酵素であるジアシルグリセロールキナーゼE(DGKE)。これらの変異はaHUSの既知の原因です(14)。さらに、H因子に対する抗体も検出されませんでした。 C4欠損症は検出されませんでした。
要約すると、私たちの患者は重度の子癇前症を患っており、HELLP症候群の診断基準を満たしていました。 aHUSの遺伝子検査は陰性のままでしたが、疾患の臨床経過(特に重度の急性腎障害)と治療への反応(特にエクリズマブ)は、患者が妊娠誘発性aHUSを患っていることを示唆しました。
ディスカッション
上記の初産婦は、重度の子癇前症、HELLP症候群、および妊娠誘発性aHUSと診断されました。 aHUSの素因となる可能性のある既知の遺伝子変異は発見されていません。 TMA、TTP、HUS / aHUS、およびHELLP症候群のような二次TMAのタイプ間の鑑別診断は重要です。特にTTPは、寛解まで毎日急速な血漿交換で治療されるため、早期に特定する必要があります(15)。
現在、aHUSを引き起こす可能性のある遺伝子変異をテストするための実験室分析法では、 aHUS症例の最大40〜60%のみであり、偽陰性の症例の可能性を残しています。したがって、突然変異の検査結果が陰性であっても、真のaHUSが除外されるわけではありません(16)。妊娠と出産後にaHUSが誘発されることはめったにありません。これらの場合、次の3年間で、約50%が慢性腎臓病(CKD)を発症し、一部は末期腎疾患(ESKD)さえも発症しました。遺伝子変異が観察された場合、最大85%がCKDまたはESKDを発症する可能性があります(17)。
妊娠高血圧症では、胎盤の炎症が内皮機能障害を引き起こすことが一般的に認められています。内皮の完全性が損なわれると、補体の活性化と凝固が起こります(18)。破壊された母体内皮はまた、重度の子癇前症および他の高血圧性妊娠障害に関連する晩年の母体の罹患率に寄与すると仮定されている(2、19)。損傷した内皮は、最初の診断症状が治まった後も数年で異常に機能することが示されています(20–23)。
HELLP患者の最大46%で、遺伝子変異が代替経路の調節因子に記載されています補体系の(24、25)。妊娠初期の胎盤が発達しているとき、後に子癇前症を発症した患者の血清中のBbレベルの上昇に補体系の活性化が見られます(26)。補体系の活性化は、重度の子癇前症およびHELLP症候群で観察されており、終末複合体(C5b-9)のレベルの上昇が重度の子癇前症の患者の尿で検出されています。 HELLP症候群の患者では、補体系の活性化の増加が機能検査によって示され、さらにCD55およびCD59の発現の欠損によって示され、調節の低下と補体系の活性化の悪化につながりました(27–29)。
HELLP症候群とaHUSの間には多くの類似点があります。どちらの状態でも、内皮障害が明らかに関与しており、その後に補体と凝固の活性化が続きます。重度の子癇前症およびHELLP症候群では、重度の疾患の初期兆候で投与されるエクリズマブとTMAは、腎臓と母体の内皮の保護に有益です(30)。内皮の完全性を維持することは、心血管疾患などの長期的な健康リスクから患者を保護する可能性があります。通常、妊娠関連のTMAでは、溶血および血小板減少症の臨床所見は約3日で解消します。疾患活動性がより長く続く場合は、鑑別診断を継続し、その場合にのみ代替治療(エクリズマブなど)を検討します。エクリズマブ治療を早期に導入することは、腎臓の損傷を防ぎ、内皮および全身性炎症の乱れを最小限に抑えることによって女性に利益をもたらすでしょう。エクリズマブは、十分に早く、わずか1〜2回の投与で、乱流を止めるのに十分であり、一連の事象を止めるのに十分である可能性があります(31)。一方では、エクリズマブは非常に高価な薬ですが、他方では、母親と家族への感情的な影響は言うまでもなく、集中治療治療、血漿交換、血液透析、腎移植の可能性の費用は計り知れません。
結論として、私たちの患者は重篤な病気であり、溶血、凝固障害、肝障害、およびICUへの入院と血液透析を必要とする腎不全を経験していました。エクリズマブが早期に開始された場合、HELLP症候群の最初の兆候で、病気の後期に有益であった可能性があり、腎臓損傷を軽減し、血液透析とその後のCKDの必要性を防ぐ可能性があります。したがって、現代の免疫医学のこの時代において、私たちは母親と家族のために、ただ待って最善を期待する以上のことをすることができるでしょうか?
倫理声明
倫理的レビューと承認はそうではありませんでした地域の法律および制度上の要件に従って、人間の参加者に関する研究に必要です。患者/参加者は、この研究に参加するための書面によるインフォームドコンセントを提供しました。
著者の貢献
ALとJH-Eは原稿のアイデアを開発し、原稿を書きました。 JH-EとMHは、患者の診断と治療に関与していました。すべての著者は、原稿をレビューおよび編集し、最終版の出版を承認しました。
利益相反
著者は、研究が商業的または金銭的関係がない状態で行われたことを宣言します。潜在的な利益相反と解釈される可能性があります。
4. Hauspurg A、Ying W、Hubel CA、Michos ED、OuyangP。有害な妊娠転帰と将来の母体の心血管疾患。クリンカルディオール。 (2018)41:239–46。 doi:10.1002 / clc.22887
PubMed要約| CrossRef全文| Google Scholar
5. Brosens I、Pijnenborg R、Vercruysse L、Romero R. ” 「偉大な産科症候群」は、深部胎盤の障害に関連しています。AmJObstet Gynecol。(2011)204:193–201。doi:10.1016 /j.ajog.2010.08。009
PubMed要約| CrossRef全文| Google Scholar
8. Germain SJ、Sacks GP、Soorana SR、Sargent IL、Redman CW 。正常な妊娠および子癇前症における全身性炎症性プライミング:循環する合胞体栄養膜微粒子の役割。 JImmunol。 (2007)178:5949–56。 doi:10.4049 / jimmunol.178.9.5949
PubMed要約| CrossRef全文| Google Scholar
9. Tannetta D、Masliukaite I、Vatish M、Redman C、Sargent I 。正常な妊娠および子癇前症における合胞体栄養膜由来の細胞外小胞の更新。 JReprodImmunol。 (2017)119:98–106。 doi:10.1016 / j.jri.2016.08.008
PubMed要約| CrossRef全文| Google Scholar
10. Weinstein L.溶血、肝酵素の上昇、血小板減少の症候群カウント:妊娠中の高血圧の深刻な結果。 J ObstetGynecolです。 (1982)142:159–67。 doi:10.1016 / S0002-9378(16)32330-4
PubMed Abstract | CrossRef全文| Google Scholar
15. Pourrat O、Coudroy R、PierreF。重度のHELLP症候群の違いおよび血栓性微小血管症、血栓性血小板減少性紫斑病および他の模倣者。 Eur J Obstet Gynecol ReprodBiol。 (2015)189:68–72。 doi:10.1016 / j.ejogrb.2015.03.017
PubMed要約| CrossRef全文| Google Scholar
20. Agatisa PK、Ness RB、Roberts JM、Costantino JP、Kuller LH 、マクラフリンMK。子癇前症の病歴のある女性における内皮機能の障害:心血管リスクの指標。 JPhysiolはCircPhysiolを聞きます。 (2004)286:1–3。 doi:10.1152 / ajpheart.00298.2003
PubMed要約| CrossRef全文| Google Scholar
22. Kvehaugen AS、Dechend R、Ramstad HB、Troisi R、Fugelseth D 、スタッフAC。子癇前症後の女性と子供では、内皮機能と循環バイオマーカーが乱されます。高血圧。 (2011)58:63–9。 doi:10.1161 / HYPERTENSIONAHA.111.172387
PubMed要約| CrossRef全文| Google Scholar
23. StanhewiczAE。子癇前症の病歴のある女性の残存血管機能障害。 J Physiol Regul Integr CompPhysiolです。 (2018)315:R1062–R71。 doi:10.1152 / ajpregu.00204.2018
PubMed要約| CrossRef全文| Google Scholar
25. Vaught AJ、Braunstein EM、Jasem J、Yuan X、Makhlin I 、Eloundou S、etal。補体の代替経路における生殖細胞変異は、HELLP症候群の素因となります。 JCIの洞察。 (2018)3:0–13。 doi:10.1172 / jci.insight.99128
PubMed要約| CrossRef全文| Google Scholar
31. Elabd H、Elkholi M、Steinberg L、Acharya A. Eculizumab、子癇前症/ HELLP症候群に関連する急性腎障害の新しい潜在的治療法。 BMJケース担当者(2019)12:e228709。 doi:10.1136 / bcr-2018-228709
PubMed要約| CrossRef全文| Google Scholar