ポロニウム元素の事実
化学元素ポロニウムは、カルコゲンとメタロイドに分類されます。 1898年にマリーとピエールキュリーによって発見されました。

データゾーン
| 分類: | ポロニウムはカルコゲンでありメタロイドです |
| 色: | 銀灰色 |
| 原子量: | (209)、安定した同位体なし |
| 状態: | 固体 |
| 融点: | 254 oC、527 K |
| 沸点: | 960 oC、1233 K |
| 電子: | 84 |
| プロトン: | 84 |
| 最も豊富な同位体の中性子: | 125 |
| 電子シェル: | 2,8 、18,32,18,6 |
| 電子構成: | 4f14 5d10 6s2 6p4 |
| 密度@ 20oC: | 9.4 g / cm3 |
次のような詳細を表示:熱、エネルギー、牛イオン化、
反応、化合物、半径、導電率
| 原子体積: | 22.23 cm3 / mol |
| 構造: | 単純な立方体 |
| 硬度: | – |
| 比熱容量 | 0.12 J g-1 K-1 0.12 |
| 融解熱 | 13 kJ mol-1 |
| 融解熱 | 142 kJ mol-1 |
| 蒸発熱 | 120 kJ mol-1 |
| 最初のイオン化エネルギー | 812 kJ mol-1 |
| 2番目のイオン化エネルギー | – |
| 3番目のイオン化エネルギー | – |
| 電子親和性 | 180 kJ mol-1 |
| 最小酸化数 | -2 |
| 最小一般的な酸化番号 | -2 |
| 最大酸化数 | 6 |
| 最大一般的な酸化番号 | 4 |
| 電気陰性度(ポーリングスケール) | 2.0 |
| 分極性体積 | 6.8Å3 |
| 空気との反応 | 穏やか、⇒PoO2 |
| 15 MHNO3との反応 | – |
| 6 MHClとの反応 | 穏やか、⇒PoCl2 |
| 6 MNaOHとの反応 | なし |
| 酸化物 | PoO2、PoO2 |
| 水素化物 | PoH2 |
| 塩化物 | PoCl2 |
| 原子半径 | 190 pm |
| イオン半径(1+イオン) | – |
| イオン半径(2+イオン) | – |
| イオン半径(3+イオン) | – |
| イオン半径(1-イオン) | – |
| イオン半径(2-イオン) | – |
| イオン半径(3-イオン) | – |
| 熱伝導率 | 0.2 W m-1 K-1 |
| 導電率 | 0.7 x 106 S m-1 |
| 凝固点/融点: | 254 oC、527 K |

1883年のマリーキュリー、16歳。ポロニウムは、15年後、彼女が最初に発見した元素でした。
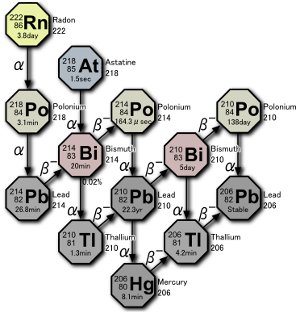
ウラン崩壊系列。ポロニウムの3つの同位体は、ラドンガス自体の崩壊、またはラドンの崩壊に起因する原子の崩壊のいずれかによって、自然界で生成されます。戸坂による画像。
ポロニウムの発見
ポロニウムは、マリーとピエール・キュリーによって最初に発見された元素でした。
1898年にパリでポロニウムとラジウムを発見し、ピッチブレンド(酸化ウラン鉱)の放射能を調査しました。
彼らは次のように書いています。「ピッチブレンドから抽出した物質には、分析特性がビスマスと同様に、これまで知られていなかった金属が含まれていると考えられます。この新しい金属の存在が確認された場合は、次のように提案します。私たちの一人の出身国の名前にちなんでポロニウムと呼ばれました。」
キュリーの希望に応じて、ポロニウムはマリーキュリーが生まれ育ったポーランドにちなんで名付けられました。
キュリーが放射性元素を扱うことの危険性は、知られていませんでした。彼らの発見をしました。この時からの彼らの実験室のノートは非常に放射性であるため、現在は鉛で裏打ちされたケースに保管されています。(1)
外観と特徴
有害な影響:
ポロニウムは、化学毒性と放射能の両方で有害です。ポロニウム-210はアルファ放射体であるため、飲み込んだり吸入したりすると非常に危険です。ポロニウムへの曝露は、さまざまな癌にかかるリスクを高めます。
特徴:
ポロニウムは、希少な銀灰色の放射性で低融点の半金属です。
ポロニウムは希酸と容易に反応しますが、アルカリとはわずかしか反応しません。
その同位体はすべて放射性です。
210Poは、崩壊によって周囲の空気が励起されるため、青い輝きを放ちます。製品。 1グラムのPoは、5キログラムのラジウムと同じ数のアルファ粒子を放出します。
ポロニウムのアルファ崩壊によって放出されるエネルギーはかなりのものであり、その周りの空間を加熱します。放出されるエネルギーは非常に大きいため(140 W / g)、約0.5グラムを含むカプセルは500°Cを超える温度に達します。
ポロニウムの使用
によって放出されるアルファ線ポロニウムは、巻紙、ワイヤー、板金などのプロセス中に発生する静電気を除去するために使用できます。ただし、ベータ線源は危険性が低いため、より一般的に使用されます。
210Poは原子熱源として使用できますが、同位体の半減期が短い(138。4日)ため、長期間使用するための電力を供給しません。
ポロニウムは、写真フィルムのほこりを取り除くために帯電防止ブラシにも使用されています。放射性物質の放出を制御するためにブラシで密封されています。
豊富さと同位体
豊富な地球の地殻:1兆分の1のオーダー。
豊富な太陽系:ごくわずか
コスト、純粋:100gあたり
コスト、バルク:100gあたり
出典:ポロニウムは、すべての同位体の半減期が短いため、非常にまれな元素です。ウラン鉱石に微量に含まれています。これは、天然ビスマス209Biに中性子を照射して、210Biを生成し、β崩壊によって210Poに崩壊することで得られます。毎年約100gのポロニウムが合成されます。
同位体:ポロニウムには、半減期がわかっている29の同位体があり、質量数は190〜218です。安定したものはありません。最も安定した同位体は209Poで、半減期は102年です。

このページを引用
オンラインリンクの場合は、次のいずれかをコピーして貼り付けてください。
<a href="https://www.chemicool.com/elements/polonium.html">Polonium</a>
または
<a href="https://www.chemicool.com/elements/polonium.html">Polonium Element Facts</a>
学術文書でこのページを引用するには、次のMLA準拠の引用を使用してください。
"Polonium." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/polonium.html>.