大動脈二尖弁疾患における大動脈拡張|文献情報| J-GLOBAL科学技術総合リンクセンターRevistaEspañoladeCardiología(英語版)
はじめに
大動脈二尖弁(BAV)は最も一般的な先天性心臓異常であり、人口の0.5%〜1.4%で発生します。 ;この異常は、常染色体優性経路によって遺伝的に散発的に伝達され、男性が3:1で優勢です。1BAVは、弁関連の合併症(弁機能障害、感染性心内膜炎)だけでなく、大動脈拡張を含む多くの血管異常2(図1)。
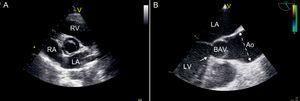
図1.二尖大動脈弁を評価する心エコー画像。 A:前後構成の二尖大動脈弁を示す経胸壁傍胸骨短軸像。 B:大動脈二尖弁の異常な収縮期開口(「ドーミング」)を示す経食道長軸像。大動脈拡張は明らかであり、洞管接合部の上から始まり、管状大動脈の中央上昇部分で最大になります(点線)。大動脈下狭窄が存在し、左心室流出路の中隔部分から線維性隆起が生じる(矢印)。Ao、大動脈; BAV、二尖大動脈弁; LA、左心房; LV、左心室; RA、右心室; RV、右心室。
BAV関連の大動脈拡張の報告された有病率は33%〜80%の範囲です。この変動は、拡張を定義するために使用されるしきい値、年齢と体の表面積の正常値、および大動脈。関与する領域に応じて、さまざまなタイプの大動脈二尖弁が説明されています。3は、中部上行路の拡張(管状上行部分のみでの拡張)であり、最も頻繁に観察されるパターンです。4年齢とBAV形態も関連しています。形態の役割は明確に定義されていませんが、上行大動脈(AscAo)の次元で編集されています。5,6
病態生理学
BAV患者の大動脈拡張の病因に関する2つの理論の間で論争が続いています。ある理論では、AscAoの拡張は血流の乱れの結果である可能性があり、一次血行力学的効果が胎児の生命から作用し、さまざまな程度のストレス誘発性大動脈変性を引き起こすと主張しています。この仮説には比較的単純であるという利点がありますが、血行力学的変化だけではこれらの患者の大動脈拡張の原因にはなり得ないことが示唆されています7。2番目の理論は、大動脈構造に先天性欠損が存在するという仮説を立てます。心臓弁膜尖の配置とAscAo疾患との関連は、神経堤細胞の異常な発達パターンによって説明される可能性があり、構造異常は血行力学的病変に関係なく細胞レベルで発生します8。この理論は過去10年間でますます一般的になり、これらの患者の近位大動脈の治療のためのより積極的な推奨事項。主な先天性壁の異常を裏付ける証拠がいくつかあります。
-
•正常に機能している大動脈弁を有するBAV患者(子供を含む)では、以下と比較して有意な近位大動脈の拡大が観察されています。年齢を一致させた通常のコントロール。ただし、「正常に」機能するBAVは本質的に狭窄であり、弁を通過する圧力勾配がない場合でも、軸方向ではなく乱流が発生します。この流れは非常に偏心しており、近位大動脈に異常ならせん状の流れパターンを引き起こします9。これらの異常な血行力学的パターンは長期間にわたって作用し、非対称のストレス誘発性大動脈壁病変を引き起こし、その後特定の大動脈セグメントが拡張する可能性があります。
-
•BAVの患者は、弁病変の血行力学的重症度を照合した後でも、三尖大動脈弁(TAV)の患者よりも大動脈基部とAscAoの直径が大きいことが示されています。5ただし、ジェット偏心BAVを介して発生するものは分析されていません。
-
•AscAoの拡張は、大動脈弁の交換後でも発生する可能性があります。10
-
•内因性壁異常は、BAVにおけるAscAo合併症の根底にある組織病理学的異常、すなわち嚢胞性内側変性の実証によって裏付けられるであろう。この病理学的所見は、動脈瘤形成が起こる前にBAV患者の大動脈で観察されており、大動脈の細胞外マトリックス成分の減少とマトリックス分解酵素の増加で構成されています。11、12、13興味深いことに、同様の組織学的および生体分子の変化がBAVとマルファン大動脈では、これらの変化の分布は両方の条件で異なり、反応性大動脈壁リモデリングの開発における血行動態の主要な役割を提唱するTAV動脈瘤でも異なります(表1)。
表1 。嚢胞性内側変性の組織病理学
特徴 BAV動脈瘤 マルファン動脈瘤 TAV動脈瘤 ECM成分の減少 VSMCアポトーシスの増加:ECMタンパク質の産生の減少 エラスチンの断片化:構造的支持と弾力性の喪失 FB-1欠損症:エラスチンおよびコラーゲンマトリックスからのVSMCの剥離(マトリックス破壊) 変化の程度が少ない マトリックス分解酵素の増加 MMPの増加-2MMPを増やす-9MMP2 / TIMP-1を増やす MMP-12を増やす MMP-13を増やす 空間CMD分布 非対称 円周 動脈瘤領域に限定 BAV 、二尖大動脈弁; CMD、嚢胞性内側変性; ECM、細胞外マトリックス; FB、フィブリリン; MMP、マトリックスメタロプロテイナーゼ; TAV、三尖弁; TIMP、メタロプロテイナーゼの組織阻害剤; VSMC、血管平滑筋細胞。
-
•最後に、BAV疾患は遺伝率が高く、決定はほぼ完全に遺伝的であることが示唆されています。大家族の研究では、BAVのある個人の一等親血縁者(FDR)におけるBAVの有病率は9%であると報告されています。さらに、いくつかの研究では、BAVが存在するかどうかにかかわらず、BAV患者のFDRの最大3分の1で大動脈二尖弁拡張、胸部大動脈瘤、または大動脈解離が報告されています14、15。BAVおよびAscAo動脈瘤の複数の潜在的な遺伝子部位は示唆されているように、BAVの大動脈拡張の原因となる明確な部位は確立されていません。
自然史拡張率
大動脈拡張は小児期に記録されており、これはこれを示唆していますプロセスは人生の早い段階で始まります。 BAVに関連する大動脈疾患の進行速度に関する情報は大きく異なり、研究では年間約0.3〜1.1mm(mm /年)が報告されています7。オルムステッド郡の研究では、AscAo拡張の有病率(> 40mm)は15%であり、繰り返し測定した患者のサブセットでは、有病率は39%に上昇しました16。ただし、大動脈の拡張には多くの危険因子が関連しています(高血圧、男性の性別、重大弁膜症)、最も重要な変数はおそらく年齢です。小児および成人の両方の研究で、TAV関連動脈瘤と比較して、BAV関連動脈瘤はより急速に拡大し、かなり若い年齢で現れることが報告されています6、7。さらに、大動脈の進行性拡張は、以下の患者でより一般的です。ベースラインでのより大きな大動脈。
大動脈解離と破裂
BAV患者で最も恐れられている大動脈合併症は大動脈解離ですが、この合併症の実際の発生率については議論が続いています。有病率は研究されたコホートによって異なり、4%の症例の推定がプールされています17、18。紹介センターからのいくつかの報告は、大動脈解離リスクがTAVよりもBAVで5〜9倍高いことを示唆しましたが、他の報告ではそのような関連は観察されませんでした.7、19最近の研究では、リスクが低くなっています。トロントシリーズ20では、解離の有病率は追跡調査の患者年あたり0.1%であり、オルムステッド郡の研究では、心エコー診断後の大動脈解離の25年コホートリスクは0.5%でした21。
実際、BAV関連のAscAo動脈瘤は、他の病因の動脈瘤と同等のサイズ範囲(平均:60±12mm;範囲:30-108mm)で解離および破裂します22。関連する解離および破裂のリスクの増加。 BAVは、特発性AscAo動脈瘤よりもかなり若い年齢で発生する大動脈拡張の発生率と速度が高いためです7、19。BAV患者とTAV患者を比較すると、BAV患者の大動脈成長率は高いものの、 1.9対1.3mm /年)、破裂と解離の発生率は同様でした。7したがって、より速い成長率にもかかわらず、負のイベントは同様の速度と同様の大動脈径で発生します。
マルファン症候群の患者は大動脈解離の生涯の可能性がはるかに高いn(40%)BAV患者より。ただし、BAV疾患はマルファン症候群よりも約100倍一般的であるため、BAV疾患は、マルファン症候群と同等以上の大動脈解離の原因となります。22
診断と監視
経胸壁心エコー図(TTE)は通常BAVを診断するための主要なイメージング技術(図1)。大動脈二尖弁またはAscAoが拡大している患者を特定し、時間の経過とともに進行を評価するためです。正常範囲(AscAoと大動脈基部の直径2)は、年齢と性別で修正する必要があります。これらのTTE測定値は、マルチディテクターコンピューター断層撮影(CT)スキャン23および磁気共鳴画像法(MRI)24による測定値と密接に関連しており、TTEが正確な画像診断法であることを示唆しています。それにもかかわらず、標準的なTTEはAscAo全体を視覚化できない可能性があり、その最大直径を検出できない可能性があります。通常、AscAoの近位から中央に最も顕著です。心エコー検査で十分に視覚化されていない場合は、MRIまたはCTスキャンを実行してAscAo全体を評価することをお勧めします。大動脈拡張(45mm以上)が最初に診断されたときにベースラインMRIまたはCTスキャンを実行することも合理的です。これは、連続心エコー図の間に不一致が発生した場合のフォローアップ中の参照手段として役立ちます。 MRIスキャンは、大動脈瘤を正確に検出および測定し、弁の解剖学的構造を確認して、造影剤や放射線被曝を回避します。最近、異常な収縮期ヘリカルフローが4次元MRIによって実証されており、フロージェットの偏心の程度と方向は、分節動脈瘤形成のリスクを決定するために重要である可能性があります9。特定の大動脈の解剖学的構造によって、どの画像検査が最適かが決まります。たとえば、動脈瘤が大動脈基部に関係している場合、CTは根の画像化が不十分であり、その直径のサイズ設定の精度が低いため、CTよりもMRIの方が適しています。 CTとMRIに禁忌がある場合、TEEは、大動脈基部(図1)、大動脈弓、および下行大動脈にある動脈瘤を評価するためにTTEよりも明らかに優れている合理的な代替手段です。 TTEとマルチスライスCT血管造影の組み合わせは、手術が計画されている場合に必要なすべての情報を提供する可能性があります。
胸部大動脈瘤が最初に検出されたとき、その成長率を決定することはできません。したがって、最初の検査から6か月後に画像検査を繰り返すのが適切です。動脈瘤のサイズが変わらない場合は、ほとんどの場合、毎年画像検査を行うのが合理的です25。これは、進行性の大動脈拡張が発生する可能性があるため、大動脈弁置換術後にも当てはまります。フォローアップ評価は、大動脈の寸法、拡張率、および身体活動に応じて、より短い間隔で検討する必要があります。重大な弁病変と正常な大動脈径のないBAV患者では、2年ごとの心エコー検査で十分な場合があります。
最後に、大動脈弁奇形と拡張したAscAoを検出するには、BAV患者のFDRのスクリーニングを検討する必要があります。 TTEは、構造的な心臓の異常を伴うFDRを確実に特定する可能性があります14、26(図2)。ただし、軽度に拡張した大動脈根とTAV表現型を持つFDRの自然史は不明です。したがって、この集団の長期追跡調査は、拡張率を決定するため、そして次に、合併症が発生する前に大動脈拡張を合理的に検出する連続TTEスクリーニングの頻度を確立するために必要です。14
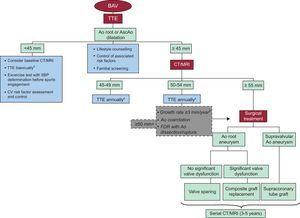
図2。大動脈拡張の管理と監視への一般的なアプローチ。あお、大動脈; AscAo、上行大動脈; BAV、二尖大動脈弁; CT、コンピューター断層撮影; CV、心血管; FDR、一等親血縁者; MRI、磁気共鳴画像法; SBP、収縮期血圧; TTE、経胸壁心エコー図。a弁機能障害が存在する場合は、早期のフォローアップを検討してください。b同じ大動脈レベルで同じイメージング技術を並べて作成した画像の連続比較。
管理医療管理
定期的な画像評価では、BAVの患者は、解離と動脈瘤形成のリスク、および急性大動脈解離の典型的な症状に関する情報を受け取る必要があります(図2)。
活動またはライフスタイルは、強度が高いため変更する必要があります。 、競技および衝突スポーツは潜在的に危険であり、軽度の拡張大動脈(45mm)以上で大動脈解離または破裂を引き起こす可能性があります。27
これらの患者では、高血圧などの関連する心血管リスク要因を積極的に管理する必要があります。 β遮断薬は、BAV患者の大動脈根の拡張または進行を遅延または予防するために投与される場合があります(重度の大動脈弁逆流がない場合)25、26。ただし、この推奨の根拠は、マルファンにおけるβ遮断薬治療の効果に基づいています。 、28、したがって、さらなる研究によって確認されるべきである。いくつかの研究は、マルファン症候群の人々にアンジオテンシン受容体遮断薬とアンジオテンシン変換酵素阻害薬治療の利益をもたらしましたが29、30、現在、BAV動脈瘤疾患におけるこれらの治療からの同様の利益を示すデータはありません。
BAV疾患の医学的管理には現在、スタチンが含まれていません。スタチンは、マトリックスメタロプロテイナーゼの発現を低下させ、内皮一酸化窒素シンターゼの増加を介して内皮機能を改善することにより、大動脈拡張を制限する可能性があります。31軽度または中等度の大動脈弁狭窄症の参加者を対象とした最近のランダム化プラセボ対照試験では、スタチンが大動脈弁関連イベントまたは大動脈弁狭窄症の進行を変化させなかったことが示されました31。しかし、研究参加者の約5%のみがBAVを有していました。 BAV疾患患者のAscAo拡張、解剖、破裂に対するスタチンの効果に焦点を当てたさらなる研究が必要です。
手術
弁手術の適応がないBAV患者の大動脈手術の最適なタイミングは、無症候性大動脈拡張の自然史に関して入手可能な限られたデータ(図2)。 AscAoの直径は、拡大した大動脈のサイズを決定するために最も頻繁に使用される寸法であり、無症候性の大動脈瘤患者に待機的手術を推奨するための主要な基準です。現在のガイドラインでは、大動脈根またはAscAoの直径が55mm以上の場合、TAV患者では大動脈根を修復またはAscAoを交換する手術が適応とされ、低身長の患者の高さと大動脈断面積を組み込んだ式25、32、33マルファンおよびBAV患者には、より低い閾値(≥50mm)が推奨されます。ただし、最近の長期追跡調査に基づくと、両方のエンティティ間の違いは重要です。 BAVの患者は、おそらくマルファン症候群と変性AscAo動脈瘤によって表される一連の状態の両極端の間にあり、外科的介入のサイズ基準は、両方の状態で確立されたものの中間である可能性があります(それぞれ50mmと55mm)。大動脈縮窄症、重度の大動脈弁狭窄症、または大動脈破裂または解離の病歴のあるFDRなどの危険因子を持つBAV患者では、AscAoが50mm以上のときに手術を、45mm以上のときに待機的大動脈弁置換術を受ける患者に手術を行うことをお勧めします。膨張率は、破裂のもう1つの主要な予測因子であることが示されています。 10mm /年を超える成長率は、伝統的に手術の適応症と見なされてきました34。心臓血管イメージングの分野における最近の進歩により、連続測定の再現性が向上しています。したがって、同じ画像技術で同じレベルの比較が正確に並べて行われている場合、手術を示すカットオフ値として3mm /年を超える拡張率を受け入れるという一般的な合意があります。大動脈。最後に、介入基準は、患者(年齢、併存疾患など)とセンターの両方の外科的リスクと慎重に比較検討する必要があります。最良のセンターでは、併存疾患のない若い患者におけるAscAoの待機的手術の現在の病院死亡率は約2%です34、35患者の特徴、大動脈弁機能不全、大動脈拡張の位置、および手術の種類を意思決定プロセスで考慮する必要があります。
いくつかの可能な外科的選択肢があり、その選択は、動脈瘤の位置、大動脈病変の遠位範囲、および望ましい抗凝固状態によって異なります(表2)。36、37弁修復または弁温存介入が考慮され、TEEは術前または術中に実施して、心臓弁膜症およびAscAoの解剖学的構造を定義することができます。38
表2.二尖大動脈弁膜症の外科的選択肢
| 外科的手法 | 考慮事項 |
| 外部合成ラッピングあり/なしの縮小大動脈形成術 | •一般的には推奨されません(再発性拡張のリスク)•高sの患者のための代替外科的リスク(特に副鼻腔が大幅に拡張していない場合) |
| 大動脈弁置換術と冠状動脈口の再移植によるAscAo(ベントール手術) | 重大な弁膜症およびAscAoの拡張を伴う患者 |
| 大動脈弁置換術および個別の冠状動脈上大動脈修復術 | •一般的には推奨されません(進行性洞拡張のリスク)• BAV狭窄、正常なサイズの副鼻腔、冠状動脈上AscAoの拡張を伴う高齢患者の代替 |
| 弁温存大動脈弁置換術 | 正常な若い患者に受け入れられるオプション-機能しているBAV |
| 肺自家移植 | •一般的には推奨されません(自家移植拡張のリスク)•妊娠を希望する子供、青年、または若い女性のための代替手段 |
| 大動脈弁修復 | 患者を慎重に選択した場合に許容されるオプション |