細胞および感染微生物学の最前線
はじめに
黄色ブドウ球菌は、世界中の入院患者から分離された重要なヒト病原体であり、病院と地域社会が獲得した感染症の両方を引き起こします( Lowy、1998)。この病原体は、皮膚や軟部組織、筋骨格系や循環器系に影響を与える、いくつかの異なる全身感染症の病原体です(Lowy、1998; Changchien et al。、2016)。黄色ブドウ球菌は、ヒト単球由来のマクロファージで生き残ることができると報告されています(Kubica et al。、2008)。黄色ブドウ球菌の病原性は、細菌によって産生されるさまざまな分泌酵素および毒素と密接に関連しています(Otto、2014年)。溶血素、ロイコシジン(Panton–Valentine leukocidin、PVL)、および毒素性ショック症候群毒素-1(TSST-1)は、それぞれ、赤血球膜の損傷、白血球の食作用機能の損傷、および毒素性ショック症候群の誘発に重要です。黄色ブドウ球菌の病原性プロセス(Löffleretal。、2010; Vandenesch et al。、2012; Berube and Bubeck Wardenburg、2013; Andrey et al。、2015; Al Laham et al。、2015)。最近の研究では、溶血素が黄色ブドウ球菌のバイオフィルムの形成にも関与していることが示されています(den Reijer et al。、2016)。病院や地域の環境における多剤耐性黄色ブドウ球菌の蔓延の増加は、黄色ブドウ球菌の危険性をさらに高め、臨床治療に深刻な課題をもたらします(Voss and Doebbeling、1995; Evangelista Sde and de Oliveira、2015)。
最近、不完全な溶血性表現型(SIHP)を持つ黄色ブドウ球菌のクラスに属する多くの菌株が当院で発見されました。これらのSIHP株によって引き起こされる溶血は、他の黄色ブドウ球菌株で生成される完全な溶血リング(β溶血表現型)とは大きく異なります。ただし、これらのSIHP株はまだ包括的に識別および特徴付けられていません。これらのSIHP株の微生物学的特性を調査するために、60のSIHP株を収集し、溶血性表現型、溶血素遺伝子の発現、薬剤耐性機能、病原性などの複数の基準を使用して研究しました。この研究は、SIHPがβ-溶血素を高度に発現し、高い毒性の可能性を持っているメチシリン耐性菌であることを示しています。
材料と方法
菌株
60のSIHP 2013年から2015年の間にSoochow大学の第2付属病院に入院した患者から菌株を分離しました。各患者から重複サンプルを採取して分析しました。次に、これらの分離株を、コロンビア種のヒツジ血液寒天プレート(CHROMagar Company、上海、中国)で、5%CO2(v / v)を含む雰囲気下で35°Cで培養しました。黄色ブドウ球菌としての菌株の同一性は、Phoenix-100自動微生物学システム(Becton、Dickinson and Company、USA)を使用して確認されました。完全な溶血性表現型を持つ対照の黄色ブドウ球菌株は、同じ期間に当院の患者から分離されました。ここでは、完全な溶血性表現型を持つ黄色ブドウ球菌をSCHP株と呼びました。黄色ブドウ球菌ATCC25923参照株(上海臨床検査センター、中国)は完全な溶血性表現型を持ち、対照株としても機能しました。 Soochow大学の第2付属病院の医療倫理委員会はこの研究を承認し、すべての分離株はこの研究で患者の同意を得て収集されました。
不完全な溶血表現型の比較分析
S. aureus菌株は、さまざまな会社(CHROMagar、Autobio Diagnostics Co.、Ltd。、中国およびBioMérieux、中国)の市販の血液寒天プレート、およびコロンビア血液寒天粉末(OXIDE、英国)を使用して自作した羊血液寒天プレートで培養しました。細菌を35℃、5%CO2(v / v)を含む雰囲気で24時間培養した後、連続継代しました。その後、溶血現象が観察された。完全な溶血表現型を持つ臨床的に分離された株とATCC25923参照株も、比較分析のコントロールとして観察されました。
逆転写リアルタイム定量を使用した黄色ブドウ球菌の4つのヘモリシン遺伝子のmRNAレベルの決定PCR(qPCR)
SIHPおよびATCC25923参照株からのトータルRNA抽出は、前述のように実施されました(Qin et al。、2014)。最初に、リゾチーム、リゾチーム、およびプロテイナーゼKを使用して細胞を溶解しました。次に、RNeasy Mini Kit(Qiagen)を使用して、製造元の推奨プロトコルに従ってRNAを抽出および精製しました。次に、NanoDrop1000を使用してRNAの品質と濃度を評価しました。 -逆転写キット(Thermo Fisher Scientific Inc.、USA)を製造元の指示に従って使用して、cDNAに転写します。簡単に説明すると、qPCRは次のように実施しました:94°Cで3分間の前変性、94°Cで30秒間の変性、52°Cで30秒間のアニーリング、72°Cで40秒間の伸長、合計45サイクル。各サンプルには、3つの技術的反復と3つの生物学的反復がありました。 4つの溶血素遺伝子と16srRNA遺伝子のそれぞれの転写プロファイルは、2-ΔΔCt法を使用して決定されました。転写のレベルは、16srRNA遺伝子の発現と比較して決定されました。 4つの溶血素遺伝子(hla、hlb、hlgC、およびhld)の配列は、GenBankデータベースから取得されました。 Primer 5.0ソフトウェアを使用してプライマーを設計し(表1)、これらのプライマーはSangon Biotech Co.、Ltd。(Shanghai、China)によって合成されました。
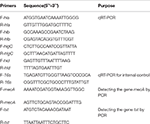
表1.この調査で使用したプライマー。
SPSS17.0をデータ分析に使用しました。測定データはx̄±sとして表されます。 2つの独立したサンプルのT検定を使用して、4つの溶血素遺伝子のそれぞれの相対的な発現を比較しました。統計的有意性は、p < 0.05として定義されました。
ウエスタンブロットによるα-溶血素(Hla)発現の検出
濃度SIHPと参照株の黄色ブドウ球菌ATCC25923は、濁度計を使用して5.0マクファーランドに調整しました。次に、各サンプルから総タンパク質を抽出し、同じ濃度に調整して、SDS-PAGEゲルで電気泳動を行いました。次に、タンパク質をニトロセルロースメンブレンに転写し、メンブレンを5%スキムミルクで1時間ブロックしました。ヤギ抗黄色ブドウ球菌α-溶血素ポリクローナル抗体(Abcam)を最終濃度2μg/ mLで添加しました。次に、反応混合物を4℃で一晩インキュベートした。メンブレンを洗浄した後、1:1000に希釈したHRP標識ウサギ抗ヤギIgG抗体を添加し、37℃で2時間インキュベートしました。最後に、化学発光基質が発色のために追加されました。 α-溶血素の発現は、最終的にイメージャの下で観察されました。
SIHPの抗菌薬感受性試験
マイクロタイターブロス希釈法を使用して、抗菌薬感受性スクリーニングを実施しました。手順は、Phoenix-100自動微生物学システムの操作マニュアルに従って行われました。このスクリーニングの結果は、臨床検査標準協会(CLSI;臨床検査標準協会、2014年)によって導入されたM100-S24基準を使用して解釈されました。メチシリン耐性黄色ブドウ球菌(MRSA)の状態は、2つの抗生物質のMIC(最小発育阻止濃度)を使用して決定されました。 SIHP株の場合、4μg/ mL以上がオキサリシンのMICであり、8μg/ mL以上がセフォキシチンのMICでした。
mecAおよびtst遺伝子の検出
60個のSIHPすべて菌株は、薬剤耐性遺伝子mecAと病原性遺伝子tstについてテストされました。ゲノムDNAの煮沸抽出は、リソスタフィンを使用した細胞溶解後に実施されました。次に、DreamGreen Taqキットを使用して、mecAおよびtst遺伝子をゲノムDNAから増幅しました。 PCR条件は次のとおりでした:94°Cで3分間の前変性、94°Cで30秒間の変性、50°Cで30秒間のアニーリング、72°Cで1分間の伸長。 PCR産物は、BLASTによって配列決定および分析され、期待される産物であることが検証されました。黄色ブドウ球菌の薬剤耐性遺伝子mecAおよび病原性遺伝子tstの配列はGenBankデータベースから取得されました。 Primer 5.0ソフトウェアを使用してプライマーを設計し(表1)、これらのプライマーはSangon Biotech Co.、Ltd。(Shanghai、China)によって合成されました。
S. aureusSIHP株の生存の検出マクロファージ
マクロファージにおけるS.aureus SIHP株の生存率を、tst陰性のS. aureus SCHP株の生存率と比較するために、ヒト単球細胞株THP-1を10%を含むRPMI-1640で維持しました(v / v)5%(v / v)CO2を含む雰囲気で37°CのFBS。マクロファージ感染の場合、THP-1細胞を24ウェル組織培養皿にウェルあたり5×105細胞で播種し、10-7 Mホルボール12-ミリステート13-アセテート(PMA)で48時間分化させました。対数期(OD600 0.5–0.6)細菌の約3×108コロニー形成単位(CFU)を遠心分離によりペレット化し、PBSで2回洗浄し、1mlのRPMI-1640に再懸濁しました。次に、細菌を20:1のMOIで細胞単層に添加し、1000rpmで5分間遠心分離しました。感染細胞を37℃で20分間インキュベートした後、予熱したPBS(pH 7.4)で3回洗浄し、100μg/ mlゲンタマイシンを含む培地でさらに1時間インキュベートして細胞外細菌を死滅させました。細胞を洗浄および溶解して、細胞内細菌をタイムゼロサンプル(T0)として定量化しました。 12μg/ mlゲンタマイシンを含む新鮮な補充組織培養培地の存在下で12時間または24時間のインキュベーション後に、追加の細胞を収集した。THP-1細胞における細菌の増殖は、12時間または24時間の細胞内細菌の数を時間0の数(T12 / T0またはT24 / T0)で割ることによって決定されました。実験は独立して3回繰り返されました。
黄色ブドウ球菌SIHP株に感染したマクロファージのサイトカイン分泌の検出
細菌に12時間感染したTHP-1マクロファージの培養上清は集めました。サイトカインレベルは、製造元の指示に従って、CBA Human Thl / Th2 Cytokine Kit II(BD)を使用したFACSCaliburフローサイトメトリー(BD)によって測定されました。
多遺伝子座配列の入力と分析
結果
羊寒天血液プレート上のSIHP株の溶血表現型
図1A、Bに示すように、完全な溶血リング(β溶血表現型)がコントロールSで観察されました。 。血液寒天プレート上で24時間培養した後の黄色ブドウ球菌株。ただし、SIHP株では異なる溶血表現型(ここでは不完全溶血表現型と呼びます)が表示されました。さらに、異なる環境で増殖したSIHP株では不完全溶血表現型が観察されました。それぞれ微小好気性、好気性、嫌気性の条件を含む条件(図1C–E)。さらに、10回の連続継代後も、この不完全な溶血表現型は維持されました(図1F)。
相対4つの溶血素遺伝子のmRNA発現レベル
図2に示すように、SCHP株における4つの溶血素遺伝子hla、hlb、hlgC、およびhldの発現レベルは統計的に有意な差を示しませんでした(p > 0.05)対照株ATCC25923と比較。ただし、SIHP株におけるhla、hlgC、およびhldの発現レベルは、それぞれ50倍、16.7倍、および8.3倍(p < 0.05)有意に抑制されました。対照株ATCC25923およびSCHP株、SIHP株におけるhlbの発現は、対照と比較して7.7倍有意に増加しました(p < 0.05)。
ウエスタンブロットによるα-ヘモリシンの検出
によってコード化されたα-ヘモリシン遺伝子hlaは、黄色ブドウ球菌が分泌する孔形成毒素であり、その分子量は33 kDaです(Andrey et al。、2015; Al Laham et al。、2015)。ウエスタンブロット分析は、SIHP株におけるα-溶血素の発現がSCHPおよび対照株の発現よりも40倍低いことを示しました。これはqRT-PCRデータと一致しています(図3)。

図3.S.aureusにおけるα-溶血素のウエスタンブロット。 ATCC29213:完全な溶血性表現型を持つ黄色ブドウ球菌をコントロールします。 SCHP:同じ期間に臨床サンプルから分離された完全な溶血性表現型を持つ黄色ブドウ球菌。 SIHP:不完全な溶血表現型を持つ黄色ブドウ球菌。
SIHPの薬剤耐性
薬剤感受性のテストマイクロタイターブロス希釈液を使用すると、オキサシリンとセフォキシチンのMIC値はすべて> 2と>8μg/ mLであり、60のSIHP染色で示されました。 。 CLSI M100-S24ガイドラインによれば、60のSIHP株すべてがMRSA株として分類されます。 PCRは、60株すべてでmecA遺伝子も検出しました。
tst遺伝子のテスト
tst遺伝子は、黄色ブドウ球菌の重要な病原性因子です。 PCRは、50のSIHP株すべてがtst遺伝子を保有していることを示しました。
マクロファージにおける黄色ブドウ球菌SIHP株の生存能力はtst陰性黄色ブドウ球菌の生存能力よりも優れています
比較しましたマクロファージにおけるSIHP株およびtst陰性SCHP株の細胞内生存能力。プレートから回収された細菌の数を数えることにより、SIHP株の細胞内生存能力は、THP-1由来マクロファージに感染してから12時間または24時間後にtst陰性黄色ブドウ球菌株よりもはるかに高いことがわかりました(図4)。事前に、SIHP株は潜在的に高い病原性を持っていると推測し、病院ではSIHPにもっと注意を払う必要があることが示唆されました。
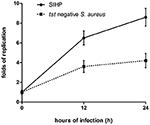
図4.THP-1由来のマクロファージにおけるSIHP株とtst陰性黄色ブドウ球菌の生存。マクロファージを細菌に12時間および24時間感染させた後、マクロファージを溶解し、細胞内で生き残った細菌をLB寒天培地にプレーティングしました。細胞内生存細菌の複製倍率は、上記のLB寒天プレート上のコロニー数に従って計算されました。
分泌の違い黄色ブドウ球菌SIHP株とtst陰性黄色ブドウ球菌に感染したマクロファージのサイトカインとケモカインの比較
SIHP株とtst陰性Sに感染したTHP-1由来マクロファージのサイトカインとケモカインの分泌の違いを比較する。黄色ブドウ球菌株では、SIHP株とtst陰性黄色ブドウ球菌株に感染したマクロファージの培養上清中のフローサイトメトリーによって炎症誘発性サイトカインを検出しました。結果は、SIHP株でIL-2、IL-6、およびIL-17Aの有意に高い誘導を示しましたが、tst陰性黄色ブドウ球菌によるものではなく、SIHP株がマクロファージでサイトカイン/ケモカイン応答を誘導することを示唆しています(図5)。マクロファージによって分泌される他のサイトカインIL-4、IL-10、INF-γ、およびTNFは、SIHP株とtst陰性黄色ブドウ球菌の影響を受けたグループとの間に明らかな違いはありませんでした。
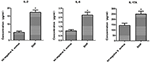
図5.黄色ブドウ球菌に感染したマクロファージから分泌されるサイトカインとケモカインの検出。 * P < 0.05。
多遺伝子座シーケンスの入力
2013年から2014年の間に当院に入院した患者から収集された60のSIHP分離株の多遺伝子座遺伝子型を決定しました。黄色ブドウ球菌MLSTデータベースで推奨されている7遺伝子座スキームが適用されました。 MLST分析では、すべてのSIHP株がST5クローンに分類されたことが示されました。
考察
溶血素は黄色ブドウ球菌にとって最も重要な病原性因子の1つです(Wiseman、1975)。 4種類の溶血素のそれぞれの複合効果により、赤血球膜が破壊され、血液寒天プレート上に完全に透明な溶血リングが形成されます。近年、SIHPは蘇州大学附属病院の臨床サンプルで発見されました。この研究では、これらの菌株を特定し、微生物学におけるそれらの特性を研究しようとしました。当初は、さまざまな市販または自作の羊血液寒天プレートを使用して、菌株を分離、培養、連続継代しました。長期の継代培養後でも不完全な溶血性表現型を示し、維持する菌株がいくつかあることを示しました。したがって、この表現型が非細菌性因子によって誘発される可能性を排除することができます。私たちの研究は、SIHPがユニークな黄色ブドウ球菌株のサブセットである可能性があることを示唆しています。
以前の研究は、ウサギ赤血球がα-溶血素に非常に敏感であることを示唆しました(Hildebrand et al。、1991)。 Berube etal。赤血球溶解に対するα-溶血素の影響は濃度依存的であると報告されています(Berube and Bubeck Wardenburg、2013)。 γ-溶血素は、人間や動物の赤血球に損傷を与える可能性があります(金子と神尾、2004)。 δ-溶血素は赤血球に損傷を与えますが、高濃度でのみ、細胞膜を溶解する膜貫通孔を形成します(Verdon et al。、2009)。この研究では、SIHP株とSCHP株の4つの溶血素の発現が有意に異なる転写発現プロファイルを持っていることを示しました。赤血球に直接損傷を与える可能性のあるSIHP株におけるα-、γ-、δ-溶血素の発現は、SCHP株よりもはるかに低く、β-溶血素はSCHP株と比較してはるかに高い発現レベルを示します。さらに、α-溶血素のタンパク質発現レベルは、ウエスタンブロットによってさらに検証されました。 β溶血素は、細胞を低温で培養しない限り、細胞を直接溶解するのではなく、主に他の毒素に対する赤血球の感受性を高めることが報告されています(Vandenesch et al。、2012)。この研究では、β-溶血素の高発現がSIHP株で検出されましたが、4°Cでインキュベートした場合でも、SIHP株では完全な溶血リングは観察されませんでした。これらの結果は、SIHP株の観察された不完全な表現型が、SCHP株と比較して異なる方法で発現される4つすべての溶血素の影響である可能性が最も高いことを示唆しています。以前の研究では、慢性的な病因の間に、シプロフロキサシンやトリメトプリムなどの抗生物質に起因する選択的圧力と宿主の免疫応答の複合効果が、黄色ブドウ球菌のコロニー形成に非常に重要なα-ヘモリシンの発現増加につながる可能性があることが示されています。特に呼吸器感染症における粘膜の黄色ブドウ球菌(Goerke et al。、2006; Huseby et al。、2010)。この研究では、SIHPに感染したすべての患者が広域スペクトル抗生物質の長期治療を受けました。この選択的圧力が薬剤耐性遺伝子の過剰発現を誘発し、溶血素遺伝子の発現を妨害したかどうかは、さらに必要な可能性が残っています。
SIHPの微生物学的特性を調査するために、抗菌薬感受性試験を実施し、黄色ブドウ球菌の病原性に関連する病原性遺伝子tstを選択しました。 60のSIHP株すべてがMRSA株として分類され、mecA遺伝子を保有していることがわかりました。抗菌薬感受性試験の結果は、これらの60のSIHP株のうち、10継代後でも、3つのSIHP株のみのリネゾリドとテイコプラニンのMIC値はほとんど変化していないことを示しました。ただし、MIC値のこれらの変更は、抗菌薬感受性の結果の評価に影響を与えませんでした。病原性遺伝子tstは、毒素性ショック症候群毒素(TSST-1)をコードします(Kreiswirth、1989)。スーパー抗原として、TSST-1はエンドトキシンによって誘発されるショックおよび免疫抑制反応を増強します(Kulhankova et al。、2014)。 PCR検査では、60のSIHP株すべてがtst遺伝子を持っていることがわかり、病原性の増加が示唆されました。最近、多くの報告が、黄色ブドウ球菌がヒト単球由来マクロファージで生き残ることができ、これらの黄色ブドウ球菌株がより毒性があることを示しました(Kubica et al。、2008; Tranchemontagne et al。、2015;Münzenmayeretal。、2016; NandiおよびBishayi、2016)。したがって、SIHP株とマクロファージのtst陰性黄色ブドウ球菌であるSCHP株の細胞内生存能力を比較したところ、SIHP株の細胞内生存能力はtst陰性黄色ブドウ球菌株よりもはるかに高いことがわかりました。さらに、患者データ分析は、SIHP株に感染したほとんどの患者における抗感染療法の効果が、SCHP株に感染した同様の患者の効果よりも悪いことを示した(データは示されていない)。私たちの研究は、SIHP株が潜在的に高い毒性を持っているという推測の予備的な実験的証拠を提供します。
侵襲性S.aureusの感染過程で、病原体関連分子が自然免疫系を開始し、活性化と動員につながります。好中球とマクロファージの増殖、および炎症誘発性サイトカイン、特にTNF-α、IL-1β、IL-6の産生(Bekeredjian-Ding et al。、2015; Giai et al。、2016; Zhao et al。、2016 )。炎症性サイトカインIL-6の分泌は、黄色ブドウ球菌の濃度の増加とともに増加することが報告されました(Chen et al。、2016)。さらに、スーパー抗原性黄色ブドウ球菌は、IL-17産生を刺激するのに特に効果的です(Islander et al。、2010)。この研究では、SIHP株はtst陰性SCHP株と比較してマクロファージのIL-2、IL-6およびIL-17Aの有意に高い誘導を示しました。これは、SIHP株がマクロファージの殺傷効果に対してサイトカインのより多くの分泌を誘導できることを示唆しています。さらに、MLST分析は、すべてのSIHP株がST5クローンに分類されたことを示しました。さらに、これらのSIHP株はt2460のスパタイプにグループ化されました(データは示していません)。
まとめると、SIHPは潜在的に高い病原性を持つMRSAの新しいサブセットである可能性があり、病院でのこれらの菌株の管理と治療。
著者の貢献
利害の対立に関する声明
著者は、研究が商業的なものがない状態で行われたことを宣言します。または潜在的な利益相反と解釈される可能性のある金銭的関係。
謝辞
この研究は、中国国立自然科学財団(81572032、81401636)、自然科学によってサポートされました。江蘇省の大学財団(16KJB320006)、および蘇州の科学技術プログラム(SYSD2014094、SYS201551、SS201638)。
臨床および実験室標準研究所(2014)。抗菌薬感受性試験のためのM100-S24性能基準; 24番目の情報補足。ペンシルベニア州ウェイン:CLSI。
Nandi、A。、およびBishayi、B。(2016)。食作用後に細胞内で生存した黄色ブドウ球菌は、TLR-2を標的として利用して、新鮮なマウス腹腔マクロファージに細胞毒性を誘発するのにより毒性があります。微生物。 Pathog。 97、131–147。 doi:10.1016 / j.micpath.2016.06.007
PubMed要約| CrossRef全文| Google Scholar
Wiseman、G。M.(1975)。黄色ブドウ球菌の溶血素。バクテリオール。 Rev. 39、317–344。
PubMed要約| Google Scholar