생리학의 경계
소개
동맥 압력 수용기는 혈류의 혈압 변화를 감지하는 최전선 센서 역할을합니다. 혈압의 변화는 동맥벽에 국한된 기계 민감성 신경 종말을 자극합니다. 기계적 힘은 신경 말단에서 전기 신호로 변환되어 압력 수용기 뉴런에서 압력 의존적 활동 전위가 발생합니다. 그런 다음 신경 신호는 혈압의 압력 반사 조절을 위해 뇌간에있는 심혈관 제어 센터로 전파됩니다 (Levy MN, 2007). 또한 중뇌 설형 문자 핵과 복부 내측 전두엽 피질을 포함한 수질 상 구조도 압력 반사 조절에 억제 역할을합니다 (Verberne et al., 1997).
동맥 압력 수용체에는 두 가지가 있습니다. 대동맥 압수 용기 및 경동맥 압수 용기는 각각 대동맥 궁과 경동맥의 외막 층에 위치합니다. 대동맥 압수 용기는 대동맥의 혈압을 감지합니다. 대동맥 압수 용기의 세포체 (소마)는 결절 신경절 (NG)에 있습니다 (그림 1). 대동맥 압수 용기 신경 말단에서 나오는 신경 신호는 대동맥 억제 신경 (ADN)이라는 감각 신경을 통해 결절 신경절로 전달됩니다 (그림 1). 경동맥 압수 용기는 뇌에 혈액을 공급하는 경동맥의 혈압을 감지합니다. 경동맥 압수 용기의 신경 말단은 내부 경동맥에 가까운 경동맥 분기점에 양측으로 위치합니다. 경동맥 압수 용기에서 나오는 신경 신호는 경동맥 부비동 신경 (CSN)을 따라 페트로 살 신경절 (PG)에 국한된 소마로 이동합니다. Petrosal 신경절은 경정 공 너머로 돌출되어 있습니다 (그림 1) (McDonald, 1983; Shoukas et al., 1991; Vander et al., 1998; Sato et al., 1999; Donnelly and Rigual, 2000; Weijnen et al., 2000) . 대동맥 압수 용기는 전체 전신 순환에 혈액을 공급하는 대동맥의 혈압을 감지하기 때문에 이러한 압수 용기는 전반적인 전신 혈압 유지에 중요한 기능적 역할을 할 것으로 예상됩니다. 반면에 경동맥 압수 용기는 뇌로 전달되는 혈액의 압력을 감지합니다. 이러한 압력 수용기는 안정적인 뇌 혈압과 뇌 혈류를 유지하는 데 더 중요 할 수 있습니다.
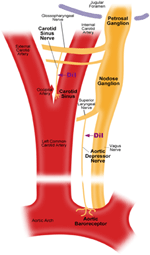
그림 1. 대동맥 및 경동맥 압력 수용기 말단과 신경의 개략도. 대동맥 및 경동맥 압수 용기 신경 말단, 신경 섬유 및 체세포 영역의 해부학 적 위치를 보여주는 다이어그램. 대동맥 압수 용기 터미널은 대동맥 궁에 있습니다. 구 심성 신경 섬유는 대동맥 억제 신경입니다. 소마는 결절성 신경절 (NG)에 있습니다. 경동맥 압력 수용체는 경동맥 분기 옆에있는 내부 경동맥에 위치합니다. 구 심성 신경은 경동맥 부비동 신경입니다. 소마는 석유 신경절 (PG)에 있습니다.
압수 용기, 대동맥 압수 용기 또는 경동맥에 대해 상충되는보고가 있습니다. 압력 수용체는 혈압 변화에 더 민감합니다. 일부 연구자들은 경동맥 압수 용기가 압력에 더 민감하다고보고 한 반면 (Donald and Edis, 1971; Fadel et al., 2003) 다른 사람들은 대동맥 압수 용기가 압력에 더 민감하다고 믿고 있습니다 (Glick and Covell, 1968; Pickering et al., 2008), 그리고 다른 사람들은이 두 압력 수용기 사이의 압력 민감도에 차이가 없다고보고했습니다 (Hainswor et al., 1970; James and Daly, 1970). 그러나 이러한 이전의 거의 모든 연구에서는 압력 수용기 민감도 분석의 종점으로 압력 반사 반응 (예 : 심박수 및 신장 교감 신경 활동) 만 사용했습니다. 대동맥 및 경동맥 압력 수용기 뉴런 자체의 압력 민감도를 직접 기록하고 비교하는 연구는 아직 없습니다.
여기서는 압력 수용기 뉴런 내부의 정수압을 변경하기 위해 고속 압력 클램프를 사용하여 측정했습니다. 전체 세포 패치 클램핑에 의한 이러한 뉴런의 상응하는 전기 생리 학적 반응. 우리는 또한 단축 스트레치 챔버를 사용하여 압력 수용체 뉴런을 늘리고 이러한 뉴런에서 세포질 Ca2 +의 해당 변화를 측정했습니다. 또한 생체 내 동물 연구를 위해 대동맥 및 경동맥 압수 용기의 감각 신경 인 대동맥 억압 기 및 경동맥 부비동 신경에서 압력 유발 활동 전위 발사를 측정했습니다.
재료 및 방법
재료 및 방법
동물
모든 동물 실험은 홍콩 SAR 정부에서 발급 한 라이선스와 홍콩 중문 대학 동물 실험 윤리위원회의 승인을 받아 수행되었습니다.수컷 Sprague-Dawley (S / D) 쥐 (180 ~ 200g)는 홍콩 중국 대학교의 실험실 동물 서비스 센터에서 제공했습니다.
1 차 배양
S / D 쥐는 펜토 바르 비탈 나트륨 (100 mg / kg)으로 마취되었습니다. 좌측 경부 부위는 멸균 된 상태에서 중간 선 절개로 노출되었습니다. 그림 1에서 보는 바와 같이 대동맥 저 신경이나 경동맥 동 신경이 노출되었고 2 ~ 3mm의 신경이 둔부 절제를 통해 주변 조직에서 조심스럽게 분리되었다. 형광 친 유성 추적자 1,1-dioctadecyl-3,3,3 ‘, 3’-tetramethylindocarbocyanine (DiI) 결정 (Invitrogen)을 신경 주위에 적용하고 Kwik-Sil (World Precision Instruments, USA)로 덮었습니다. 절개는 나중에 봉합되었습니다. 쥐는 5 ~ 7 일 동안 회복되어 DiI 염료가 각각 결절 신경절 또는 석유 신경절에 위치한 소마 타로 대동맥 억제 신경 또는 경동맥 부비동 신경을 따라 역행 적으로 확산되도록했습니다.
결절 또는 석유 신경절 뉴런은 DiI- 표지 된 쥐로부터 분리되었고 얼음처럼 차가운 EBSS에서 조각으로 잘렸다. 트립신 (1mg / ml) 및 콜라게나 아제 IA (1mg / ml)로 37 ° C에서 1 시간 동안 소화시켰다. 단일 뉴런은 Glass Pasteur 피펫으로 부드럽게 분쇄 한 다음 원심 분리하여 분산시켰다. 뉴런을 재현 탁하고 5 % FBS, 1 % 항생제 항진균제 및 7S NGF (100 ng / ml)가 보충 된 DMEM / F-12 배지에서 배양했습니다. 분열하는 세포의 성장을 억제하기 위해 Cytosine arabinofuranoside (Ara-C; 10 μM)를 배양 배지에 포함시켰다. 뉴런은 실험 전에 적어도 3 일 동안 배양되었다. 활동 전위 기록을 위해, 뉴런을 새로 분리하고 실험 최소 30 분 전에 F12에서 배양했습니다. 모든 실험에서, 실리콘 챔버가 2 % 젤라틴으로 사전 코팅 된 세포 신장 실험을 제외하고 0.1 mg / ml 폴리 -L- 라이신으로 사전 코팅 된 유리 슬라이드에서 세포를 배양했습니다.
패치 클램프
전체 셀 전류 클램프 기록은 EPC7 패치 클램프 증폭기 (독일 HEKA)에 의해 달성되었습니다. 저항이 3–5 MΩ 인 패치 피펫에 피펫 용액 (mM 단위)을 채웠습니다 : 130 K-gluconate, 10 KCl, 2 MgCl2, 2 Na2ATP, 0.4 Tris GTP, 1 EGTA, 10 HEPES, pH 7.25-7.3 by KOH. 세포를 인공 뇌척수액 (ACSF) (mM) : 120 NaCl, 2 KCl, 1.2 MgSO4 · 7H2O, 1.2 KH2PO4, 26 NaHCO3, 2.5 CaCl2, 11 포도당, 카 보겐 (95 % O2 및 5 % CO2). 현재 클램프 기록에서 세포는 휴지 막 전위에서 유지되었습니다. 고속 압력 클램프 시스템 (HSPC-1, ALA Scientific Instruments, USA)을 사용하여 마이크로 피펫을 통해 세포에 양압을 제공했습니다. 녹음은 50kHz로 샘플링되고 5kHz로 필터링되었습니다. PulseFit (HEKA)로 데이터를 분석했습니다. 모든 실험은 실온에서 수행되었습니다.
칼슘 이미징
Cytosolic Ca2 + 측정은 다른 곳에서 설명한대로 수행되었습니다 (Wong et al., 2010). 간단히 말해서, 세포에 5μM Fluo-4 / AM을 40 분 동안로드했습니다. 세포질 Ca2 + 측정은 HEPES 완충 용액 (mM 단위) : 140 NaCl, 2.5 KCl, 1 MgCl2, 1 CaCl2,10 HEPES, 10 포도당, pH 7.4로 NaOH를 사용하여 수행되었습니다. 단축 신장에 대한 세포질 Ca2 + 변화는 STREX 세포 신장 시스템 (ST-150, B-Bridge International, Inc.)을 사용하여 수행되었습니다. 세포는 1 초 동안 10, 20 또는 30 %의 단방향 스트레치에 의해 자극되었습니다. Cytosolic Ca2 + 반응은 실온에서 측정되었습니다. Fluo-4 형광은 FV1000 레이저 스캐닝 공 초점 이미징 시스템에 의해 기록되고 분석되었습니다. 세포질 Ca2 + 형광 반응의 변화는 실시간 형광의 비율 (Fx / F0)로 표현되었으며, 여기서 Fx는 실시간 fluo-4 / AM 신호이고 F0은 스트레치 전 기준선 fluo-4 / AM 신호입니다. / p>
신경 활동 기록
쥐를 100mg / kg 펜토 바르 비탈 나트륨으로 마취했습니다. 자궁경 부는 정중선 절개로 노출되었습니다. 오른쪽 경동맥은 혈압 기록을 위해 압력 변환기 (ML221, ADInstruments, USA)에 연결된 카테터에 의해 분리되고 캐 뉼러로 삽입되었습니다. 왼쪽 대퇴 정맥은 페닐에 프린 및 SNP 주사를 위해 캐 뉼러를 꽂았습니다. 왼쪽 대동맥 강압 신경 또는 경동맥 부비동 신경을 양극성은 전극에 연결 한 다음 증폭기 (Model 1700 Differential AC Amplifier, A-M Systems Inc., USA)를 연결했습니다. 혈압과 신경 활동은 차트 5.0 (AD Instruments)에 의해 지속적으로 기록되었습니다. 신경 활동은 10,000 번 증폭되었고 100–5000 Hz의 대역 통과에서 여과되었습니다. 페닐에 프린에 대한 평균 동맥압, 심박수 및 스파이크 빈도의 값은 차트 5.0 소프트웨어로 분석되었습니다. 페닐에 프린 주사시 최대 혈압 변화 (페닐에 프린 후 평균 동맥 혈압-페닐에 프린 전 평균 동맥 혈압)에 대한 스파이크 빈도 (페닐에 프린 후 스파이크 빈도-페닐에 프린 전 스파이크 빈도)의 변화를 계산했습니다 (Lau et al., 2016). .
통계 분석
대표적 추적은 시간 경과 추적으로 표시되었습니다. 모든 실험의 데이터는 개별 실험의 평균 ± sem으로 표현 된 막대 차트로 요약되었습니다. 통계 분석에는 Student ‘s t-test가 사용되었습니다. 적절한 경우 Pairwise t-test가 사용되었습니다.
결과
대동맥 억제 뉴런 및 경동맥 부비동 뉴런의 속성
Dil은 대동맥 억제 신경 또는 경동맥 부비동 신경에 적용되었습니다. 따라서 결절 신경절의 Dil 표지 뉴런에는 대동맥 궁을 자극하는 압력 수용 뉴런과 대동맥을 자극하는 화학 수용 뉴런이 포함됩니다. 반면에 Dil 표지 뉴런은 석유 신경절에는 경동맥을 자극하는 압력 수용 뉴런과 경동맥을 자극하는 화학 수용 뉴런이 포함됩니다. 먼저 이러한 Dil-label 뉴런의 기본 특성을 조사했습니다. 결절과 석유 신경절의 DiI 표지 뉴런을 별도로 배양하고 다음과 같은 탈분극 전류를가했습니다. 두 가지 유형의 응답이 기록되었습니다. 하나는 단일 활동 전위로 응답하고 다른 하나는 탈분극 전류 후 연속 활동 전위로 응답했습니다 (그림 2) (Belmonte and Gallego, 1983). 이러한 뉴런은 정수압 변화에 대한 민감도를 테스트하기 위해 정수압 프로토콜을 적용했습니다. 활동 전위가 유도 될 때까지 고속 압력 클램프 시스템 (HSPC-1, ALA Scientific Instruments, USA)에 의해 유리 마이크로파이 펫을 통해 양의 정수압 램프를 세포 내로 적용했습니다. 결과는 대동맥 압수 용기 뉴런의 45 %가 탈분극 전류에 반응하여 연속 활동 전위를 발생시키는 것으로 나타났습니다 (표 1A). 그중 91 % (41 % / 45 %)도 정수압 변화에 반응했으며 압력에 따른 활동 전위 발화를 보였습니다 (표 1A). 대동맥 압수 용기 뉴런의 나머지 55 %는 탈분극 전류 (표 1A)에 반응하여 단일 활동 전위 만 발사했으며, 그중 40 % (22 % / 55 %)는 압력 변화에 반응 할 수 있습니다 (표 1A). 경동맥 압수 용기 뉴런의 경우 세포의 45 %가 탈분극 전류에 의해 자극되었을 때 연속적인 활동 전위를 나타 냈습니다 (표 1B). 이 중 82 % (37 % / 45 %)도 압력 변화에 민감했습니다 (표 1B). 또한 탈분극 전류에 반응하여 단일 활동 전위 만 발화 한 경동맥 압력 수용기 뉴런 중 24 % (13 % / 55 %)가 압력 변화에 반응 할 수 있습니다 (표 1B).
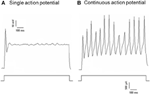
그림 2. 배양 된 대동맥 억 제기 및 경동맥 부비동 뉴런의 활동 전위 기록. 탈분극 전류에 따라 2 개의 대표적인 대동맥 억압자 / 경동맥 부비동 뉴런에서 기록 된 활동 전위의 흔적이 표시됩니다. (A) 현재 자극시 단일 활동 전위 만 발사하는 대표적인 뉴런; (B) 현재 자극시 연속 활동 전위 만 발사하는 대표적인 뉴런. 하단 패널 : 현재 주입을위한 프로토콜. 스케일 바, 수평, 100ms, 수직, 10mV (상단 트레이스) 및 500pA (하단 트레이스). n = 27 및 n = 38 (각각 대동맥 억 제기 및 경동맥 신경 세포)

표 1. 대동맥 억 제기 및 경동맥 부비동 뉴런의 특성.
단일 활동 전위를 발사하든 연속 활동 전위를 발사하든 상관없이, Dil 표지 된 대동맥 압수 용기 뉴런의 63 %가 압력 변화에 민감한 것으로 밝혀졌지만 Dil 표지 된 경동맥 압력 수용기 뉴런의 50 %만이 압력 변화 (표 1).
대동맥 및 경동맥 압수 용 뉴런의 스트레치 감도
활동 전위 방전에 대한 압력 임계 값을 분석했습니다. 그림 3에서 볼 수 있듯이 대동맥 압력 수용 뉴런은 경동맥 압력 수용 뉴런 (39 ± 4 mmHg)보다 낮은 압력 임계 값 (24 ± 4 mmHg)을 가졌습니다.

그림 3. 정수압에 대한 대동맥 및 경동맥 압력 수용기 뉴런의 민감도. (A, B) 상부 패널, 대동맥 (A) 및 경동맥 (B) 압력 수용기 뉴런에서 압력 의존 활동 전위 발사를 보여주는 대표적인 시간 코스 추적. 압력 램프 (하부 패널)는 고속 압력 클램프 시스템 (HSPC)을 사용하여 마이크로파이 펫을 통해 세포 내부에 적용되었습니다. 스케일 바 수평, 1 초, 수직, 20mV 및 20mmHg. (C) 대동맥 및 경동맥 압력 수용기 뉴런에서 활동 전위 발사를 시작하는 압력 임계 값을 보여주는 요약. 대동맥 압수 용기 뉴런의 경우 n = 13이고 경동맥 압수 용기 뉴런의 경우 n = 15. *** p < 0.01, Student ‘s t-test.
압수 용기 뉴런의 스트레치 유도 Ca2 + 반응
배양 된 대동맥 억제 또는 경동맥 부비동 뉴런을 STREX Cell Stretching System에 의한 단축 스트레칭의 10, 20 또는 30 %, 혈압 하에서 늘어나는 혈관을 모방합니다. 결과는 20 %의 단축 신장이 대동맥 압력 수용기 뉴런에서 세포질 Ca2 + 형광을 현저하게 증가 시켰지만 경동맥 압력 수용기 뉴런에서는 그렇지 않음을 보여주었습니다 (그림 4A–C). 더욱이, 30 % 단축 신장에 대한 Ca2 + 형광의 크기는 경동맥 압력 수용기 뉴런보다 대동맥 압력 수용기 뉴런에서 훨씬 더 높았습니다 (그림 4A–C).
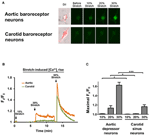
그림 4. 단축 스트레칭에 대한 대동맥 억 제기 및 경동맥 부비동 뉴런의 민감도. 세포는 Ca2 +-민감성 형광 염료 Fluo-4 / AM으로 로딩되었다. 대동맥 억 제기 및 경동맥 부비동 뉴런에서 세포 길이의 10, 20 및 30 %의 단축 신장에 반응하여 상대적인 세포질 Ca2 + 상승의 대표적인 이미지 (A) 및 시간 경과 추적 (B)이 표시됩니다. (C) 다른 정도의 스트레치에 반응하여 최대 세포질 Ca2 + 상승의 요약. 세포질 Ca2 +의 변화는 Fx / F0로 표현되었으며, 여기서 Fx는 실시간 fluo-4 / AM 신호이고 F0은 스트레칭 전 기준선 fluo-4 / AM 신호입니다. 평균 ± s.e.m. (n = 5). * p < 0.05, *** p < 쌍별 t- 검정에 의해 해당 대조군과 비교하여 0.01.
in vivo 압력 수용기 신경 활동
두 압력 수용기의 신경 활동은 in vivo에서 조사되었습니다. 페닐에 프린은 정맥 주사되었습니다. 페닐에 프린 적용시 혈압의 변화는 그림 5A, B의 상단 패널에 표시됩니다. 압력 수용기 신경 활동의 하위 시퀀스 변화는 하단 패널에 표시됩니다 (그림 5A, B). 압력 유도 신경 활동은 경동맥 부비동 신경보다 대동맥 억제 신경에서 훨씬 더 높았습니다 (그림 5A, B). mmHg 증가 당 스파이크 주파수의 변화는 그림 5C에 요약되어 있습니다. 결과는 대동맥 압수 용기가 생체 내 경동맥 압수 용기보다 정수압에 더 민감하다는 것을 나타냅니다.
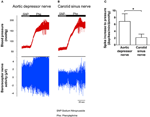
그림 5. 쥐의 생체 내 압력 수용기 신경 활동. (A, B) 혈압 상승시 대동맥 강압 신경 (A) 및 경동맥 부비동 신경 (B) 활동의 변화를 보여주는 대표적인 추적. 두 (A, B)에서 상단 패널은 수평 막대로 표시된 바와 같이 Phe 적용 전후의 혈압 변화였습니다. 아래쪽 패널은 신경 활동의 해당 변화였습니다. (C) 혈압 변화 단위당 신경 활동의 변화를 보여주는 요약 데이터. 평균 ± s.e.m. (n = 8). * p < 대동맥 압수 용기의 대조군과 비교했을 때 pairwise t-test에 의해 0.05.
TRP 채널 표현
TRPC1, -C3, -C5, -C6, -V1, -V4, -P2 (O)를 포함하여 여러 TRP 채널이 기계에 민감한 것으로보고되었습니다. “Neil and Heller, 2005; Christensen and Corey, 2007; Pedersen and Nilius, 2007; Patel et al., 2010; Lau et al., 2016). 여기에서 우리는 대동맥과 관련하여 이러한 기계 민감성 TRP 채널의 가능한 역할을 조사했습니다. 및 경동맥 압력 수용체 감수성. 이러한 채널의 nodose와 petrosal ganglion에서 mRNA 발현을 비교 한 결과 TRPV4와 TRPC6의 발현은 petrosal ganglion에 비해 nodose ganglion에서 더 높게 나타났습니다 (그림 6). 결절 신경절에서 기계 민감성 채널의 발현은 더 높은 민감도에 기여할 수 있습니다.
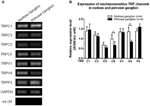
그림 6. 표현 nodose 및 petrosal ganglion의 mechanosensitive TRP 채널. (A) 기계 민감성 TRP 채널 (TRPC1, -C3, -C5, -C6, -V1, -V4, -P2)의 mRNA 발현 수준을 결절과 석유 신경절 뉴런 사이에서 비교 한 대표적인 겔 이미지. 반 정량적 RT-PCR 분석을 사용하여 GAPDH mRNA 발현과 관련된 여러 TRP 채널의 mRNA 발현 수준을 비교했습니다. 9 개의 실험 결과는 (B)에 요약되어 있습니다. 값은 평균 ± sem이었습니다. * p < 0.05, 쌍별 t- 검정.
토론
본 연구에서는 대동맥 압 수용체와 경동맥 압 수용체의 기계적 감수성을 비교 하였다. 전체 세포 패치 클램프 연구는 경동맥 부비동 뉴런과 비교하여 더 높은 비율의 대동맥 억제 뉴런이 스트레치에 민감하다는 것을 보여주었습니다. 또한, 활동 전위 발사를 시작할 수있는 압력 임계 값은 경동맥 압력 수용기 뉴런에서보다 대동맥 압력 수용기 뉴런에서 더 낮은 것으로 밝혀졌습니다. 단축 신장에 의해 유도 된 세포질 Ca2 + 상승은 또한 대동맥 억압자와 경동맥 부비동 뉴런 사이에서 비교되었습니다.단축 신장에 대한 반응으로 세포질 Ca2 + 상승의 크기는 경동맥 압력 수용기 뉴런에서보다 대동맥 압력 수용기 뉴런에서 훨씬 더 높았다. 대동맥 압수 용기 뉴런은 또한 단축 스트레치에 대한 세포질 Ca2 + 반응의 더 낮은 임계 값을 나타냈다. 다른 일련의 실험에서, 우리는 압력에 의한 활동 전위 발사의 증가가 경동맥 부비동 신경보다 대동맥 억제 신경에서 더 높음을 발견했습니다. 종합하면, 우리의 데이터는 대동맥 압력 수용기가 경동맥 압력 수용체보다 혈압에 더 민감하다는 강력한 증거를 제공합니다.
이전에는 두 압력 수용기 간의 민감도 차이를 이해하기 위해 많은 노력을 기울였습니다. 그러나 그 결과는 논란의 여지가 있습니다. 일부 보고서는 대동맥 압수 용기가 압력 변화에 더 민감하다는 결론을 내렸지 만 (Glick and Covell, 1968; Fan et al., 1996; Pickering et al., 2008), 다른보고에서는 경동맥 압수 용기가 압력 변화에 더 민감하다고 말했습니다 (Donald 및 Edis, 1971; Fadel et al., 2003). 그러나 이러한 이전 연구의 거의 대부분은 매우 복잡한 수술 절차를 포함했으며 궁극적으로 압력 수용기 민감도 분석의 종점으로 심박수 및 신장 교감 신경 출력과 같은 압력 반사 반응을 활용했습니다. 복잡한 수술 절차는 실험적 오류를 유발하는 경향이 있으며 이는 논란의 여지가있는 결론을 초래할 수 있습니다. 또한, 압 수용체 민감도의 동물 종 의존적 변화도 가능합니다. 더욱이 압력 반사 반응은 압력 수용체 민감성뿐만 아니라 신경 전도, 중추 매개, 혈관 수축 및 심장 기능을 포함한 여러 다른 요인의 영향을받습니다. 따라서 이전 연구의 증거는 간접적이며 이상적이지 않습니다. 현재까지 대동맥 압력 수용 뉴런과 경동맥 압력 수용 뉴런의 압력 민감도를 비교하는 직접적인 연구가 부족합니다. 이 연구에서는 압력 수용 뉴런에서 직접 기계 감수성을 연구했습니다. 이 데이터는 대동맥 압수 용기가 경동맥 압수 용기보다 압력에 더 민감하다는 것을 강력하게 시사합니다. 이 정보는 혈압 조절에 중요한 생리 학적 관련성을 가질 수 있습니다.
대동맥 압력 수용체와 경동맥 압력 수용체 사이의 압력 민감도 차이의 기초가되는 메커니즘이 무엇인지 명확하지 않습니다. 우리는 여러 기계 민감성 TRP 채널의 발현 수준을 비교했습니다 (그림 6) (O “Neil and Heller, 2005; Christensen and Corey, 2007; Pedersen and Nilius, 2007; Patel et al., 2010). 우리의 결과는 대동맥 압수 용기 뉴런이 TRPV4 및 TRPC6을 포함한 여러 기계 민감성 TRP 채널의 발현이 더 높습니다. TRPV4 및 / 또는 TRPC6의 높은 발현이 대동맥 압력 수용체의 높은 압력 민감도에 기여할 수 있습니다. 이러한 이온 채널의 역할을 확인하려면 추가 연구가 필요합니다.
결절 신경절과 석유 신경절에는 두 가지 유형의 뉴런이 포함되어 있다고보고 된 바 있습니다 (Belmonte and Gallego, 1983). 그중 하나는 전기 자극시 지속적인 활동 전위를 제공하는 반면 다른 하나는 단일 활동을 제공합니다. 저자는 전자를 압력에 민감한 뉴런으로 할당하고 후자를 화학에 민감한 뉴런으로 할당했습니다. 탈분극 전류에 반응하여 단일 활동 전위를 발화하는지 또는 연속 활동 전위를 발화하는지에 따라 압력에 민감한 뉴런과 압력에 민감한 뉴런을 할당합니다. 사실, 전기 자극에 반응하여 단일 활동 전위를 발화하는 많은 비율의 세포도 압력에 민감하므로 압력 감지 압력 수용기 뉴런에 속합니다 (그림 2 및 표 1).
요약하면, 본 연구는 대동맥 압수 용기가 경동맥 압수 용기보다 압력에 더 민감하다는 증거를 제공하고 기본 생리학의 이해에 새로운 정보를 추가합니다.
저자 기여
EL XY는 실험을 설계하고 원고 초안을 작성합니다. EL, CL 및 YY는 실험을 수행합니다. XY, YH, AM, LJ는 원고를 수정했습니다. 모든 저자가 원고의 최종 버전을 승인했습니다.
기금
이 작업은 홍콩 연구 보조금위원회 CUHK478710, CUHK478413, AoE / M-05 / 12, TBRS / T13-706 / 11, 중국 국립 과학 재단 보조금 31470912 및 RGC-NSFC 공동 보조금 N_CUHK439 / 13.
이해 상충 성명
저자는 연구가 수행되었다고 선언합니다. 잠재적 인 이해 상충으로 해석 될 수있는 상업적 또는 재정적 관계가없는 경우.
James, JEA 및 Daly, MDB (1970). 개의 박동성 및 비박 동성 압력에 의한 경동맥 및 대동맥 궁 압수 용기의 개별 및 결합 된 자극에 대한 반사 혈관 운동 반응의 비교. J. Physiol. 209, 257–293. 도이 : 10.1113 / jphysiol. 1970.sp009165
PubMed 요약 | CrossRef 전체 텍스트 | Google 학술 검색
Levy MN, P. A. (2007). 심혈관 생리학. 펜실베이니아 주 필라델피아 : 모스 비 엘스 비어.
Vander, A. J., Sherman, J. H. 및 Luciano, D. S. (1998). 인간 생리학 : 신체 기능의 메커니즘. 매사추세츠 주 보스턴 : WCB McGraw-Hill.