물리적 지질학
지각의 암석을 구성하는 대부분의 광물은 규산염 광물입니다. 여기에는 석영, 장석, 운모, 각섬석, 파이 록센, 감람석 및 다양한 점토 광물과 같은 광물이 포함됩니다. 이 모든 광물의 구성 요소는 4 개의 산소 원자와 1 개의 실리콘 원자의 조합 인 실리카 사면체입니다. 이들은 산소 원자를 통해 그려진 평면이 4 면체를 형성하도록 배열됩니다 (그림 2.6). 실리콘 이온의 전하가 +4이고 4 개의 산소 이온이 각각 -2의 전하를 갖기 때문에 실리카 사면체는 -4의 순 전하를 갖습니다.
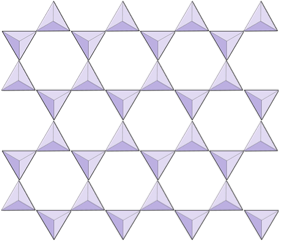
규산염 광물에서 이러한 사면체는 배열됩니다. 단일 단위에서 복잡한 프레임 워크에 이르기까지 다양한 방식으로 함께 연결됩니다 (그림 2.9). 미네랄 감람석의 가장 단순한 규산염 구조는 철 및 / 또는 마그네슘 이온에 결합 된 분리 된 사면체로 구성됩니다. 감람석에서 각 실리카 사면체의 -4 전하는 2가 (즉, +2) 철 또는 마그네슘 양이온으로 균형을 이룹니다. Olivine은 Mg2SiO4 또는 Fe2SiO4 또는 두 가지 (Mg, Fe) 2SiO4의 조합 일 수 있습니다. 마그네슘과 철의 2가 양이온은 반경이 매우 가깝습니다 (0.73 대 0.62 옹스트롬). 이러한 크기의 유사성과 둘 다 2가 양이온 (둘 다 +2의 전하를 가짐)이기 때문에 철과 마그네슘은 감람석과 다른 많은 미네랄에서 서로를 쉽게 대체 할 수 있습니다.
| 사면체 구성 | 예시 미네랄 | |
|---|---|---|
 |
분리 (네소 실리케이트) | 올리바 인, 가넷, 지르콘, 카야 나이트 |
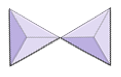 |
쌍 (소로 실리케이트) | 에피도 테, 조이 사이트 |
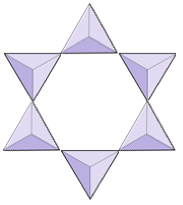 |
링 (사이클로 실리케이트) | 토르마린 |
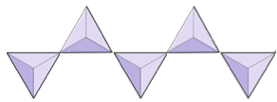 |
단일 사슬 (이노 실리케이트) | 파이 록센, 규회석 |
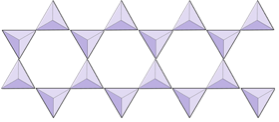 |
이중 사슬 (이노 실리케이트) | 각섬석 |
 |
시트 (phyllosilicates) | 운모, 점토 광물, 사문석, 아 염소산염 |
| 3 차원 구조 | 프레임 워크 (텍토 실리케이트) | 장석, 석영, 제올라이트 |
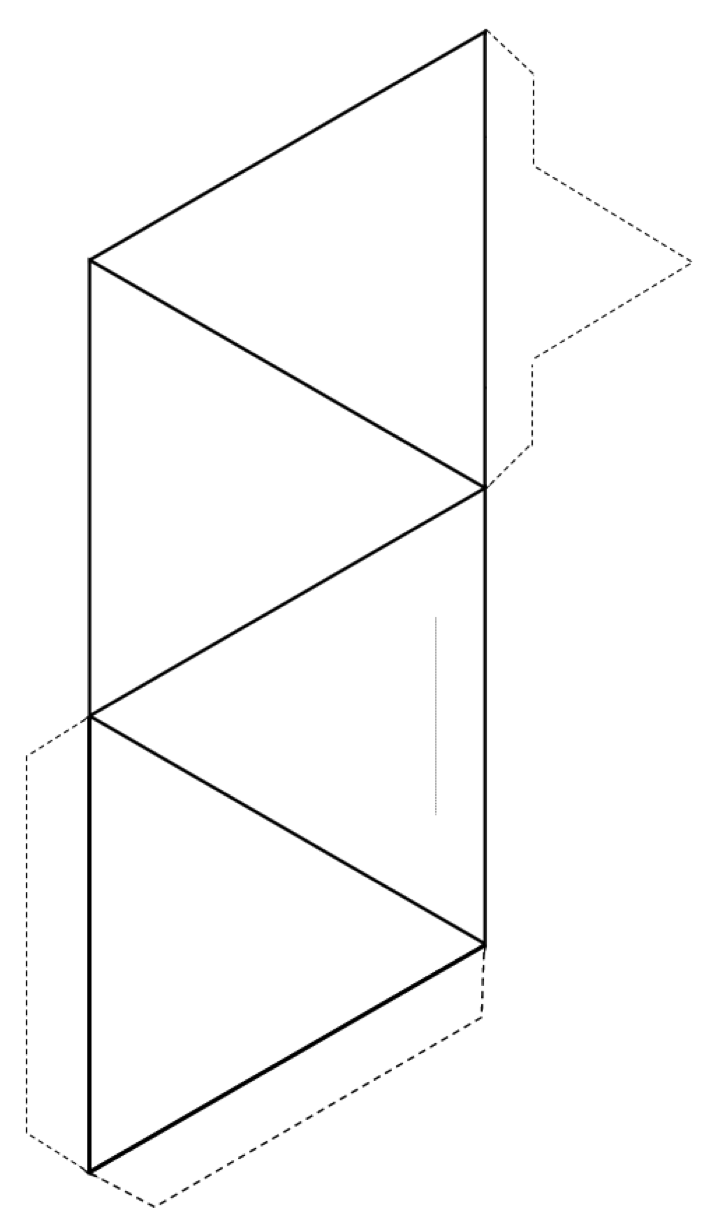
연습 2.3 사면체 만들기
모양의 바깥 쪽 (실선 및 점선)을 자른 다음 실선을 따라 접어 4 면체를 만듭니다.
풀이나 테이프가있는 경우 탭을 정사면체에 연결합니다. 풀이나 테이프가없는 경우 얇은 회색 선을 따라 슬라이스를 만들고 뾰족한 탭을 슬릿에 삽입합니다.
교실에서이 작업을 수행하는 경우 다른 사람과 함께 4 면체를 결합 해보십시오. 쌍, 고리, 단일 및 이중 사슬, 시트 및 심지어 3 차원 프레임 워크.
올리 빈에서는 대부분의 다른 규산염 광물과 달리 실리카 사면체가 각각에 결합되지 않습니다. 다른. 그러나 그림 2.10과 같이 철 및 / 또는 마그네슘에 결합되어 있습니다.
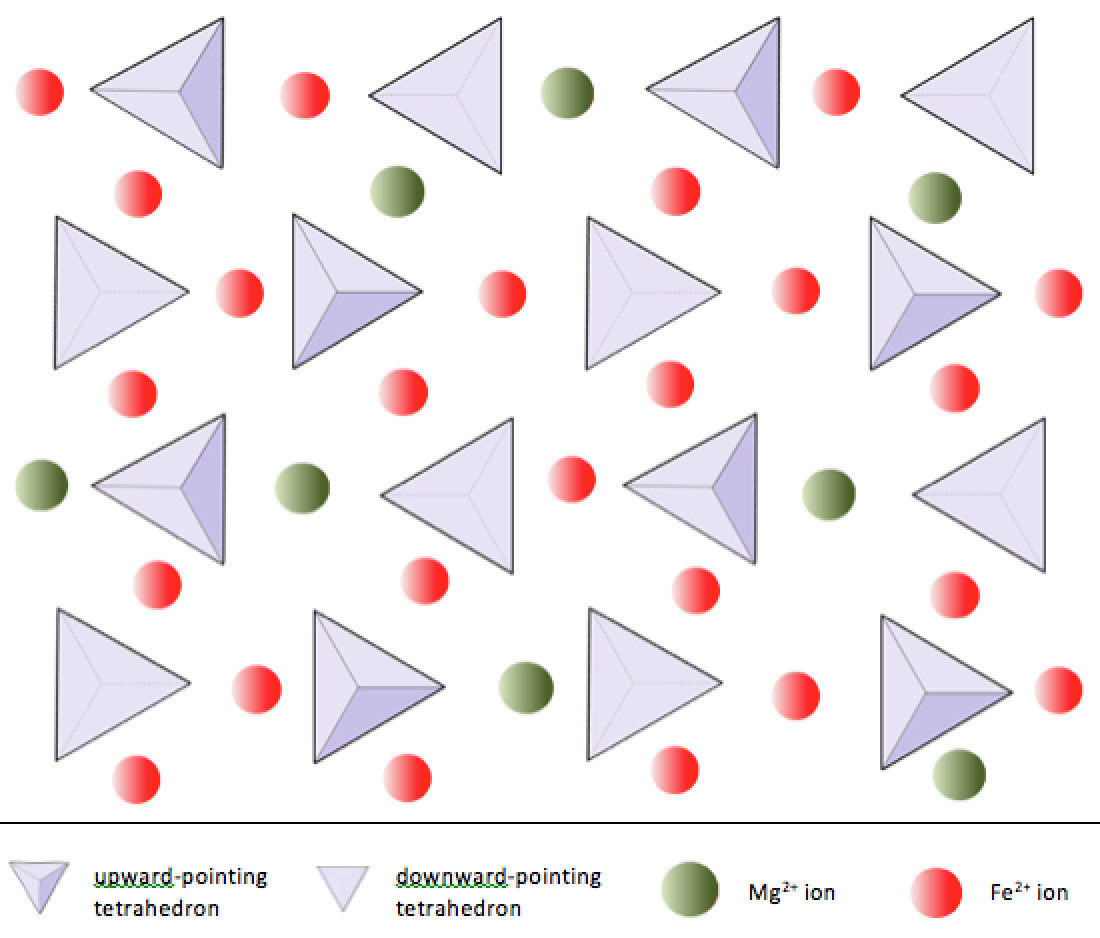
이미 언급했듯이 철과 마그네슘의 +2 이온은 크기가 비슷합니다 (비록 같지는 않지만). 이를 통해 일부 규산염 광물에서 서로를 대체 할 수 있습니다. 사실, 규산염 광물의 공통 이온은 그림 2.11에 표시된 것처럼 다양한 크기를 가지고 있습니다. 산소를 제외한 모든 이온은 양이온입니다. 철은 +2 이온 (이온화 중에 2 개의 전자를 잃는 경우) 또는 +3 이온 (3 개를 잃는 경우) 모두로 존재할 수 있습니다. Fe2 +는 철로 알려져 있습니다. Fe3 +는 철로 알려져 있습니다. 이온 반경은 규산염 광물의 구성에 매우 중요하므로이 다이어그램을 다시 참조하겠습니다.

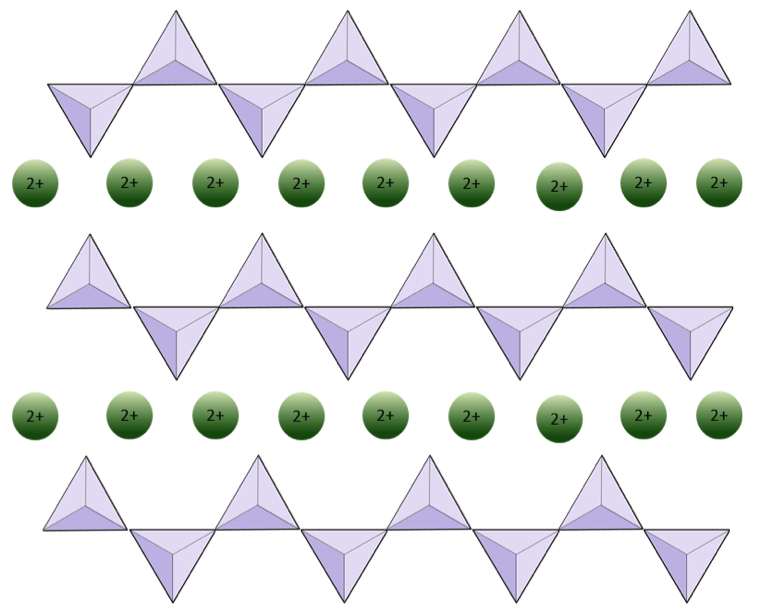
단일 사슬의 구조 규산염 파이 록센은 그림 2.12 및 2.13에 나와 있습니다. 파이 록센에서 실리카 사면체는 단일 사슬로 함께 연결되어 각 사면체의 하나의 산소 이온이 인접한 사면체와 공유되므로 구조에 산소가 적습니다.그 결과 산소-실리콘 비율은 감람석보다 낮고 (4 : 1 대신 3 : 1), 더 적은 양이온이 필요하기 때문에 실리콘 원자 당 순 전하는 더 적습니다 (-4 대신 -2). 그 요금의 균형을 유지합니다. 파이 록센 조성물은 MgSiO3, FeSiO3 및 CaSiO3 유형 또는 이들의 일부 조합입니다. Pyroxene은 (Mg, Fe, Ca) SiO3로도 쓸 수 있으며, 여기서 괄호 안의 요소는 어떤 비율로도 존재할 수 있습니다. 즉, 파이 록센은 각 실리카 사면체 (예 : MgSiO3)에 대해 하나의 양이온을 가지고있는 반면 감람석은 두 개 (예 : Mg2SiO4)를 가지고 있습니다. 각 실리콘 이온이 +4이고 각 산소 이온이 -2이기 때문에 3 개의 산소 (-6)와 하나의 실리콘 (+4)은 단일 사면체 실리카 사슬에 대해 -2의 순 전하를 제공합니다. 파이 록센에서 사면체 당 하나의 2가 양이온 (2+)은 -2 전하의 균형을 이룹니다. 감람석에서는 분리 된 사면체의 -4 전하를 균형있게 맞추기 위해 두 개의 2가 양이온이 필요합니다.
피 록센의 구조는 감람석의 구조보다 “관용적”입니다. 즉, 더 넓은 범위의 이온 반경을 가진 양이온 이것이 바로 파이 록센이 철 (반지름 0.63Å), 마그네슘 (반경 0.72Å) 또는 칼슘 (반경 1.00Å) 양이온을 가질 수있는 이유입니다.
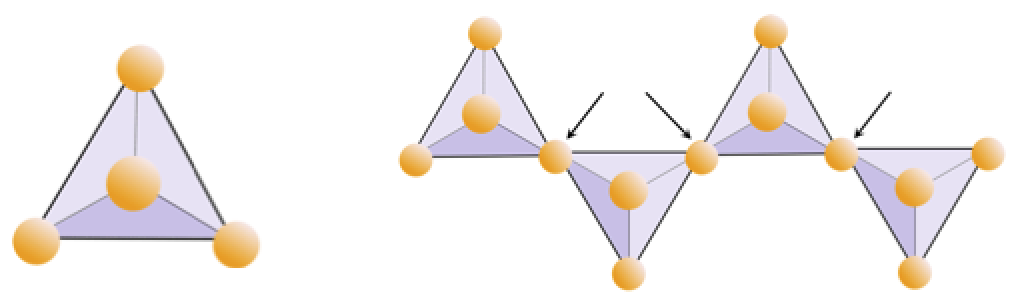
운동 2.4 산소 부족
아래 다이어그램은 규산염 광물의 단일 사슬을 나타냅니다. 4 면체의 수와 산소 이온의 수 (노란색 구체)를 계산합니다. 각 사면체에는 하나의 실리콘 이온이 있으므로 단일 사슬 규산염 (예 : 파이 록센)에서 Si 대 O의 비율을 제공해야합니다.
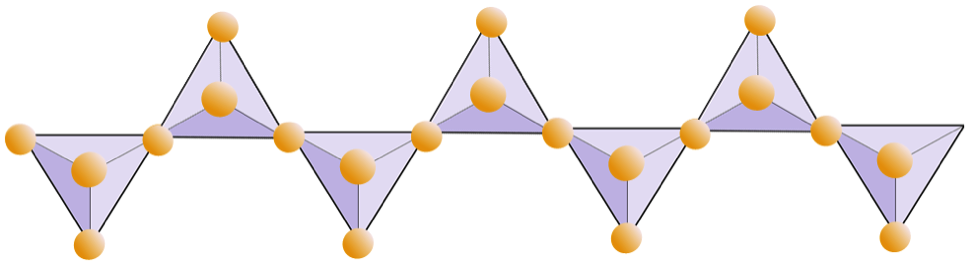
아래 그림은 규산염 광물의 이중 사슬을 나타냅니다. 다시 말하지만, 4 면체의 수와 산소 이온의 수를 세십시오. 이것은 이중 사슬 규산염 (예 : 각섬석)에서 Si와 O의 비율을 제공합니다.
각섬석 구조에서 실리카 사면체는 파이 록센보다 낮은 산소 대 실리콘 비율을 가진 이중 사슬로 연결되어 있기 때문에 전하 균형을 맞추기 위해 더 적은 양이온이 필요합니다. 각섬석은 파이 록센보다 훨씬 더 관대하며 그 구성은 매우 복잡 할 수 있습니다. 예를 들어 Hornblende는 나트륨, 칼륨, 칼슘, 마그네슘, 철, 알루미늄, 실리콘, 산소, 불소 및 하이드 록실 이온 (OH–)을 포함 할 수 있습니다.
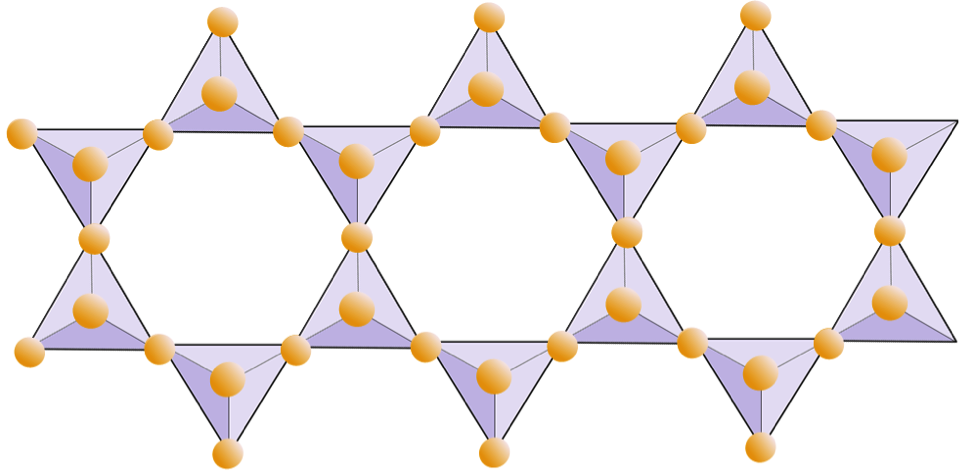
운모 구조에서 실리카 사면체는 연속 시트로 배열되며 각 사면체는 인접한 사면체와 3 개의 산소 음이온을 공유합니다. 인접한 사면체간에 산소를 더 많이 공유하므로 시트 규산염 광물에 필요한 전하 균형 양이온이 더 적습니다. 시트 사이의 결합은 상대적으로 약하며 이는 잘 발달 된 단방향 절단을 설명합니다 (그림 2.14). 흑운모 운모는 철 및 / 또는 마그네슘을 포함 할 수 있으며, 따라서 페로 마그네 시안 규산염 광물 (올리 빈, 파이 록센 및 각섬석 등)이됩니다. Chlorite는 일반적으로 마그네슘을 포함하는 또 다른 유사한 미네랄입니다. 백운모에서 존재하는 유일한 양이온은 알루미늄과 칼륨입니다. 따라서 비 페로 마그네시아 규산염 광물입니다.

백운모, 흑운모 및 아 염소산염을 제외하고 다른 많은 시트 규산염 (또는 필로 실리케이트)이 있습니다. 일반적으로 점토 크기의 조각으로 존재합니다 (즉, 0.004mm 미만). 여기에는 점토 광물 인 카올리나이트, 일 라이트 및 스멕타이트가 포함되며, 크기가 매우 작아 연구하기는 어렵지만 암석, 특히 토양의 매우 중요한 구성 요소입니다.
모든 시트 규산염 미네랄은 구조에 물도 있습니다.
실리카 사면체는 장석과 석영 모두에서 3 차원 구조로 결합되어 있습니다. 이들은 페로 마그네시아가 아닌 미네랄이며 철이나 마그네슘을 포함하지 않습니다.실리카 사면체 외에도 장석에는 양이온 알루미늄, 칼륨, 나트륨 및 칼슘이 다양한 조합으로 포함됩니다. 석영에는 실리카 사면체 만 포함되어 있습니다.
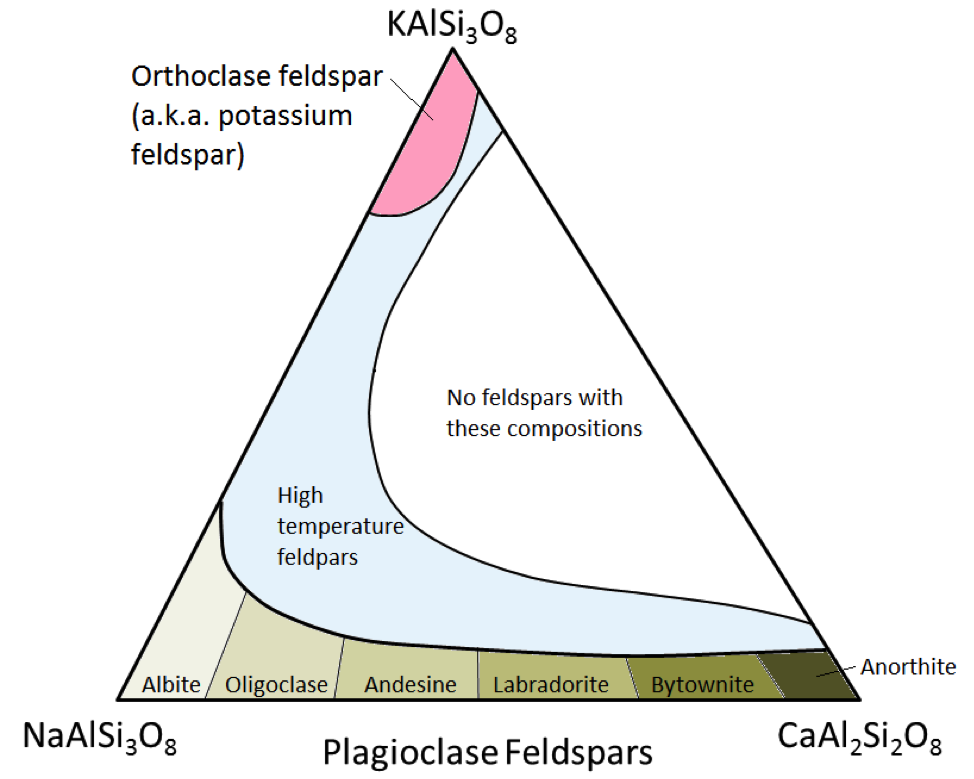
세 가지 주요 장석 광물은 칼륨 장석 (일명 K- 장석 또는 K- 스파)과 두 가지 유형의 사장석 장석 : albite (나트륨 만) 및 anorthite (칼슘 만) . 감람석에서 철과 마그네슘의 경우와 마찬가지로, 사장석에서 albite와 anorthite 사이에 연속적인 범위의 조성 (고체 용액 시리즈)이 있습니다. 이는 칼슘과 나트륨 이온의 크기가 거의 동일하기 때문입니다 (1.00Å 대 0.99Å). CaAl2Si3O8과 NaAlSi3O8 사이의 중간 조성이 존재할 수 있습니다 (그림 2.15). 크기가 매우 비슷하지만 칼슘과 나트륨 이온은 동일한 전하를 갖지 않기 때문에 약간 놀랍습니다 (Ca2 + 대 Na +). 이 문제는 Si4 +를 Al3 +로 대체함으로써 설명됩니다. 따라서 albite는 NaAlSi3O8 (1 개의 Al과 3 개의 Si)이고 anorthite는 CaAl2Si2O8 (2 개의 Al과 2 개의 Si)이며 중간 조성의 plagioclase feldspar는 Al과 Si의 중간 비율을 갖습니다. 이것을 “결합 치환”이라고합니다.
중간 구성 사장석은 올리고 클라 제 (10 ~ 30 % Ca), 안데 신 (30 ~ 50 % Ca), 래브라도 라이트 (50 ~ 70 % Ca) 및 bytownite (70 % ~ 90 % Ca) K- 장석 (KAlSi3O8)은 칼륨 이온 (1.37Å)의 크기가 더 크고 크기가 크기 때문에 사장석 (KAlSi3O8)과 구조가 약간 다릅니다. , 칼륨과 나트륨은 고온을 제외하고는 쉽게 대체되지 않습니다.이 고온 장석은 화산암에서만 발견 될 가능성이 높습니다. 침입 성 화성암은 장석이 다음 중 하나로 변할 수있을 정도로 온도가 낮을 정도로 천천히 식기 때문입니다. 저온 형태.
석영 (SiO2)에서 실리카 사면체는 “완벽한”3 차원 프레임 워크로 결합됩니다. 각 사면체는 4 개의 다른 사면체 (각 사면체의 모든 모서리에서 공유되는 산소와 함께)에 결합되며 결과적으로 실리콘 대 산소의 비율은 1 : 2입니다. 하나의 실리콘 양이온은 +4 전하를 가지며 두 개의 산소 음이온은 각각 -2 전하를 갖기 때문에 전하가 균형을 이룹니다. 알루미늄이나 나트륨 또는 칼륨과 같은 다른 양이온이 필요하지 않습니다. 석영의 경도와 절단 부족은 실리카 사면체의 강력한 공유 / 이온 결합 특성 때문입니다.
운동 2.5 페로 마그네시아 규산염?
규산 광물은 공식에 철 (Fe) 및 / 또는 마그네슘 (Mg)이 포함되어 있는지 여부에 따라 페로 마그네 시안 또는 비 페로 마그네 시안으로 분류됩니다. 다양한 미네랄과 그 공식이 아래에 나열되어 있습니다. 각각에 대해 페로 마그네 시안 규산염인지 여부를 표시합니다.
| 미네랄 | 공식 | 페로 마그네시아 규산염? |
|---|---|---|
| 감람석 | (Mg, Fe) 2SiO4 | |
| 파이 라이트 | FeS2 | |
| plagioclase | CaAl2Si2O8 | |
| 피 록센 | MgSiO3 | |
| 적철광 | Fe2O3 | |
| 정교사 | KAlSi3O8 | |
| 쿼츠 | SiO2 |
| 광물 | 공식 * | 페로 마그네시아 규산염? |
|---|---|---|
| amphibole | Fe7Si8O22 (OH) 2 | |
| 백혈구 | K2Al4 Si6Al2O20 (OH) 4 | |
| 자석 | Fe3O4 | |
| 흑운모 | K2Fe4Al2Si6Al4O20 (OH) 4 | |
| 백운석 | (Ca, Mg) CO3 | |
| 가넷 | Fe2Al2Si3O12 | |
| 사문석 | Mg3Si2O5 (OH) 4 |
* 일부 공식, 특히 더 복잡한 공식이 단순화되었습니다.
- 옹스트롬은 원자 표현에 일반적으로 사용되는 단위입니다. -스케일 치수. 1 옹스트롬은 10–10m 또는 0.0000000001m입니다. 옹스트롬의 기호는 Å입니다. ↵