사이클로 헥산 분자
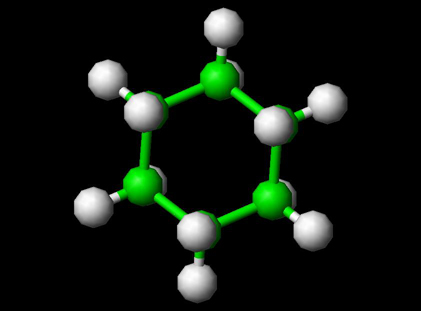
사이클로 헥산은 분자식이 C6H12 인 사이클로 알칸입니다. 시클로 헥산은 화학 산업의 비극성 용매로 사용되며 나일론 생산에 사용되는 중간체 인 아 디프 산과 카프로 락탐의 산업 생산을위한 원료로도 사용됩니다. 산업 규모에서 시클로 헥산은 벤젠과 수소를 반응시켜 생산됩니다. 고유 한 화학적 및 형태 적 특성으로 인해 시클로 헥산은 실험실에서 분석 및 표준으로도 사용됩니다.
Jsmol을 사용하는 시클로 헥산 분자 참조-3D 구조
시클로 헥산 구조 분자
6 개의 꼭지점 고리가 완벽한 육각형의 모양을 따르지 않습니다. 평평한 2D 평면 육각형의 형태는 결합이 109.5 도가 아니기 때문에 상당한 각도 변형을가집니다. 비틀림 변형은 모든 가려진 결합으로 인해 상당 할 것입니다. 따라서 비틀림 변형을 줄이기 위해 시클로 헥산은 의자 형태로 알려진 3 차원 구조를 채택합니다. 새로운 형태는 탄소를 109.5 °의 각도로 만듭니다. 수소의 절반은 고리의 평면 (적도)에 있고 나머지 절반은 평면 (축)에 수직입니다. 이 형태는 시클로 헥산의 가장 안정적인 구조를 허용합니다. 시클로 헥산의 또 다른 형태는 보트 형태로 알려져 있지만 약간 더 안정적인 의자 형성으로 상호 전환됩니다. 시클로 헥산이 큰 치환체로 단일 치환 된 경우, 이것은 약간 더 안정된 형태이기 때문에 치환기가 적도 위치에 부착되어있을 가능성이 가장 높습니다.
사이클로 헥산은 가장 낮은 각도와 비틀림 변형을가집니다. 모든 시클로 알칸은 결과적으로 시클로 헥산은 전체 고리 변형, 각도 및 비틀림 변형의 조합에서 0으로 간주되었습니다. 이는 또한 시클로 헥산을 시클로 알칸 중에서 가장 안정하게 만들어 다른 시클로 알칸에 비해 연소시 열을 가장 적게 생성합니다.
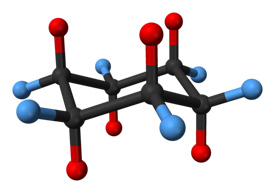
의자 형태의 시클로 헥산 분자. 축 위치에있는 수소 원자는 빨간색으로 표시되고 적도 위치에있는 수소 원자는 파란색으로 표시됩니다.
시클로 헥산과의 반응
순수 시클로 헥산 자체는 다소 비 반응성이며 비극성입니다. 소수성 탄화수소. 초산 시스템 HF + SbF5와 같은 매우 강한 산과 반응하여 강제 양성자 화 및 “탄화수소 균열”을 일으킬 수 있습니다. 그러나 치환 된 시클로 헥산은 다양한 조건 하에서 반응성이있을 수 있으며, 그 중 대부분은 유기 화학에 중요합니다. 사이클로 헥산은 인화성이 매우 높습니다.
사이클로 헥산 유도체
사이클로 헥산 유도체, 그리고 실제로 대부분의 사이클로 알칸 분자에서 작용기의 구체적인 배열은 화학 반응, 특히 친핵체와 관련된 반응에서 매우 중요합니다. 고리의 치환체는 다른 분자와 반응하기 위해 축 형성에 있어야합니다. 예를 들어, 브로 모시 클로 헥산과 일반적인 친핵체 인 수산화 음이온의 반응은 시클로 헥센을 생성합니다.
일반적으로 제거 반응 또는 탈 할로겐화 (특히 E2)로 알려진이 반응은 브롬 치환기가 다음과 같아야합니다. 축 형성에서 다른 축 H 원자에 반대하여 반응합니다. 브로 모시 클로 헥산이 반응하기에 적절한 형성에 있다고 가정하면 E2 반응은 다음과 같이 시작됩니다.
- C-Br 사이의 전자쌍 결합이 Br로 이동하여 Br∠‘를 형성하고 설정합니다. 시클로 헥산이 없음
- 친핵체 (-OH)는 인접한 축 H에 전자 쌍을 제공하여 H를 자유롭게 설정하고 결합하여 H2O를 생성합니다.
- 인접한 축 사이의 전자 쌍 결합 축 H는 두 CC 사이의 결합으로 이동하여 C = C
참고 : 모든 E2 반응의 특징 인 세 단계 모두 동시에 발생합니다.
위의 반응 대부분 E2 반응을 생성하고 결과적으로 생성물은 대부분 (~ 70 %) 시클로 헥센이됩니다. 그러나 백분율은 조건에 따라 다르며 일반적으로 두 가지 다른 반응 (E2 및 Sn2)이 경쟁합니다. 위의 반응에서 Sn2 반응은 하이드 록실 (OH-) 그룹 대신 브롬을 대체 할 것이지만 다시 한 번 Br은 축 방향에 있어야 반응합니다. SN2 치환이 완료되면 새로 치환 된 OH 그룹은보다 안정된 적도 위치로 빠르게 (~ 1 밀리 초) 되돌아갑니다. 산화. 그런 다음 KA 오일은 아 디프 산과 카프로 락탐의 원료로 사용됩니다. 실제로 KA 오일의 시클로 헥사 놀 함량이 시클로 헥사 논보다 높으면 아 디프 산으로 전환 될 가능성이 더 높고 (경제적), 그 반대의 경우 카프로 락탐 생산 가능성이 더 높습니다. KA 오일에서 이러한 비율은 적절한 산화 촉매를 선택하여 제어 할 수 있습니다. 일부 시클로 헥산은 유기 용매로 사용됩니다.
연구중인 시클로 헥산
이 고리 형 탄화수소에 대해 이미 많이 알려져 있지만, 조사시 혼합물의 수소 수율을 결정하기 위해 시클로 헥산 및 벤젠 혼합물과 고체상 시클로 헥산에 대한 연구가 여전히 진행 중입니다. 195 ° C.
역사
벤젠과 같은 화합물과 달리 시클로 헥산은 석탄과 같은 천연 자원에서 쉽게 얻을 수 없습니다. 19 세기 말에 이르러 초기 화학 연구자들은 유기 합성에 의존해야했습니다. 세부 사항을 구체화하는 데 30 년이 걸렸습니다. 1867 년 Marcellin Berthelot은 고온에서 요오드화 수소산으로 벤젠을 감소 시켰습니다. 그는 끓는점 (69 ° C)에서 편리하게 일치하기 때문에 반응 생성물을 n- 헥산으로 잘못 식별했을뿐만 아니라 벤젠이 순환 분자 (현재의 August Kekule와 같은)라고 믿지 않았기 때문에 오히려 일종의 연관성이라고 믿었습니다. 아세틸렌의. 1870 년 그의 회의론자 중 한 명이 반응을 반복하고 동일한 반응 생성물 인 헥사 하이드로 벤젠을 선언했으며 1890 년 블라디미르 마르코프 니 코프는 코카서스 석유에서 동일한 화합물을 헥사 나프 텐이라고 부르는 동일한 화합물을 증류 할 수 있다고 믿었습니다.
1894 년 Baeyer 피 멜산의 Dieckmann 축합으로 시작하여 합성 된 사이클로 헥산에 이어 다중 환원. 그리고 같은 해 E. Haworth와 W.H. Perkin Jr. (1860-1929)는 1,6-dibromohexane의 Wurtz 반응에서도 똑같이했으며, 놀랍게도 그들의 사이클로 헥산은 헥사 하이드로 벤젠이나 헥사 나프 텐보다 10 ° C 높게 끓었지만이 수수께끼는 1895 년 Markovnikov, NM Kishner 및 Nikolay에 의해 해결되었습니다. Zelinsky는 예기치 않은 재 배열 반응의 결과로 헥사 하이드로 벤젠과 헥사 나프 텐을 메틸 사이클로 펜탄으로 재 진단했습니다.