면역학의 최전선
소개
자간전증은 모든 임신의 3 ~ 5 %에 영향을 미치는 임신 특정 질병입니다 (1, 2). 임신 20 주 후 새로 발병 한 고혈압과 단백뇨로 나타납니다. 태반은 산모와 태아를 연결함으로써 질병의 발병 기전의 중심입니다 (3). 모체-태아 인터페이스는 유 전적으로 다른 태아 기원 조직이 모체 순환, 내피 및 면역 체계와 만나는 영역입니다. 종종 이론의 질병이라고 불리는, 일반적으로 받아 들여지는 통찰 중 하나는 자간전증이 모체 내피에 영향을 주어 내피 기능을 방해하여 고혈압과 단백뇨를 유발한다는 것입니다 (2). 심한 형태의 자간전증은 태아 성장 지연, 조산으로 이어질 수 있으며, 산모에게는 자간증뿐만 아니라 신장과 간에서 장기 부전을 일으킬 수 있습니다. 또한, 자간전증은 산모와 신생아에게 장기적으로 심혈관 질환에 악영향을 미칠 수 있습니다 (4). 태반의 발달은 특히 모체 나선 동맥 변형 과정에서 부적절하다고 간주됩니다. 영양 모세포가 모체 쪽을 침범하여 탈락 막으로 동맥을 저 저항 도관으로 전환하고 모체 내피를 대체합니다 (5-7). 일반적으로 자궁 동맥의 이러한 재 형성은 특히 심각한 형태의 자간전증에서 부재하거나 불완전합니다. 수축 된 자궁 동맥의 높은 저항은 태반의 악간 공간으로 난류 혈류를 유발하여 산화 스트레스와 태반 융모 나무에 기계적 손상을 일으 킵니다. 결과적인 손상은 미세 입자와 염증 매개체의 태반 발산을 증가시켜 일반화 된 내피 활성화 및 기능 장애를 초래합니다 (8, 9). 산모-태아 인터페이스의 이러한 연속적인 사건은 위에서 설명한 바와 같이 산모 고혈압 및 기타 증상을 유발합니다.
HELLP 증후군은 1982 년 Weinstein에 의해 별도의 증후군으로 처음 특성화되었으며, 종종 자간전증과 함께 나타내지 만 단독으로도 나타납니다. (10, 11). HELLP 증후군은 용혈, 간 효소 상승 및 혈소판 감소가 특징입니다. 종종 집중 치료 수준의 관찰과 증상 치료가 필요합니다. 증후군의 병인은 여전히 그림자 속에 있습니다. HELLP 증후군은 혈전 성 혈소판 감소 성 자반병 (TTP) 및 용혈성 요독 증후군 (HUS)과 같은 혈전 성 미세 혈관 병증 (TMA)과 공통된 특징을 공유합니다. TMA는 미세 혈관 병성 용혈, 혈소판 감소증 및 미세 혈전으로 인한 장기 손상의 공통된 특징을 가진 다양한 질병 그룹에 존재합니다. TTP에서 유전 적 결함 또는 대부분의 경우와 같이 활성화 된 폰 빌레 브란트 인자 (vWF)를 절단하는 효소 인 트롬 보스 폰딘 1 형 모티프 13 (ADAMTS13)을 사용하는 디 신테 그린 및 메탈 로프 로테이나 제에 대한 획득 된자가 항체는 비정상적으로 큰 작은 혈관에서 혈소판 혈전 및 용혈로 이어지는 내피 세포에서 활성화 된 vWF 멀티 머. 전형적인 HUS는 Shiga-toxin 생성 박테리아 감염 (특히 Escherichia coli)에 의해 발생하는 반면, 비정형 HUS (aHUS)는 TMA의 유형을 말하며, 여기에는 보체 시스템의 대체 경로 조절 자의 유전 적 결함이 존재합니다. 방아쇠가 임상 질환을 유발할 수 있습니다 (12, 13). FDA 승인 된 aHUS 치료제는 막 공격 복합체 (MAC)의 형성을 방지하는 보체 C5 길항제 eculizumab의 주입입니다 (그림 1). 임상 적으로 HELLP는 전통적인 TMA와 동일한 증상을 보입니다 : 용혈, 혈소판 감소증, 간에서 나타나는 장기 장애. 사용되는 TMA 분류에 따라 HELLP 증후군은 일반적으로 2 차 또는 후천성 TMA의 일부로 분류됩니다 (표 1).
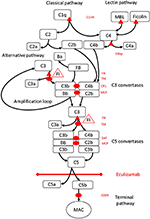
그림 1. Eculizumab은 보체 활성화의 말단 경로를 억제합니다. 보체 활성화는 3 개의 활성화 경로를 통해 시작될 수 있으며, 이는 모두 표적 표면에 MAC의 형성으로 이어지는 말단 경로를 활성화 할 수있는 능력을 가진 C5 전환 효소의 형성으로 이어집니다. 보체 시스템의이 개략도는 가장 관련성이 높은 활성화 제 (검은 색 글꼴) 및 억제제 (빨간색)를 보여줍니다. 활성화 제는 막 결합 (타원형) 또는 가용성 (삼각형) 일 수 있습니다. 대체 경로는 가용성 조절 인자 H (FH)에 의한 억제를 허용하지 않는 모든 표면에서 자발적으로 활성화됩니다. FH는 인자 I (FI)에 의해 C3b에서 iC3b 로의 불 활성화를위한 보조 인자로 작용합니다. 트롬 보 모듈 린 (TM)은 FH 보조 인자 활성을 향상시킵니다. 활성제 C3b와 함께 절단 된 인자 B (FB)는 대체 경로 전환 효소를 형성하며, 이는 C3를 C3b로 절단하여 대체 경로 활성화의 증폭 루프를 생성하는 능력을 갖는다.보체 활성화의 고전적 경로는 예를 들어 C1q에 대한 면역 복합체의 결합에 의해 시작될 수있는 반면, 렉틴 경로는 예를 들어 미생물상의 탄수화물 패턴에 결합하는 만노스 결합 렉틴 (MBL) 또는 피 콜린에 의해 활성화된다. 렉틴 경로 활성화는 보체 성분 C4 및 C2를 절단하여 고전적 경로 전환 효소 C4bC2b를 형성하는 만노스 관련 세린 프로테아제 1 및 2 (MASP-1 및 MASP-2, 그림에 없음)를 초래합니다. C1 억제제 (C1inh) 및 C4bp는 고전적 경로의 가용성 조절제 인 반면, 막 보조 인자 단백질 (MCP) 및 보체 수용체 1 (CR1)은 초기 보체 경로의 막 결합 조절제입니다. C5 전환 효소의 형성은 표면 결합 조절 인자 붕괴 가속 인자 (DAF) 및 MCP의 부재 하에서 보체 활성화 및 C5의 절단의 말단 경로를 시작합니다. MAC 조립은 표면 결합 조절기 CD59 (protectin)에 의해 조절됩니다. 초기 경로에서 C3 및 말단 경로에서 C5의 절단은 아나 필라 톡신 C3a 및 C5a를 방출하고 염증을 유발합니다. Eculizumab은 보체 단백질 C5에 대한 인간화 재조합 항체로, C5 전환 효소에 의한 C5의 절단을 억제하여 보체 활성화의 전 혈전 및 전 염증 효과를 조절합니다. 이 사례 보고서에 설명 된 환자는 응고 캐스케이드의 vWF 경로 조절자인 Factor H (CFH), FHR5 및 MCP, CFI, CFB, THBD 및 ADAMTS13 (ADAMTS13)을 코딩하는 유전자의 유전 적 돌연변이에 대해 테스트되었습니다. 표시됨). 유전자 검사 결과는 음성이었습니다.

표 1. HELLP 및 aHUS 진단 기준
이 사례 연구에서 우리는 복잡한 임신으로 인한 TMA 및 성공적인 치료 과정을 가진 환자.
사례 발표
29 세의 primigravida는 재태 연령 34 + 2 세에 헬싱키 대학 병원으로 의뢰되었습니다. 복통이있는 외래 진료소. 처음에 그녀의 혈압은 적당히 상승했고 (133/91 mmHg), 요도 딥 스틱은 단백질 양성이었습니다. 처음보고 된 상복부 통증은 점차 호전되고있었습니다. 초음파 스캔에서 태아는 정상적인 생물 물리학 적 프로파일 (BPP)을 가졌고 체중 추정치는 -2 SD 성장 곡선에있었습니다. 심전도 (CTG)는 정상이었습니다. 혈액 헤모글로빈 (Hb)은 115g / L, 혈소판은 158 E9 / L (정상 범위 150-360 E9 / L), 알라닌 아미노 전이 효소 (ALT)는 정상 (23U / L)이었습니다. 소변 딥 스틱은 단백질 (+2) 양성이었고 계산 된 단백뇨는 1.6g / 24 시간이었습니다. 아기의 폐 성숙을 촉진하기 위해 코르티손 치료를 시작하기로 결정했습니다. 환자는 대조군 검진과 두 번째 코르티손 투여를 위해 다음날 돌아올 계획으로 퇴원했습니다. 예정대로, 그녀는 임신 34 + 4 주에 통제를 위해 왔습니다. 혈압은 147/87 mmHg, ALT 23, 혈소판 177, CTG였으며 초음파 검사에서 태아의 BPP는 정상이었습니다. 그녀는 퇴원했고 또 다른 검진 일정이 잡혔습니다. 같은 날 오후, 상복부 통증이 회복되었고 저녁이 될수록 점차 악화되었습니다. 그녀는 오전 2시 20 분에 병원으로 돌아 왔습니다. 그녀는 팽팽한 상복부 통증과 안절부절 함을 경험하고 있었고 두 번 구토를했고 떨림을 느꼈습니다. 혈압은 170/94 mmHg에서 분명하게 상승했고, 소변 단백질 딥 스틱은 강하게 양성, ALT는 159, Hb 122, 혈소판 172에서 상승했습니다. 그녀는 산전 병동에 입원했습니다. 오전 4시에 그녀는 두통을 겪고있었습니다. 항 고혈압 제가 시작되었습니다 (라베 탈롤 100mg 3 회). 소변 단백질 배출량은 밤에 13g / 24 시간으로 최고조에 달했습니다. 그 후, 그녀는 구토를 시작했고, 복통과 두통이 있었고, CTG 모니터링은 감속을 보였다. 환자는 오전 7시 1 분에 분만실로 이송되었고 자궁경 부가 3cm 확장됨에 따라 분만 유도를 위해 태아 막이 인위적으로 부러졌다. 동시에 실험실 테스트는 Hb 122, 혈소판 172로 완료되었습니다. 그러나 젖산 탈수소 효소 (LD)는이 시점에서 분명히 1231 U / L로 상승했습니다. CTG에서 감속이 계속되었고 서맥이 계속됨에 따라 응급 제왕 절개가 수행되었습니다. 남자 유아 (1960g, -2 SD)는 오전 7.25에 제 대동맥 pH 값 7.05, BE -6.80, Apgar 1/6/8로 태어났습니다. 수술 중 출혈량은 400ml였습니다.
제왕 절개 후 오전 9시에 산모의 혈소판은 49로 낮았고 Hb는 102였습니다. 오후에는 ALT가 1800으로 상승했습니다. LD 3570 , 혈청 크레아티닌 수치는 153 (μmol / L)이었고 혈소판은 33으로 감소했습니다. 낮은 수준의 피브리노겐 (1.1g / L, 기준값 2–4g / L)과 높은 수준의 D로 표시된 응고 장애가있었습니다. -피브린 이량 체 (30.2 mg / L, < 0.5 mg / L). 추가 봉합을 삽입 한 제왕 절개 상처에서 약간의 출혈이있었습니다.이때 8 단위의 혈소판이 투여되었다. 칼륨 수치는 4.7에서 5.6 (mmol / L)로 증가했습니다. 용혈이 명확하게 관찰되었습니다. Coombs 테스트는 음성이었습니다. 소변 배설은 10ml / h에 불과했습니다. 실험실 검사에서 신장과간에 손상 징후가있는 심각한 질병이 분명하게 나타났습니다. 또한, 상당한 응고와 현저한 섬유소 용해를 동시에 나타내는 응고 시스템에 장애가있었습니다. 황산 마그네슘 주입은 자간전증의 심각한 합병증 인 경련의 예측 징후로 간주되는 과반 사 때문에 시작되었습니다. 덱사메타손 10mg 정맥 주사를 시작하고 환자를 중환자 실 (ICU)로 이송했습니다.
또한 다른 의학적 응급 상황에 대한 감별 진단 목적으로 실험실 테스트를 실시했습니다 (표 2). ADAMTS13의 활성은 TTP를 제외한 정상 62 % (40–130 %)였습니다. 혈청 보체 C3 (0.52 g / L, 0.71–1.41 g / L) 및 C4 (0.07 g / L, 0.12–0.34 g / L) 수준은 낮았습니다. 보체 (C5b-9, 971 ng / mL, < 366 ng / mL)의 가용성 말단 복합체 수준은 산후 첫날에 상승했습니다. 항 인지질 항체는 검출되지 않았고, B 형과 C 형 간염과 관련된 감염 혈청학, HIV는 음성이었습니다. 대변 샘플에서 전형적인 HUS를 유발하는 병원체가 음성으로 테스트되었습니다.

표 2. 질병 진단 및 치료 일정
환자는 산후 1 일과 2 일에 혈장 교환 치료를 받았습니다. 치료 과정 (산후 2 일, 4 일, 6 일)에 걸쳐 세 번 모두 혈액을 채혈했습니다.
산후 셋째 날 환자는 안정되어 여성 병원 회복실로 다시 옮겨졌습니다. 고혈압은 암로디핀 10mg 1 일 2 회, 라베 탈롤 200mg 1 일 3 회 치료를 받았고, 산후 4 일째에는 혈소판 감소가 계속되었고 환자는 aHUS 진단을 받았습니다. aHUS는 일반적으로 산후 3 일에 HELLP 환자의 자발적인 회복에 있으며, eculizumab 치료를 시작했습니다 (900 mg IV). 폐렴 구균 예방 접종을 받고 예방 항생제 (페니실린)를 시작했습니다. 환자는 주 4 회에 쿨리 주맙 (900mg)을 모두 함께 투여했고 그녀는 빠르게 회복되기 시작했습니다. 산후 6 일째 세 번째 혈액 투석 후 추가 혈액 투석이 필요하지 않았습니다 (그림 2). 신장 기능이 점진적으로 교정되고 혈소판 수가 증가하고 용혈이 해결되었습니다. 산후 4 주 동안 C3 및 C4의 혈장 수치가 정상화되었습니다.
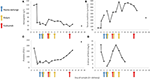
그림 2. 질병의 초기 단계와 혈장 교환, 혈액 투석 및에 쿨리 주맙 투여시기 동안 관찰 된 선별 된 실험실 값. 패널 (A)에서 혈중 헤모글로빈 측정의 발달을, 패널 (B)에서 혈청 크레아티닌 수준, 패널 (C)에서 혈소판 수, 패널 (D)에서 17 일 동안 섬유소 값의 D- 이량 체를 나타냅니다. 추적 기간.
유전자 검사에서 알려진 유전자 다형성은 확인되지 않았습니다. 그녀는 보체 조절 인자 H (CFH), 인자 H 관련 단백질 5 (FHR5) 및 막 보조 인자 단백질 (MCP), 보체 대체 경로 비활성화 인자 I (CFI), 대체 경로 활성화 인자 B (CFB)의 돌연변이에 대해 테스트를 받았습니다. ) 및 응고 캐스케이드의 다음 구성 요소 : ADAMTS13, 트롬 보 모듈 린 (THBD) 및 세포 내 효소 인 디아 실 글리세롤 키나제 E (DGKE), 그 돌연변이는 aHUS의 알려진 원인입니다 (14). 또한 인자 H에 대한 항체도 검출되지 않았습니다. C4 결핍은 발견되지 않았습니다.
요약하자면 우리 환자는 중증 자간전증이 있었고 HELLP 증후군 진단 기준을 충족했습니다. aHUS에 대한 유전자 검사는 음성으로 남아 있었지만 질병의 임상 경과 (특히 심각한 급성 신장 손상)와 치료에 대한 반응 (특히에 쿨리 주맙)은 환자가 임신에 의해 유발 된 aHUS를 가졌음을 시사했습니다.
토론
상기 프리미 그라 비다는 중증 자간전증, HELLP 증후군, 임신 유발 aHUS로 진단되었습니다. aHUS에 취약 할 수있는 알려진 유전자 돌연변이는 발견되지 않았습니다. TMA, TTP, HUS / aHUS 및 HELLP 증후군과 같은 이차 TMA 유형 간의 감별 진단이 중요합니다. 특히 TTP는 질병이 완화 될 때까지 매일 빠른 혈장 교환으로 치료되기 때문에 조기에 식별해야합니다 (15).
현재 aHUS를 유발할 수있는 유전 적 돌연변이를 검사하는 실험실 분석 방법은 다음과 같은 돌연변이를 나타낼 수 있습니다. aHUS 사례의 최대 40 ~ 60 % 만 위음성 사례의 가능성을 남깁니다. 따라서 돌연변이에 대한 음성 테스트 결과가 진정한 aHUS를 배제하지 않습니다 (16).임신과 분만 후에는 드물게 aHUS가 유도됩니다. 이 경우, 다음 3 년 동안 ~ 50 %가 만성 신장 질환 (CKD), 일부는 말기 신장 질환 (ESKD)으로 발전했습니다. 유전 적 돌연변이가 관찰되면 최대 85 %까지 CKD 또는 ESKD가 발생할 수 있습니다 (17).
임신 중 고혈압 장애에서 태반 염증이 내피 기능 장애를 유발한다는 것이 일반적으로 인정됩니다. 내피의 완전성이 방해되면 보체와 응고가 활성화됩니다 (18). 산모 내피 손상이 심각한 자간전증 및 기타 고혈압 임신 장애와 관련된 노년의 산모 이환율에 기여하는 것으로 가정되었습니다 (2, 19). 손상된 내피는 초기 진단 증상 (20-23)이 가라 앉은 후에도 수년 동안 비정상적으로 기능하는 것으로 나타났습니다.
HELLP 환자의 최대 46 %에서 유전자 돌연변이가 대체 경로의 조절 자에 설명되어 있습니다. 보완 시스템의 (24, 25). 임신 초기에 태반이 발달하면 나중에 자간전증이 발생한 환자의 혈청 내 Bb 수치가 상승하면 보체 시스템이 활성화됩니다 (26). 보체 시스템의 활성화는 중증 자간전증 및 HELLP 증후군에서 관찰되었으며 중증 자간전증 환자의 소변에서 높은 수준의 말단 복합체 (C5b-9)가 발견되었습니다. HELLP 증후군 환자에서 기능 검사를 통해 보체 시스템의 활성화가 증가했으며, CD55 및 CD59의 발현 부족으로 인해 조절이 감소하고 보체 시스템의 활성화가 악화되었습니다 (27-29).
HELLP 증후군과 aHUS 사이에는 많은 유사점이 있습니다. 두 조건 모두에서 내피 장애가 명확하게 관련되고 보체 및 응고 활성화가 뒤 따릅니다. 중증 자간전증 및 HELLP 증후군에서 중증 질환 및 TMA의 초기 징후에 투여되는 eculizumab은 신장과 산모 내피의 보호에 도움이 될 것입니다 (30). 내피의 완전성을 보존하면 심혈관 질환과 같은 장기적인 건강 위험으로부터 환자를 잠재적으로 보호 할 수 있습니다. 일반적으로 임신 관련 TMA에서 용혈 및 혈소판 감소증의 임상 소견은 3 일 이내에 해결됩니다. 질병 활동이 더 오래 지속되면 감별 진단이 계속되어야하며 그 후에 만 대체 치료 (예 :에 쿨리 주맙)가 고려됩니다. eculizumab 치료를 일찍 도입하면 신장 손상을 예방하고 내피 및 전신 염증의 난류를 최소화함으로써 여성에게 도움이 될 것입니다. Eculizumab을 충분히 일찍 투여하고 1 ~ 2 회 투여하면 난류를 막고 연속적인 사건을 막기에 충분할 수 있습니다 (31). 한편으로는 eculizumab은 매우 비싼 약물이지만 다른 한편으로는 집중 치료, 혈장 교환, 혈액 투석, 가능한 신장 이식 비용은 물론 산모와 가족에 대한 정서적 결과는 말할 것도 없습니다.
결론적으로 우리 환자는 중환자 실에 입원하고 혈액 투석을 필요로하는 용혈, 응고 장애, 간 손상, 신부전을 경험하는 중병이었습니다. 에 쿨리 주맙이 HELLP 증후군의 첫 징후에서 일찍 시작된 경우, 질병의 후기 과정에서 유익 할 수 있으며, 잠재적으로 신장 손상을 완화하여 혈액 투석 및 나중에 CKD의 필요성을 예방할 수 있습니다. 그러므로 현대 면역 의학 시대에 우리는 최선을 다하기를 기다리며 희망하는 것보다 더 많은 일을 할 수 있을까요?
윤리 성명서
윤리 검토 및 승인은 그렇지 않았습니다. 현지 법률 및 제도적 요구 사항에 따라 인간 참가자에 대한 연구에 필요합니다. 환자 / 참가자들은이 연구에 참여하기 위해 서면 동의서를 제공했습니다.
저자 기고
AL과 JH-E는 아이디어를 원고에 개발하고 원고를 작성했습니다. JH-E와 MH는 환자의 진단 및 치료에 관여했습니다. 모든 저자는 원고를 검토 및 편집하고 최종 버전의 출판을 승인했습니다.
이해 상충
저자는 연구가 상업적 또는 재정적 관계가없는 상태에서 수행되었다고 선언합니다. 잠재적 인 이해 상충으로 해석 될 수 있습니다.
4. Hauspurg A, Ying W, Hubel CA, Michos ED, Ouyang P. 불리한 임신 결과 및 미래의 모성 심혈관 질환. Clin Cardiol. (2018) 41 : 239–46. doi : 10.1002 / clc.22887
PubMed 요약 | CrossRef 전체 텍스트 | Google 학술 검색
5. Brosens I, Pijnenborg R, Vercruysse L, Romero R. The ” 중대한 산과 증후군”은 심부 태반 장애와 관련이 있습니다. Am J Obstet Gynecol. (2011) 204 : 193–201. doi : 10.1016 / j.ajog.2010.08.009
PubMed 요약 | CrossRef 전체 텍스트 | Google 학술 검색
8. Germain SJ, Sacks GP, Soorana SR, Sargent IL, Redman CW . 정상적인 임신과 자간전증에서 전신 염증성 프라이밍 : 순환하는 세포 융합 영양 모세포 미세 입자의 역할. J Immunol. (2007) 178 : 5949–56. doi : 10.4049 / jimmunol.178.9.5949
PubMed 요약 | CrossRef 전체 텍스트 | Google 학술 검색
9. Tannetta D, Masliukaite I, Vatish M, Redman C, Sargent I . 정상 임신 및 자간전증에서 융합 영양 모세포 유래 세포 외 소포의 업데이트. J Reprod Immunol. (2017) 119 : 98–106. doi : 10.1016 / j.jri.2016.08.008
PubMed 요약 | CrossRef 전체 텍스트 | Google 학술 검색
10. Weinstein L. 용혈 증후군, 간 효소 상승 및 혈소판 감소 카운트 : 임신 중 고혈압의 심각한 결과. J Obstet Gynecol입니다. (1982) 142 : 159–67. doi : 10.1016 / S0002-9378 (16) 32330-4
PubMed 요약 | CrossRef 전체 텍스트 | Google Scholar
15. Pourrat O, Coudroy R, Pierre F. 중증 HELLP 증후군의 구별 및 혈전 성 미세 혈관 병증, 혈전 성 혈소판 감소 성 자반병 및 기타 모방 자. Eur J Obstet Gynecol Reprod Biol. (2015) 189 : 68–72. doi : 10.1016 / j.ejogrb.2015.03.017
PubMed 요약 | CrossRef 전체 텍스트 | Google 학술 검색
20. Agatisa PK, Ness RB, Roberts JM, Costantino JP, Kuller LH , McLaughlin MK. 자간전증 병력이있는 여성의 내피 기능 장애 : 심혈관 위험의 지표. Am J Physiol은 Circ Physiol을 듣고 있습니다. (2004) 286 : 1–3. doi : 10.1152 / ajpheart.00298.2003
PubMed 요약 | CrossRef 전체 텍스트 | Google 학술 검색
22. Kvehaugen AS, Dechend R, Ramstad HB, Troisi R, Fugelseth D , 직원 AC. 자간전증 후 여성과 소아에서 내피 기능과 순환 바이오 마커가 방해받습니다. 고혈압. (2011) 58 : 63–9. doi : 10.1161 / HYPERTENSIONAHA.111.172387
PubMed 요약 | CrossRef 전체 텍스트 | Google 학술 검색
23. Stanhewicz AE. 자간전증 병력이있는 여성의 잔여 혈관 기능 장애. Am J Physiol Regul Integr Comp Physiol. (2018) 315 : R1062–R71. doi : 10.1152 / ajpregu.00204.2018
PubMed 요약 | CrossRef 전체 텍스트 | Google 학술 검색
25. Vaught AJ, Braunstein EM, Jasem J, Yuan X, Makhlin I , Eloundou S, et al. 보체의 대체 경로에서 생식선 돌연변이는 HELLP 증후군에 걸리기 쉽습니다. JCI 통찰력. (2018) 3 : 0–13. doi : 10.1172 / jci.insight.99128
PubMed 요약 | CrossRef 전체 텍스트 | Google 학술 검색
31. Elabd H, Elkholi M, Steinberg L, Acharya A. Eculizumab, 자간전증 / HELLP 증후군과 관련된 급성 신장 손상에 대한 새로운 잠재적 치료. BMJ 케이스 담당자 (2019) 12 : e228709. doi : 10.1136 / bcr-2018-228709
PubMed 요약 | CrossRef 전체 텍스트 | Google 학술 검색