폴로늄 요소 정보
화학 원소 인 폴로늄은 칼 코겐과 준 금속으로 분류됩니다. 1898 년 Marie와 Pierre Curie가 발견했습니다.

데이터 영역
| 분류 : | 폴로늄은 칼 코겐이자 준 금속입니다. |
| 색상 : | 은회색 |
| 원자량 : | (209), 안정 동위 원소 없음 |
| 상태 : | 고체 |
| 녹는 점 : | 254 oC, 527 K |
| 끓는점 : | 960 oC, 1233 K |
| 전자 : | 84 |
| 양성자 : | 84 |
| 가장 풍부한 동위 원소의 중성자 : | 125 |
| 전자 껍질 : | 2,8 , 18,32,18,6 |
| 전자 구성 : | 4f14 5d10 6s2 6p4 |
| 밀도 @ 20oC : | 9.4 g / cm3 |
다음을 포함하여 더보기 : 열, 에너지, 황소 idation,
반응, 화합물, 반경, 전도도
| 원자 부피 : | 22.23 cm3 / mol |
| 구조 : | 단순 입방체 |
| 경도 : | – |
| 비열 | 0.12 J g-1 K-1 0.12 |
| 융해열 | 13kJ mol-1 |
| 무화 열 | 142 kJ mol-1 |
| 기화열 | 120kJ mol-1 |
| 1 차 이온화 에너지 | 812 kJ mol-1 |
| 2 차 이온화 에너지 | – |
| 3 차 이온화 에너지 | – |
| 전자 친 화성 | 180kJ mol-1 |
| 최소 산화수 | -2 |
| 최소 일반적인 산화수 | -2 |
| 최대 산화수 | 6 |
| 최대. 일반적인 산화 번호. | 4 |
| 전기 음성도 (폴링 스케일) | 2.0 |
| 분 극성 부피 | 6.8 Å3 |
| 공기와의 반응 | 온화함, ⇒ PoO2 |
| 15M HNO3와의 반응 | – |
| 6M HCl과의 반응 | 온화함, ⇒ PoCl2 |
| 6M NaOH와의 반응 | 없음 |
| 산화물 | PoO2, PoO2 |
| 수 소화물 | PoH2 |
| 염화물 | PoCl2 |
| 원자 반경 | 190 pm |
| 이온 반경 (1+ 이온) | – |
| 이온 반경 (2+ 이온) | – |
| 이온 반경 (3+ 이온) | – |
| 이온 반경 (1 이온) | – |
| 이온 반경 (2- 이온) | – |
| 이온 반경 (3- 이온) | – |
| 열전도율 | 0.2 W m-1 K-1 |
| 전기 전도도 | 0.7 x 106 S m-1 |
| 어는점 / 어는점 : | 254 oC, 527 K |

Marie Curie, 1883 년, 16 세. 폴로늄은 15 년 후 그녀가 발견 한 첫 번째 요소였습니다.
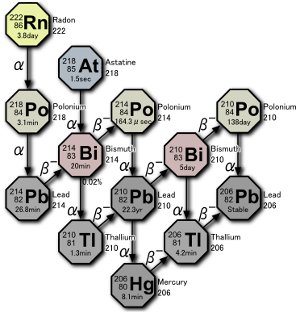
우라늄 붕괴 시리즈. 3 개의 폴로늄 동위 원소는 라돈 가스 자체의 붕괴 또는 라돈 붕괴로 인한 원자의 붕괴에 의해 자연적으로 생성됩니다. 이미지 : Tosaka.
폴로늄 발견
폴로늄은 Marie와 Pierre Curie가 처음으로 발견 한 원소입니다.
그들은 1898 년 파리에서 폴로늄과 라듐을 발견하고 피치블렌드 (산화 우라늄)의 방사능을 조사했습니다.
그들은 다음과 같이 썼습니다. “우리는 피치블렌드에서 추출한 물질에 분석적 특성에서 비스무트와 유사한 이전에 알려지지 않은 금속이 포함되어 있다고 믿습니다.이 새로운 금속의 존재가 확인되면 우리 중 한 사람의 원산지 이름을 따서 폴로늄이라고 불렀습니다.”
큐리스의 소원에 따라 폴로늄은 마리 큐리가 태어나고 자란 폴란드의 이름을 따서 명명되었습니다.
큐리가 태어 났을 때 방사성 원소로 작업하는 위험은 알려지지 않았습니다. 이번 연구실 공책은 방사능이 너무 커서 이제 납이있는 케이스에 보관됩니다. (1)
외관 및 특성
유해한 영향 :
폴로늄은 화학적 독성과 방사능으로 인해 해 롭습니다. 폴로늄 -210은 알파 방출 체이므로 삼키거나 흡입하면 매우 위험합니다.폴로늄에 노출되면 다양한 암에 걸릴 위험이 높아집니다.
특성 :
폴로늄은 희귀하고 은회색의 방사성이며 저 융점 준 금속입니다.
폴로늄은 묽은 산과 쉽게 반응하지만 알칼리와는 약간만 반응합니다.
모든 동위 원소는 방사성입니다.
210Po는 주변의 공기가 붕괴에 의해 흥분되기 때문에 푸른 빛을냅니다. 제품. 1g의 Po는 5kg의 라듐만큼 많은 알파 입자를 방출합니다.
폴로늄의 알파 붕괴에 의해 방출되는 에너지는 상당하며 그 주변 공간을 가열합니다. 방출되는 에너지는 너무 커서 (140W / g) 약 0.5 그램의 캡슐이 500 ° C 이상의 온도에 도달합니다.
폴로늄 사용
폴로늄은 롤링 페이퍼, 와이어 및 판금과 같은 공정에서 발생하는 정전기를 제거하는 데 사용할 수 있습니다. 그러나 베타 광선 소스는 덜 위험하므로 더 일반적으로 사용됩니다.
210Po는 원자 열원으로 사용할 수 있지만 동위 원소의 짧은 반감기 (138.4 일)로 인해 장기간 사용할 수있는 전력을 제공하지 않습니다.
폴로늄은 정전기 방지 브러시에도 사용되어 사진 필름의 먼지를 제거합니다. 방사능 방출을 제어하기 위해 브러시로 밀봉되어 있습니다.
풍부 및 동위 원소
풍부한 지각 : 천조 당 1 부 정도.
풍부한 태양계 : 무시할 수 있음
비용 , 순수 : 100g 당
비용, 부피 : 100g 당
출처 : 폴로늄은 모든 동위 원소의 반감기가 짧기 때문에 매우 드문 원소입니다. 우라늄 광석에서 소량으로 발견됩니다. 천연 비스무트 209Bi를 중성자로 충격을 가하여 210Bi를 생성 한 다음 β 붕괴를 통해 210Po로 붕괴하여 얻을 수 있습니다. 매년 약 100g의 폴로늄이 합성됩니다.
동위 원소 : 폴로늄에는 반감기가 알려진 29 개의 동위 원소가 있으며 질량 수는 190 ~ 218입니다. 안정된 것은 없습니다. 가장 안정적인 동위 원소는 209Po이며 반감기는 102 년입니다.

이 페이지 인용
온라인 링크의 경우 다음 중 하나를 복사하여 붙여 넣으십시오.
<a href="https://www.chemicool.com/elements/polonium.html">Polonium</a>
또는
<a href="https://www.chemicool.com/elements/polonium.html">Polonium Element Facts</a>
학술 문서에서이 페이지를 인용하려면 다음 MLA 준수 인용을 사용하세요.
"Polonium." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/polonium.html>.