저널 | 정책 | 허가 위장병 학 연구
내시경 검사에서 관찰 된 반점 홍반에 의한 위 장 대사의 예측 가능성
Naoyoshi Nagataa, g, Takuro Shimbob, Junichi Akiyamaa, Ryo Nakashimaa, Hyung Hun Kimc, Takeichi Yoshidad, Kazufusa Hoshimotoe, Naomi Uemuraf
aDepartment of Gastroenterology and Hepatology, Department of Gastroenterology and Hepatology, National Center for Global Health and Medicine (NCGM), 일본 도쿄
b 일본 동경 NCGM 임상 연구 정보학과 국제 임상 연구 센터
c 부산 고신대 학교 의과 대학 내과
d 소화 기간과, 와카야마 의과 대학, 와카야마, 일본
e 일본 동경 NCGM 임상 실험실 병리과
f 일본 치바 코노 다이 병원 NCGM 소화기 및 간과 부
g 교신 저자 : Naoyoshi Nagata, Department of 지 astroenterology and hepatology, National Center for Global Health and Medicine, 1-21-1 Toyama, Shinjuku-ku, Tokyo 162-8655, Japan
2011 년 9 월 26 일 출판 승인 원고
짧은 제목 : 장 증식의 내시경 진단
doi : https://doi.org/10.4021/gr357w
- 요약
- 소개
- 방법
- 결과
- 토론
| 추상 | ▴ 상단 |
배경 : 장내 화생 (IM)은 전 암성 병변으로 간주됩니다. 그러나 IM의 내시경 진단은 어렵다고 여겨져왔다. 내시경 검사를 통해 심각한 IM을 포함하는 독특한 홍반 패턴 인 “점막 반점 홍반 (MPE)”을 발견했습니다. 헬리코박터 파일로리 (Hp) 감염 자체가 위 점막의 조직 학적 변화를 반영하는 홍반을 유발할 수 있습니다. 따라서 우리는 Hp 박멸을 등록했습니다. MPE와 병리학 적 소견 사이의 관계를 검증 할 수있는 환자입니다.
방법 : 연구 최소 6 개월 전에 성공적으로 Hp 박멸을받은 만성 위염 환자를 등록했습니다. MPE를 여러 편평하거나 우울한 홍반 병변으로 정의했습니다. 내시경 검사에서 MPE를 발견했을 때 MPE 부위와 비 MPE 부위 모두에서 생검을 수행했습니다. 비 MPE 부위는 MPE 부위에서 3cm 이내에 위치한 인접 점막으로 정의했습니다. 모든 생검 검체는 다음을 사용하여 IM subtype에 대해 면역 조직 화학적으로 평가되었습니다. MUC2, MUC5AC, MUC6, CD10 및 CDX2 염색. IM의 정도는 Updated Sydney System에 따라 정의되었으며, 병리학 적 IM에 대한 MPE 소견의 진단 정확도를 계산했습니다. MPE와 IM 하위 유형 간의 관계도 평가되었습니다.
결과 : 총 102 명의 환자가 연구 대상으로 선정되었습니다. 이 중 55 명 (54 %)의 환자가 MPE를 가졌습니다. 이 55 명의 환자로부터 MPE 부위와 비 -MPE 부위에서 생검 표본을 채취했습니다. IM의 IM 비율과 중앙값은 모두 비 MPE 사이트보다 MPE 사이트 (P < 0.001)에서 훨씬 더 높았습니다. 조직 학적 IM 검출에서 MPE의 민감도와 특이도는 각각 72.7 %와 84.1 %였다. MPE 부위와 비 -MPE 부위 사이의 MUC2, MUC5AC, MUC6, CD10 및 CDX2의 발현에서 유의 한 연관성은 관찰되지 않았습니다. 두 그룹 간의 IM 하위 유형의 비율 (완전 / 불완전)에는 큰 차이가 없었습니다.
결론 : MPE는 염색 내시경 및 확대 내시경을 사용하지 않고 조직 학적 IM을 검출하는 데 유용한 내시경 결과입니다. 그러나 IM 하위 유형은 식별하기 어렵습니다. Hp 박멸 시대에 MPE는 위암 위험에 대한 예측 결과가 될 가능성이 있습니다.
키워드 : 장의 화생; 전 악성 병변; 내시경 소견; 홍진; 백색광 내시경; 하위 유형, 박멸; 헬리코박터 파일로리
| 소개 | ▴ 상단 |
위암 발병에는 헬리코박터 파일로리 (Hp) 감염, 만성 위염, 선 위축, 장 대사 (IM), 그리고 마지막으로 다단계 과정이 포함되는 것으로 알려져 있습니다. 이형성증. IM과 위 위축은 함께 장형 위암 발병의 위험 인자로 간주되며 전 악성 병변으로 간주됩니다.위 위축은 내시경 검사로 인식 할 수 있으며 조직 학적 평가와 관련이 있습니다. 그러나 표준 백색광 내시경을 이용한 IM의 진단은 IM의 색상 구분이 부족하고 여러 편평한 병변으로 존재하기 때문에 어려운 것으로 간주되었습니다.
최근 , 우리는 Hp 박멸 후에도 내시경에서 독특한 홍반 소견을 관찰 할 수 있음을 발견했습니다. 우리는이 발견을 “점성 반점 홍반 (MPE)”이라고 설명합니다. MPE는 표준 백색광 내시경 검사에서 여러 편평하거나 약간 우울한 홍반 병변으로 인식 될 수 있습니다. 병리학 적으로 심각한 IM이 포함됩니다 .Hp 감염 자체는 내시경 검사에서 볼 수있는 홍반을 유발할 수 있으며 이는 염증 세포 침윤 및 부종과 같은 조직 학적 변화를 반영합니다. , 우리는 MPE와 병리학 적 발견 사이의 관계를 검증하기 위해 Hp 박멸을받은 환자를 등록했습니다.
| 방법 | ▴Top |
환자 선택
연구 최소 6 개월 전에 성공적으로 Hp 박멸을받은 만성 위염 환자는 2008 년 1 월부터 2008 년 12 월까지 NCGM (National Center for Global Health and Medicine)에 연구에 등록되었습니다. 제외 기준 i 내시경 검사 전 4 주 동안 비 스테로이드 성 항염증제 (NSAID), 제산제 및 항 혈전 제 사용을 포함하지 않았습니다. 또한 위 수술, 출혈성 질환, 간경변, 신부전, 심부전, 조기 또는 진행성 위암 병력이있는 환자는 제외했습니다. 헬싱키 선언 및 후속 개정에 따라 참가자로부터 서면 동의를 얻었습니다. 연구 프로토콜은 NCGM 윤리위원회의 승인을 받았습니다.
헬리코박터 파일로리 박멸
Hp 감염으로 유발 된 만성 위염 및 소화성 궤양 환자는 박멸 요법을 받았습니다. 환자들은 일본에서 승인 된 표준 1 차 요법 인 아목시실린, 클라리 트로마 이신 및 양성자 펌프 억제제 (PPI)로 구성된 7 일 요법으로 하루에 두 번 치료 받았습니다. 박멸에 성공하지 못하면 아목시실린, 메트로니다졸 및 PPI로 구성된 두 번째 요법이 투여되었습니다. 박멸은 박멸 요법 완료 후 2 ~ 3 개월 후에 음성 13C- 요소 호흡 검사 (13C-UBT)와 함께 위 생검의 조직 학적 검사 음성으로 확인되었습니다. 모든 검사가 음성이면 환자는 Hp 감염 음성으로 정의되었습니다.
내시경 평가
Hp 박멸 후 최소 6 개월 후 환자는 내시경 검사를 받았습니다. 우리는 위 점막에서 MPE의 존재를 관찰하기 위해 배율이없는 고해상도 내시경 (Olympus videoscope, 모델 GIF-H260)을 사용했습니다. 우리는 MPE를 울혈 성 점막, 출혈, 혈관 확장증, 반점 홍반 및 선형 홍반과 구별되는 여러 편평하거나 약간 우울한 홍반 병변으로 정의했습니다 (그림 1A, B). 또한 MPE와 궤양 또는 궤양 흉터를 동반하는 재생 상피가있는 붉은 점막을 구별했습니다.
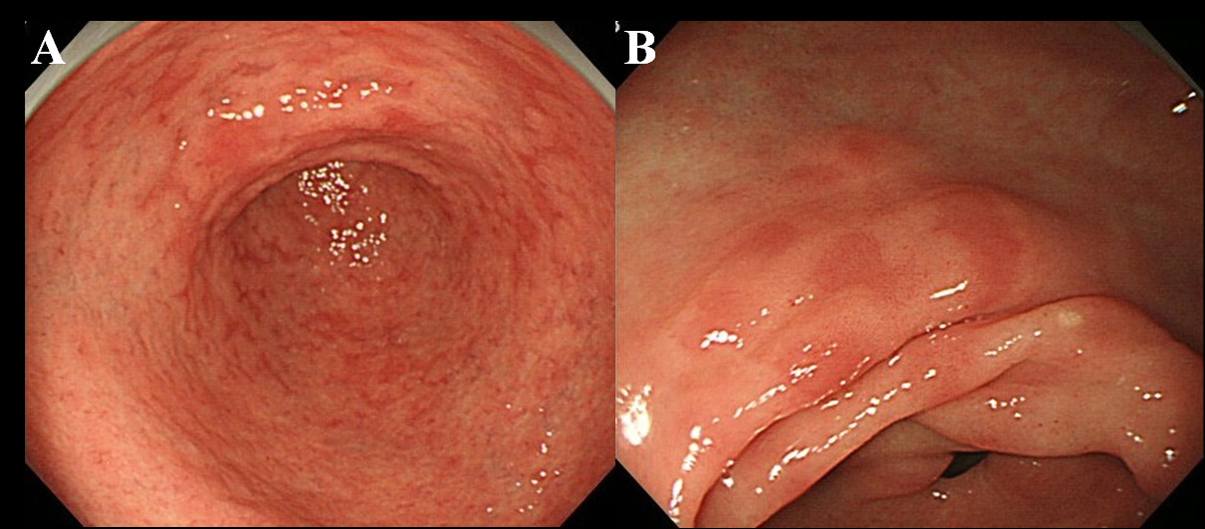 큰 이미지를 보려면 클릭 |
그림 1. MPE의 내시경 발견. (A) antrum의 다중 및 편평한 홍반; (B) antrum의 덜 만곡 된 편평하고 우울한 홍반. |
내시경 검사에서 MPE 소견을 발견하면 MPE 부위와 비 MPE 부위 모두에 대해 생검을 수행했습니다. 비 -MPE 부위는 MPE 부위에서 3cm 이내에 위치한 인접 점막으로 정의되었습니다 (그림 2).
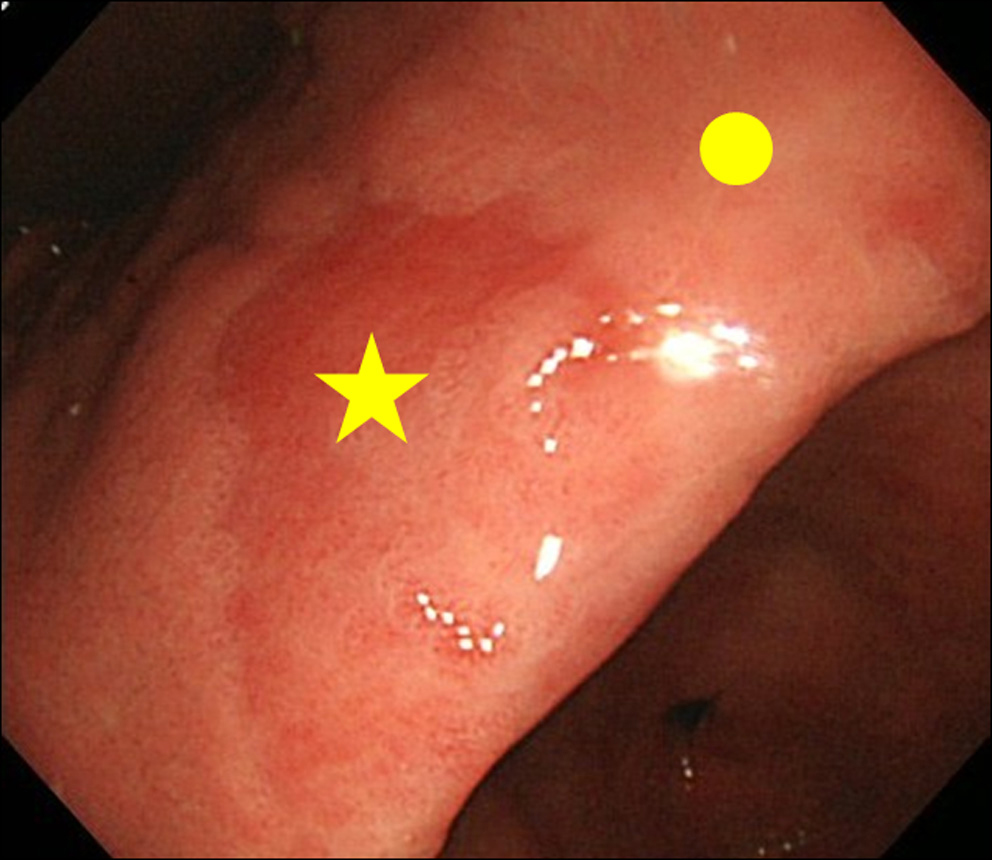 큰 이미지를 보려면 클릭 |
그림 2. 생검 사이트. (★) MPE의 생검 부위; (•) 비 -MPE의 생검 부위. 비 -MPE 부위는 MPE 부위의 3cm 이내에 위치한 인접 점막으로 정의되었습니다. |
위축성 경계의 범위는 Kimura와 Takemoto가 정의한대로 경증, 중등도 및 중증의 3 단계로 분류되었습니다.
조직 학적 평가
생검 표본이 10 % 완충 포르말린으로 고정 된 우리 실험실로 보내졌습니다. 시편을 가공하고 파라핀에 매립하고 4 µm 섹션으로 절단했습니다. 각 표본의 슬라이드는 hematoxylin-eosin (HE)을 사용하여 염색되었습니다 (그림 1a).3A) 및 면역 조직 화학 염색. 면역 조직 화학 염색은 다음과 같다. foveolar 상피 (그림 3C), (3) MUC6, 위 점액에 대한 마커, 신체의 목 영역의 점액 세포와 antrum의 유문선 (그림 3D), (4) CD10, a 소장의 브러시 경계를 감지하는 데 유용한 마커 (그림 3E) 및 (5) IM의 존재를 나타내는 마커 인 CDX2 (그림 3F). 최근 연구에 따르면 IM 땀샘에서 CDX2 발현이 광범위하게 관찰되고 Hp 박멸 후에도 사라지지 않는 것으로 나타났기 때문에 CDX2를 사용했습니다. IM의 존재는 HE와 immunohistochemical 염색으로 확인되었습니다.
IM의 하위 유형은 완전 또는 불완전 유형으로 분류되었습니다. 완전한 유형은 위 뮤신 (MUC5AC 또는 MUC6)의 감소 된 발현과 장 뮤신 (MUC2) 및 CD10의 공동 발현으로 정의되었습니다 (그림 3A-F). 불완전한 유형은 위 점액 (MUC5AC 또는 MUC6) 및 MUC2의 발현으로 정의되었습니다. 한 섹션에 완전 및 불완전 유형을 모두 포함하는 것으로 케이스를 분류하는 데 설정된 기준이 없기 때문에 IM 하위 유형을 일반적인 유형으로 할당했습니다.
IM은 업데이트 된 시드니 시스템 (0 : 없음, 1 : 약간, 2 : 보통, 3 : 표시)을 기반으로 채점되었습니다.
통계 분석
p>
우리는 환자가 MPE에 대해 양성인지 음성인지에 따라 환자를 두 그룹으로 나누었습니다. 우리는 Student ‘s t-test를 사용하여 연령과 박멸 기간을 비교했습니다. 두 그룹의 성별 비율과 내시경 위축 정도는 카이 제곱 테스트 또는 Fisher의 정확한 확률 테스트를 사용했습니다.
또한 MPE 부위와 비 -MPE 부위 간의 조직 학적 결과를 비교했습니다. 두 생검 부위의 차이점을 비교하기 위해 IM에 Wilcoxon Matched-Pairs Signed-Ranks Test를 사용했습니다. IM, IM 아형 및 IM 표현형의 유병률에 대한 중앙값과 Fisher의 정확한 검정. 병리 적 IM 검출을 위해 내시경에서 관찰 된 MPE의 민감도, 특이성, 양성 및 음성 예측 값, 양성 및 음성 가능성 비율을 계산했습니다. P 값 < 0.05가 유의미한 것으로 간주되었습니다. 모든 통계 분석은 Stata 소프트웨어 버전 10 (StataCorp LP, College Station, TX, USA)을 사용하여 수행되었습니다.
| 결과 | ▴ 상단 |
환자 특성
연구 기간 동안 157 명의 환자 상부 내시경 검사를 받고 Hp 박멸을받은 사람을 검토했습니다. 157 명의 환자 중 52 명을 제산제 사용 (31), 항 혈전 약물 (17) 또는 NSAID (3)에 대한 분석에서 제외했습니다. 또는 간경변 (5), 심부전 (1) 또는 조기 위암 (2)의 병력. 일부 환자에게는 하나 이상의 제외 기준이 적용되었습니다.
따라서 제외 후 분석을 위해 총 102 명의 환자가 선택되었습니다. 이 중 55 명 (54 %)의 MPE 환자가있었습니다. MPE 양성 환자와 음성 환자 사이의 평균 연령과 성별에는 유의 한 차이가 없었다 (표 1). Hp 박멸 기간 이후에는 두 그룹간에 큰 차이가 없었다. 그러나 중증도 (중등도에서 중증)의 위 위축은 MPE 음성 그룹에 비해 MPE 양성 그룹에서 훨씬 더 자주 나타났습니다 (양성 65.6 % 대 음성 45.0 %, P = 0.035).
 보려면 클릭 |
표 1. 환자의 인구 통계 학적 특성 (n = 102) |
내시경 소견 및 병리학 적 특징
 보려면 클릭 |
표 2. MPE와 비 MPE 사이트 간의 IM 점수 비교 (n = 55) |
MUC2, MUC5AC, MUC6, C의 발현에서 유의 한 연관성이 관찰되지 않았습니다. MPE 사이트와 비 -MPE 사이트 간의 D10 및 CDX2 (표 3). 두 그룹간에 IM 하위 유형의 비율 (완전 / 불완전)에는 유의 한 차이가 없었습니다 (MPE : 18/30 대 비 -MPE : 8/10, P = 0.778).
 보려면 클릭하세요. |
표 3. 장 Metaplasia의 표현형 및 하위 유형 |
| 토론 | ▴Top |
이 연구에서 우리는 HP 박멸 후 내시경에서 보이는 독특한 홍반 모양에 초점을 맞추 었습니다. 우리는이 발견을 “MPE”라고 불렀고 내시경에서 볼 수있는 MPE의 존재가 일반적으로 병리학 적 IM의 특징임을 발견했습니다.
기존 내시경을 통한 IM 진단은 다음과 같습니다. IM은 일반적으로 평평한 점막에 나타나고 형태 학적 변화가 거의 없기 때문에 어려운 것으로 간주되었습니다 Kaminishi 등은 IM의 지표로 “회색 결절 변화”를보고했습니다. 이 조사자들의 결과의 정확도는 98-99 %로 높았지만 민감도는 낮았습니다 (6-12 %). Kaminishi 등은 기존의 내시경 검사가 IM 진단을 확인하는 데 덜 유용하다고 지적했습니다. 확대 내시경을 이용한 IM의 내시경 소견에 관한 최근 연구가 나타났습니다. Methylene blue chromoendoscopy에서 보이는 위 구덩이의 독특한 소견과 confocal endoscopy에서 보이는 “villus-like appearance”가 IM 진단에 유용하다고보고되었습니다. Uedo et al은 “a light blue crest”( LBC)는 협 대역 영상 (NBI) 확대 내시경에서 볼 수 있듯이 IM의 존재에 대한 정확한 신호입니다. 그러나 높은 장비 비용과 NBI 또는 확대 내시경과 같은 특수 도구를 사용한 면밀한 검사에 필요한 추가 기술과 시간으로 인해이 장비를 사용한 스크리닝은 일상적인 임상 실습에서 실용적이지 않습니다. 또한 메틸렌 블루에 이어 백색광을 사용하여 크로 모 내시경을 사용하면 위장 점막의 DNA 손상 위험이 높아져 사용시주의가 필요합니다. 따라서 색채 내시경 및 확대 내시경없이 MPE를 찾아서 IM을 진단하는 것이 더 유리합니다. 우리의 연구 결과에 따르면 IM의 존재는 생검없이 표준 내시경으로 진단 할 수 있습니다.
Hp 박멸 후에도 왜 MPE가 관찰 될 수 있습니까? 이것은 위 점막 내의 조직 학적 변화 때문일 수 있습니다. 박멸 후 현저한 조직 학적 변화는 염증 세포의 침윤, 상피 증식 및 부종의 개선을 포함합니다. 개선 된 것으로 보이는 홍반 및 부종성 점막의 내시경 영상은 이러한 조직 학적 변화를 반영합니다. 따라서 우리는 MPE가 지속적인 홍 반성 IM의 나머지 영역과 성공적인 Hp 박멸로 인해 빠르게 회복 된 비 IM 영역으로 구성되어 있다고 추측합니다. Hp의 근절은 MPE 영역과 비 MPE 영역 사이의 대비를 더 명확하게 만들었습니다. 그러나 MPE 부위 만 홍 반성 점막으로 관찰되는 이유는 알려져 있지 않습니다. 매우 조밀 한 미세 혈관 영역이 변성 선을 둘러싸고 있다고 추론 할 수 있습니다. 이것은이 연구에서 밝혀지지 않았습니다. 또한 MPE 사이트의 IM 점수는 비 MPE 사이트의 점수보다 훨씬 높았습니다. 우리는 홍 반성 점막의 출현이 많은 화생 샘의 존재와 관련이 있다고 추측합니다.
현재 연구는 IM 완전 아형이 위 점막에서 주로 발견된다는 것을 보여주었습니다. . IM의 하위 유형은 완전 또는 불완전 유형으로 분류되었습니다. 이들은 가장 널리 사용되는 하위 유형입니다. 여러 연구에 따르면 완전 형은 암종 발병 위험이 증가하지 않는 반면 불완전 형은 악성 전이 위험 증가와 관련이 있습니다. 그러나 아형과 위암의 위험 사이의 연관성은 널리 받아 들여지지 않습니다. 현재 표준 내시경을 사용하여 두 가지 아형을 식별하는 것은 어렵습니다.
Hp 제균 요법이 위장 궤양뿐 아니라 위장 궤양도 예방하는 데 효과적이라고보고되었습니다. 위암의 발생. 이러한 Hp 박멸 요법의 사용은 가까운 장래에 임상 실습에서 나타날 것입니다. 그러나 Hp 박멸 후 위암 발병 위험에주의해야합니다. 박멸 후 위암의 특징은 병리학 적으로 심각한 신체 내 IM과 내시경에서 발견 된 심각한 위 위축을 포함하는 것으로보고되었습니다. 따라서 HP 박멸 후에도 IM의 존재를주의 깊게 관찰 할 필요가 있습니다.
결론적으로 내시경 검사에서 MPE의 존재는 병리 적 IM의 특징입니다.chromoendoscopy 또는 magnifying endoscopy없이 병리학 적 IM을 진단 할 수있는 것은 임상 실습에서 유익 할 것입니다. MPE는 HP 박멸 시대에 위암 위험에 대한 예측 결과가 될 가능성이 있습니다.
감사
병리학 적 평가와 관련하여이 연구에 자문 서비스를 제공 한 와타나베 히데노부 박사와 오타 히로 요시 박사를 인정합니다. 데이터 수집에 도움을 주신 임상 연구 코디네이터 인 Hisae Kawashiro에게 감사를 표합니다.
Grant 지원
이 작업은 Grant of National Center for Global Health and Medicine (21-108)의 지원을 받았습니다.
이해 상충
저자는 이해 상충이 없음을 선언합니다.
| ▴ 상단 |
- Correa P. 인간 위 발암 : 다단계 및 다 인성 과정 — 암에 대한 최초의 미국 암 협회 상 강의 역학 및 예방. Cancer Res. 1992; 52 (24) : 6735-6740.
게시 됨 - Leung WK, Sung JJ. 기사 검토 : 장의 화생 및 위 발암. Aliment Pharmacol Ther. 2002; 16 (7) : 1209-1216.
pubmed doi - Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, et al. 헬리코박터 파일로리 감염 및 위암 발병. N Engl J Med. 2001; 345 (11) : 784-789.
pubmed doi - Kimura K, Takemoto T. 위축성 경계와 만성 위염에서의 중요성에 대한 내시경 인식. 내시경. 1969; 1 : 1-3.
- Satoh K, Kimura K, Taniguchi Y, Kihira K, Takimoto T, Saifuku K, Kawata H, et al. 헬리코박터 파일로리 감염의 진단 및 위축성 위염의 정도 평가에 적합한 생검 부위. J Gastroenterol입니다. 1998; 93 (4) : 569-573.
pubmed doi - Kaminishi M, Yamaguchi H, Nomura S, Oohara T, Sakai S, Fukutomi H, Nakahara A, et al. 위염 연구회에서 실시한 파일럿 연구에 근거한 만성 위염의 내시경 분류. 다이제스트 Endosc. 2002; 14 : 138-151.
- Rugge M, Leandro G, Farinati F, Di Mario F, Sonego F, Cassaro M, Guido M, et al. 위 상피 이형성증. 임상 병리학 적 배경이 관리와 어떻게 관련되는지. 암. 1995; 76 (3) : 376-382.
pubmed doi - Nagata N, Akiyama J, Uemura N. 헬리코박터 파일로리 박멸 후 위 장내 증식의 내시경 진단. 내시경. 2009; 41 (suppl I) : A212.
- Dixon MF, Genta RM, Yardley JH, Correa P. 위염 분류 및 등급. 업데이트 된 시드니 시스템. 1994 년 휴스턴 위염의 조직 병리에 관한 국제 워크숍. Am J Surg Pathol. 1996; 20 (10) : 1161-1181.
pubmed doi - Ho SB, Shekels LL, Toribara NW, Kim YS, Lyftogt C, Cherwitz DL, Niehans GA. 정상, 전 종양 및 신 생물 인간 위 상피에서 뮤신 유전자 발현. Cancer Res. 1995; 55 (12) : 2681-2690.
게시 됨 - Silva E, Teixeira A, David L, Carneiro F, Reis CA, Sobrinho-Simoes J, Serpa J, et al. 뮤신은 위장의 장상 화를 분류하는 핵심 분자입니다. Virchows Arch. 2002; 440 (3) : 311-317.
pubmed doi - Reis CA, David L, Correa P, Carneiro F, de Bolos C, Garcia E, Mandel U, et al. 인간 위장의 장의 화생은 점액 (MUC1, MUC2, MUC5AC 및 MUC6) 발현의 뚜렷한 패턴을 나타냅니다. Cancer Res. 1999; 59 (5) : 1003-1007.
게시 됨 - Groisman GM, Amar M, Livne E. CD10 : 미세 악성 봉입 질환 (가족 성 미세 악성 위축)의 광학 현미경 진단에 유용한 도구입니다. J Surg Pathol입니다. 2002; 26 (7) : 902-907.
pubmed doi - Carl-McGrath S, Lendeckel U, Ebert M, Wolter AB, Roessner A, Rocken C. The ectopeptidases CD10, CD13, CD26 및 CD143은 위암에서 상향 조절됩니다. Int J Oncol. 2004; 25 (5) : 1223-1232.
pubmed - Bai YQ, Yamamoto H, Akiyama Y, Tanaka H, Takizawa T, Koike M, Kenji Yagi O, 외. 장의 화생 및 위 암종에서 호 메오 도메인 단백질 CDX2의 이소성 발현. Cancer Lett. 2002; 176 (1) : 47-55.
pubmed doi - Satoh K, Mutoh H, Eda A, Yanaka I, Osawa H, Honda S, Kawata H, et al. 장의 화생이 있거나없는 위 점막에서 CDX2의 비정상적인 발현 : 헬리코박터 파일로리의 박멸 효과. 헬리코박터. 2002; 7 (3) : 192-198.
pubmed doi - Dinis-Ribeiro M, da Costa-Pereira A, Lopes C, Lara-Santos L, Guilherme M, Moreira-Dias L, Lomba- Viana H, et al. 위 장화 생 및 이형성증 진단을위한 확대 색소 내시경. Gastrointest Endosc. 2003; 57 (4) : 498-504.
pubmed doi - Areia M, Amaro P, Dinis-Ribeiro M, Cipriano MA, Marinho C, Costa-Pereira A, Lopes C, et al. 전 악성 위 병변에서 메틸렌 블루 배율 크로 모 내시경에 대한 분류의 외부 검증. Gastrointest Endosc. 2008; 67 (7) : 1011-1018.
pubmed doi - Yang JM, Chen L, Fan YL, Li XH, Yu X, Fang DC. 위 점막의 내시경 패턴과 임상 병리학 적 중요성. World J Gastroenterol. 2003; 9 (11) : 2552-2556.
게시 됨 - Uedo N, Ishihara R, Iishi H, Yamamoto S, Yamada T, Imanaka K, Takeuchi Y, et al. 위장의 화생을 진단하는 새로운 방법 : 확대 내시경을 이용한 협 대역 영상. 내시경. 2006; 38 (8) : 819-824.
pubmed doi - Kiesslich R, Jung M. 확대 내시경 : 위장 신 생물 진단을위한 점막 표면 분석을 개선합니까? 내시경. 2002; 34 (10) : 819-822.
게시 된 doi - Olliver JR, Wild CP, Sahay P, Dexter S, Hardie LJ. Barrett ‘s oesophagus. Lancet. 2003; 362 (9381) : 373-374.
pubmed doi - Oda Y , Miwa J, Kaise M, Matsubara Y, Hatahara T, Ohta Y. 헬리코박터 파일로리 박멸 후 위 점막의 조직 학적 및 내시경 적 변화에 대한 5 년 추적 연구. Dig Endosc. 2004; 16 : 213-18.
- Tepes B, Kavcic B, Zaletel LK, Gubina M, Ihan A, Poljak M, Krizman I. 헬리코박터 후 위 점막의 2 ~ 4 년 조직 학적 추적 관찰 pylori 박멸. J Pathol. 1999; 188 (1) : 24-29.
pubmed doi - Jass JR, Filipe MI. 정상 위의 뮤신 프로필 점막, 장 화생 및 그 변이 및 위암. Histochem J. 1981; 13 (6) : 931-939.
pubmed doi - Filipe MI, Munoz N, Matko I, Kato I, Pompe-Kirn V, Jutersek A, Teuchmann S, 외. 장의 화생 유형 및 위의 위험 암 : 슬로베니아의 코호트 연구. Int J Cancer. 1994; 57 (3) : 324-329.
pubmed doi - Rokkas T, Filipe MI, Sladen GE. 면밀히 추적 관찰 한 제 3 형 장화 이성 환자에서 조기 위암 발생률 증가 발견. 배짱. 1991; 32 (10) : 1110-1113.
pubmed doi - Genta RM, Rugge M. 리뷰 기사 : 위 점막의 종양 전 상태-난처한 임상의를위한 실용적인 접근 방식. Aliment Pharmacol Ther. 2001; 15 (Suppl 1) : 43-50.
게시 됨 - Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, Terao S, et al. 헬리코박터 파일로리의 박멸이 조기 위암의 내시경 적 절제술 후 중기 성 위암 발병률에 미치는 영향 : 공개 라벨, 무작위 대조 시험. 랜싯. 2008; 372 (9636) : 392-397.
게시 된 doi - Tashiro J, Miwa J, Tomita T; Matsubara Y, Oota Y. Helicobacter pylori 박멸 후 발견 된 위암. 소화기 내시경. 2007; 19 : 167-173.
크리에이티브 커먼즈 저작자 표시 라이선스 조건에 따라 배포되는 오픈 액세스 기사입니다. 원본 작업이 적절하게 인용되는 경우 모든 매체에서 제한없이 사용, 배포 및 복제 할 수 있습니다.
Gastroenterology Research는 Elmer Press Inc.에서 발행합니다.