카드뮴 요소 정보
화학 원소 카드뮴은 전이 금속으로 분류됩니다. 1817 년 Friedrich Stromeyer에 의해 발견되었습니다.

데이터 영역
| 분류 : | 카드뮴 전이 금속입니다. |
| 색상 : | 청백색 |
| 원자량 : | 112.41 |
| 상태 : | 고체 |
| 녹는 점 : | 321.1 oC, 594.3 K |
| 끓는점 : | 765 oC, 1038 K |
| 전자 : | 48 |
| 양성자 : | 48 |
| 중성자 가장 풍부한 동위 원소 : | 66 |
| 전자 껍질 : | 2,8,18,18,2 |
| 전자 구성 : | 4d10 5s2 |
| 밀도 @ 20oC : | 8.65g / cm3 |
열, 에너지, 산화, 반응,
화합물, 반경, 전도도
| 원자 부피 : | 13.1 cm3 / mol |
| 구조 : | hcp : 육각형 마감 포장 |
| 경도 : | 2.0 mohs |
| 비열 | 0.23 J g-1 K-1 |
| 융해열 | 6.192 kJ mol-1 |
| 무화 열 | 112 kJ mol-1 |
| 기화열 | 99.87 kJ mol-1 |
| 1 차 이온화 에너지 | 867.7 kJ mol-1 |
| 2 차 이온화 에너지 | 1631.4 kJ mol-1 |
| 3 차 이온화 에너지 | 3616.2 kJ mol-1 |
| 전자 친 화성 | – |
| 최소 산화수 | 0 |
| 최소 일반적인 산화 번호 | 0 |
| 최대 산화 번호 | 2 |
| 최대. 일반적인 산화 번호. | 2 |
| 전기 음성도 (폴링 스케일) | 1.69 |
| 분 극성 부피 | 7.2 Å3 |
| 공기와의 반응 | 온화함, w / ht ⇒ CdO |
| 15M HNO3와의 반응 | 온화한 ⇒ Cd (NO3) 2, NOx |
| 6M HCl과의 반응 | 마일드, ⇒ H2, CdCl2 |
| 6M NaOH와의 반응 | 없음 |
| 산화물 (s) | CdO, CdO2 |
| 수 소화물 | CdH2 |
| 염화물 | CdCl2 |
| 원자 반경 | 151 pm |
| 이온 반경 (1+ 이온) | – |
| 이온 반경 (2+ 이온) | 109 pm |
| 이온 반경 (3+ 이온) | – |
| 이온 반경 (1- 이온) | – |
| 이온 반경 (2- 이온) | – |
| 이온 반경 (3- 이온) | – |
| rmal 전도도 | 96.6 W m-1 K-1 |
| 전기 전도도 | 14.7 x 106 S m-1 |
| 어는점 / 어는점 : | 321.1 oC, 594.3 K |

크기 참조 용 동전과 함께 카드뮴 금속으로 된 작은 공입니다.

1817 년에 카드뮴을 발견 한 Friedrich Stromeyer.
카드뮴의 주기율표 이웃
| 그룹 11 |
그룹 12 | 그룹 13 | |
| 4 | 29 Cu |
30 Zn |
31 Ga |
| 5 | 47 Ag |
48 Cd |
49 입력 |
| 6 | 79 Au |
80 Hg |
81 Tl |
카드뮴의 발견
카드뮴은 1817 년 독일 화학자 Friedrich Stromeyer에 의해 산화 아연의 불순물로 발견되었습니다. (1)
Stromeyer는 독일 힐 데스 하임 (Hildesheim) 마을에있는 약국을 검사 해 달라는 정부의 요청에 따라 발견했습니다.
그 당시에는 산화 아연이 피부 상태를 치료하는 데 사용되었습니다. 어떤 이유로 Hildesheim의 약국에서는 일반적인 산화 아연이 아닌 탄산 아연을 판매하고있었습니다.
Stromeyer는 탄산 아연을 붉게 뜨거워 질 때까지 가열하면 산화 아연으로 전환된다는 사실을 알고있었습니다. 그는 약국에서 얻은 샘플로 이것을했습니다. 그는 반짝이는 백색 탄산염이 백색이어야하지만 실제로는 노란색 / 주황색 인 산화물로 변했다는 것을 발견했습니다.
일반적으로이 색상은 철 또는 납 오염을 암시하지만 Stromeyer는 흔적을 찾을 수 없습니다.
그는 약국에서 탄산 아연을 구입 한 잘 츠기 터의 공장을 방문했습니다. 그는 왜 그들이 일반적인 산화물 대신 탄산 아연을 판매하는지 물었습니다.
관리자는 탄산 아연이 예상되는 색인 흰색이며 판매하기 쉽다고 설명했습니다.
가열을 통해 탄산염을 산화물로 전환하려고했을 때, 항상 노란색으로 변했습니다. 산화 아연은 흰색이어야하므로 팔 수 없었습니다. 그들은 철 오염에 대해 신중하게 분석했지만 아무것도 찾을 수 없었습니다.
Stromeyer는이 노란색 산화 아연을 신중하게 분석하기로 결정했습니다. 그는 노란색이 “지금까지 의심되지 않았던 특이한 금속 산화물의 존재”에 기인한다는 것을 발견했습니다.
그는 산화 아연에서이 새로운 금속 산화물을 추출한 다음 환원시켜 세계 최초의 카드뮴 금속을 분리했습니다. 그는 백금의 외관을 백금에 비유하고 밀도를 8.75g / cm3로 측정하여 오늘날과 매우 유사합니다.
그는 추가 작업을했고 다른 아연 화합물에도 그의 새로운 금속이 포함되어 있음을 발견했습니다. 그는 ‘순수한’아연 금속을 분석 한 결과 그의 새로운 금속이 여기에도 존재한다는 사실을 발견했습니다.
그는 새로운 금속이 아연과 그 화합물에 0.1 %에서 1 % 사이로 존재한다고 추정했으며, 이로부터 순수한 카드뮴 금속 3g을 분리 할 수있었습니다.
Stromeyer는 카드뮴의 이름을 제안했습니다. ‘cadmia’의 이름은 calamine의 라틴어 이름입니다. Calamine은 아연 광석의 오래된 이름입니다.
카드뮴은 1818 년 독일 화학자 Karl Hermann에 의해 독립적으로 발견되었습니다. Hermann은 아연 황화물에서 예기치 않은 노란색을 발견했습니다. . 노란색은 비소 불순물에서 나온 것으로 추정되었지만 Hermann은 실제로 이전에 알려지지 않은 요소 때문이라는 것을 깨달았습니다. ment. (2)


카드뮴 텔루 라이드는 박막 태양 전지를 만드는 데 사용됩니다. 가시광 선의 90 % 이상을 흡수합니다. 이미지 : NREL
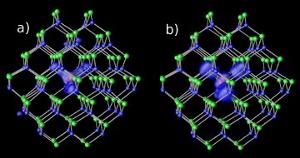
두 가지 갭 레벨에서 카드뮴-셀레늄 나노 결정의 마그네슘 불순물 : (a) 공명 및 (b) 하이브리드. 이미지 : NERSC
외관 및 특성
유해 영향 :
카드뮴 및 그 화합물 매우 독성이 있습니다.
특성 :
카드뮴은 부드럽고 가단하며 연성이있는 청백색 금속으로 칼로 쉽게자를 수 있습니다. 우수한 전기 전도체이며 화학 물질에 의한 부식 및 공격에 대한 저항성이 우수합니다.
화학적 특성이 아연과 여러면에서 유사합니다.
카드뮴은 공기 중에서 변색되며 산에 용해되지만 알칼리에는 용해되지 않습니다.
금속은 공기 중에서 연소하여 갈색 카드뮴 산화물 (CdO)을 형성합니다.
카드뮴 사용
카드뮴의 주요 용도는 배터리 (특히 충전식 니켈-카드뮴, NiCad, 배터리).
낮은 마찰 계수와 높은 피로 저항으로 인해 카드뮴은 베어링 합금에 사용됩니다. 카드뮴은 저 융점 합금에 사용되며 여러 종류의 땜납의 구성 요소입니다. 전기 도금에도 사용됩니다.
카드뮴을 함유 한 화합물은 흑백 텔레비전 형광체에 사용되며, 청색 및 녹색 형광체는 컬러 텔레비전 영상 튜브에 사용됩니다. 황화 카드뮴은 노란색 안료로 사용되며 카드뮴 셀레 나이드는 종종 카드뮴 레드라고 불리는 빨간색 안료로 사용됩니다.
카드뮴과 텔 루륨은 물리적 특성이 이상적인 CdTe 박막 태양 광 모듈로 합성 될 수 있습니다. 태양 전지 생산. 상대적으로 비용이 저렴하고 태양 에너지 수확을위한 거의 완벽한 밴드 갭이 있습니다.
풍부함과 동위 원소
풍부한 지각 : 150 억분의 일, 30 분의 1 몰
풍부한 태양계 : 중량으로 10 억분의 6, 몰로 1 조분의 70
비용, 순수 : 100g 당 $ 46
비용, 부피 : $ 0.77 100g 당
출처 : 카드뮴은 대부분 sphalerite (ZnS)와 같은 아연 광석과 관련된 소량으로 발생합니다. Greenockite (CdS)는 모든 결과의 유일한 카드뮴 광물입니다. 거의 모든 카드뮴은 아연, 구리 및 납 광석 정제 작업의 부산물로 얻어집니다.

- Friedrich Stromeyer, Annals of Philosophy, 편집 : Thomas Thomson, Volume XIII, 1819, Robert Baldwin, p108
- JW Mellor, A Comprehensive Treatise in Inorganic and Theoretical Chemistry, Volume IV, 1929, Longmans, Green and Co. Ltd., p404
이 페이지 인용
온라인 링크 용 , 다음 중 하나를 복사하여 붙여 넣으십시오.
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium</a>
또는
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium Element Facts</a>
To 학술 문서에서이 페이지를 인용하려면 다음 MLA 준수 인용을 사용하세요.
"Cadmium." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cadmium.html>.