세포 및 감염 미생물학의 경계
소개
포도상 구균은 전 세계적으로 입원 한 환자로부터 분리 된 중요한 인간 병원균으로, 병원 및 지역 사회 감염을 모두 유발합니다 ( Lowy, 1998). 이 병원체는 피부와 연조직, 근골격계 및 순환계에 영향을 미치는 여러 가지 전신 감염의 원인이되는 인자입니다 (Lowy, 1998; Changchien et al., 2016). S. aureus는 인간 단핵구 유래 대 식세포에서 생존 할 수 있다고보고되었습니다 (Kubica et al., 2008). S. aureus의 독성은 박테리아에 의해 생성되는 다양한 분비 효소 및 독소와 밀접한 관련이 있습니다 (Otto, 2014). 적혈구 막 손상을 촉진하고 백혈구의 식세포 기능을 손상시키고 독성 쇼크 증후군을 유도하는 Hemolysin, leukocidin (Panton–Valentine leukocidin, PVL) 및 독성 쇼크 증후군 독소 -1 (TSST-1)은 각각 S. aureus의 병원성 과정 (Löffler et al., 2010; Vandenesch et al., 2012; Berube and Bubeck Wardenburg, 2013; Andrey et al., 2015; Al Laham et al., 2015). 최근 연구에 따르면 hemolysin은 S. aureus 생물막의 형성에도 관여합니다 (den Reijer et al., 2016). 병원 및 지역 사회 환경에서 다제 내성 S. aureus 균주의 유병률이 증가함에 따라 S. aureus의 위험이 더욱 증가하고 임상 치료에 심각한 도전이되고 있습니다 (Voss and Doebbeling, 1995; Evangelista Sde and de Oliveira, 2015).
최근 우리 병원에서 불완전한 용혈 표현형 (SIHP)을 가진 S. aureus 계열에 속하는 많은 균주가 발견되었습니다. 이러한 SIHP 균주에 의한 용혈은 다른 S. aureus 균주에서 생성 된 완전한 용혈 고리 (β- 용혈 표현형)와 크게 다릅니다. 그러나 이러한 SIHP 균주는 아직 포괄적으로 확인되고 특성화되지 않았습니다. 이러한 SIHP 균주의 미생물 학적 특성을 조사하기 위해 60 개의 SIHP 균주를 수집하고 용혈 표현형, hemolysin 유전자 발현, 약물 내성 기능 및 독성을 포함한 여러 기준을 사용하여 연구했습니다. 이 연구는 SIHP가 β- 헤 몰리 신을 고도로 발현하고 독성 잠재력이 높은 메티 실린 내성 균주임을 보여줍니다.
재료 및 방법
박테리아 균주
Sixty SIHP 2013 년부터 2015 년까지 수초 대학교 제 2 부속 병원에 입원 한 환자로부터 균주를 분리 하였다. 분석을 위해 각 환자의 중복 샘플을 채취 하였다. 이들 분리 물은 5 % CO2 (v / v)를 포함하는 분위기에서 35 ° C에서 Columbia sheep blood agar plate (CHROMagar Company, Shanghai, China)에서 배양되었습니다. S. aureus로서 균주 식별은 Phoenix-100 자동화 미생물 시스템 (Becton, Dickinson and Company, USA)을 사용하여 확인되었습니다. 완전한 용혈 표현형을 가진 대조군 S. aureus 균주는 같은 기간 동안 우리 병원의 환자로부터 분리되었습니다. 여기서, 완전한 용혈 표현형을 가진 S. aureus를 SCHP 균주라고 부른다. S. aureus ATCC25923 참조 균주 (Shanghai Center for Clinical Laboratory, China)는 완전한 용혈 표현형을 가지고 있으며 대조 균주로도 작용합니다. 수초 대학교 제 2 부속 병원 의료 윤리위원회가이 연구를 승인했으며 모든 분리 주가 환자 동의하에 수집되었습니다.
불완전 용혈 표현형 비교 분석
The S. aureus 균주는 다른 회사 (CHROMagar, Autobio Diagnostics Co., Ltd., China 및 BioMérieux, China)의 시판 혈액 한천 플레이트와 Columbia blood agar powder (영국 옥사이드)를 사용하여 자체 준비된 양 혈액 한천 플레이트에서 배양되었습니다. 박테리아는 5 % CO2 (v / v)가 포함 된 분위기에서 35 ° C에서 24 시간 동안 배양 한 후 연속 계대를 거쳤습니다. 그런 다음 용혈 현상이 관찰되었습니다. 완전한 용혈 표현형을 가진 임상 적으로 분리 된 균주와 ATCC25923 참조 균주도 비교 분석을위한 대조군으로 관찰되었습니다.
역전사 실시간 정량을 사용한 S. aureus의 4 가지 Hemolysin 유전자의 mRNA 수준 측정 PCR (qPCR)
SIHP 및 ATCC25923 참조 균주로부터의 총 RNA 추출은 이전에 설명한대로 수행되었습니다 (Qin et al., 2014). 처음에는 lysostaphin, lysozyme 및 proteinase K를 사용하여 세포를 용해했습니다. 그런 다음 제조업체의 권장 프로토콜에 따라 RNeasy Mini Kit (Qiagen)를 사용하여 RNA를 추출하고 정제했습니다. NanoDrop1000을 사용하여 RNA 품질과 농도를 평가 한 다음 RNA를 역순으로 측정했습니다. -제조업체의 지침에 따라 역전사 키트 (Thermo Fisher Scientific Inc., USA)를 사용하여 cDNA로 전사했습니다.간단히 qPCR은 다음과 같이 수행되었습니다 : 94 ° C에서 3 분 동안 사전 변성, 94 ° C에서 30 초 동안 변성, 52 ° C에서 30 초 동안 어닐링, 72 ° C에서 40 초 동안 연신, 총 45 사이클 . 각 샘플에는 3 개의 기술적 반복과 3 개의 생물학적 반복이있었습니다. 4 개의 hemolysin 유전자와 16s rRNA 유전자 각각의 전사 프로파일은 2-ΔΔCt 방법을 사용하여 결정되었습니다. 전사 수준은 16s rRNA 유전자의 발현과 관련하여 결정되었습니다. 4 개의 hemolysin 유전자 (hla, hlb, hlgC 및 hld)의 서열은 GenBank 데이터베이스에서 검색되었습니다. Primer 5.0 소프트웨어를 사용하여 프라이머를 설계하고 (표 1) 이들 프라이머는 Sangon Biotech Co., Ltd. (중국 상하이)에서 합성했습니다.
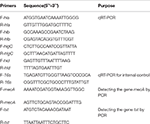
표 1.이 연구에 사용 된 입문서.
SPSS 17.0은 데이터 분석에 사용되었습니다. 측정 데이터는 x̄ ± s로 표시됩니다. 두 개의 독립적 인 샘플에 대한 T- 테스트를 사용하여 네 개의 헤 몰리 신 유전자 각각의 상대적 발현을 비교했습니다. 통계적 유의성은 p < 0.05로 정의되었습니다.
웨스턴 블롯에 의한 α- 헤 모리 신 (Hla) 발현 검출
SIHP 및 기준 균주 S. aureus ATCC25923은 탁도 측정기를 사용하여 5.0 McFarland로 조정되었다. 그런 다음 각 샘플에서 총 단백질을 추출하고 동일한 농도로 조정하고 SDS-PAGE 겔에서 전기 영동을 수행했습니다. 그런 다음 단백질을 니트로 셀룰로오스 막으로 옮기고 막을 5 % 탈지유로 1 시간 동안 차단했습니다. 염소 항-포도상 구균 α- 헤 몰리 신 폴리 클로 날 항체 (Abcam)를 최종 농도 2μg / mL로 첨가했습니다. 그 다음 반응 혼합물을 4 ° C에서 밤새 배양 하였다. 멤브레인을 세척 한 후 1 : 1000 희석 된 HRP 표지 토끼 항 염소 IgG 항체를 첨가하고 37 ° C에서 2 시간 동안 배양했습니다. 마지막으로, 발색을 위해 화학 발광 기판이 추가되었습니다. α- 헤 모리 신의 발현은 최종적으로 이미 저 아래에서 관찰되었습니다.
SIHP의 항균제 감수성 테스트
미세 역가 브로스 희석법을 사용하여 항균 감수성 스크리닝을 수행했습니다. 절차는 Phoenix-100 자동 미생물학 시스템의 운영 매뉴얼에 따라 수행되었습니다. 이 스크리닝 결과는 Clinical and Laboratory Standards Institute (CLSI, Clinical and Laboratory Standards Institute, 2014)에서 도입 한 M100-S24 기준을 사용하여 해석되었습니다. 메티 실린 내성 S. 아우 레 우스 (MRSA) 상태는 2 가지 항생제의 MIC (최소 억제 농도)를 사용하여 결정되었습니다. SIHP 균주의 경우 ≥4 μg / mL는 oxallicin의 MIC, ≥8 μg / mL는 cefoxitin의 MIC였습니다.
mecA 및 tst 유전자 검출
모든 60 SIHP 균주는 약물 내성 유전자 mecA 및 독성 유전자 tst에 대해 테스트되었습니다. lysostaphin을 사용하여 세포 용해 후 게놈 DNA의 비등 추출을 수행했습니다. mecA 및 tst 유전자는 DreamGreen Taq 키트를 사용하여 게놈 DNA에서 증폭되었습니다. PCR 조건은 다음과 같습니다 : 94 ° C에서 3 분 동안 사전 변성, 94 ° C에서 30 초 동안 변성, 50 ° C에서 30 초 동안 어닐링, 72 ° C에서 1 분 동안 연장. PCR 산물은 BLAST에 의해 시퀀싱되고 분석되어 예상 산물인지 검증되었습니다. 약물 내성 유전자 mecA 및 S. aureus의 독성 유전자 tst의 서열은 GenBank 데이터베이스에서 검색되었습니다. Primer 5.0 소프트웨어를 사용하여 프라이머를 설계하고 (표 1) 이들 프라이머는 Sangon Biotech Co., Ltd. (중국 상하이)에서 합성했습니다.
S. aureus SIHP 균주의 생존 검출 대 식세포
대 식세포에서 S. aureus SIHP 균주의 생존율과 tst 음성 S. aureus SCHP 균주의 생존율을 비교하기 위해 인간 단핵구 세포주 THP-1은 10 % (v)를 포함하는 RPMI-1640에서 유지되었습니다. / v) 5 % (v / v) CO2를 포함하는 대기에서 37 ° C의 FBS. 대 식세포 감염의 경우, THP-1 세포를 24 웰 조직 배양 접시에 웰당 5×105 세포로 시드하고 48 시간 동안 10-7M 포르 볼 12- 미리 스테이트 13- 아세테이트 (PMA)에 의해 분화하도록 유도했습니다. 대 수상 (OD600 0.5–0.6) 박테리아의 약 3×108 콜로니 형성 단위 (CFU)를 원심 분리에 의해 펠렛 화하고 PBS로 두 번 세척 한 다음 1ml의 RPMI-1640에 재현 탁했습니다. 그런 다음 박테리아를 20 : 1의 MOI로 세포 단층에 첨가하고 1000rpm에서 5 분 동안 원심 분리했습니다. 감염된 세포를 37 ° C에서 20 분 동안 배양 한 다음, 예열 된 PBS (pH 7.4)로 3 회 세척하고 100μg / ml 젠타 마이신을 포함하는 배지에서 추가로 1 시간 동안 배양하여 세포 외 박테리아를 죽였습니다. 세포를 세척하고 용해하여 시간 0 샘플 (T0)로서 세포 내 박테리아를 정량화했습니다. 추가 세포는 12μg / ml 젠타 마이신을 함유하는 신선한 보충 된 조직 배양 배지의 존재하에 12 시간 또는 24 시간 배양 후 수집되었다.THP-1 세포에서 박테리아의 성장은 12 시간 또는 24 시간에 세포 내 박테리아의 수를 시간 0 (T12 / T0 또는 T24 / T0)의 수로 나누어 결정했습니다. 실험은 독립적으로 3 회 반복되었습니다.
S. aureus SIHP 균주에 감염된 대 식세포의 사이토 카인 분비 검출
박테리아에 의해 12 시간 동안 감염된 THP-1 대 식세포의 배양 상청액은 다음과 같습니다. 모은. 사이토 카인 수준은 제조업체의 지침에 따라 CBA Human Thl / Th2 Cytokine Kit II (BD)를 사용하여 FACSCalibur 유세포 분석 (BD)으로 측정되었습니다.
다중 로커스 시퀀스 타이핑 및 분석
결과
양 한천 혈액 플레이트상의 SIHP 균주의 용혈 표현형
그림 1A, B에 나타난 바와 같이, 완전한 용혈 고리 (β- 용혈 표현형)가 대조군 S에서 관찰되었습니다. . aureus 균주를 혈액 한천 플레이트에 24 시간 배양 한 후의 균주. 그러나 SIHP 균주에서는 서로 다른 용혈 표현형 (여기서는 불완전 용혈 표현형이라고 함)이 나타 났으며, 다른 환경에서 성장한 SIHP 균주에서는 불완전 용혈 표현형이 관찰 될 수 있었다. 각각 미세 호기성, 호기성 및 혐기성 조건을 포함하는 조건 (그림 1C–E). 또한 10 개의 연속 계대 후에도이 불완전한 용혈 표현형이 여전히 유지되었습니다 (그림 1F).
상대 4 개의 Hemolysin 유전자의 mRNA 발현 수준
그림 2에서 볼 수 있듯이 SCHP 균주에서 4 개의 hemolysin 유전자 hla, hlb, hlgC 및 hld의 발현 수준은 통계적으로 유의 한 차이를 나타내지 않았습니다 (p > 0.05) 대조군 균주 ATCC25923과 비교했습니다. 그러나 SIHP 균주에서 hla, hlgC, hld의 발현 수준은 각각 50 배, 16.7 배, 8.3 배 (p < 0.05) 대조군 균주 ATCC25923 및 SCHP 균주, SIHP 균주의 hlb 발현은 대조군에 비해 7.7 배 유의하게 증가했습니다 (p < 0.05).
Western Blot에 의한 α-Hemolysin 검출
유전자 hla는 S. aureus에서 분비되는 기공 형성 독소이며 분자량은 33kDa입니다 (Andrey et al., 2015; Al Laham et al., 2015). Western blot 분석은 SIHP 균주에서 α-hemolysin의 발현이 SCHP 및 대조군 균주보다 40 배 낮았으며 이는 qRT-PCR 데이터와 일치합니다 (그림 3).

그림 3. S. aureus에서 α -hemolysin의 웨스턴 블롯. ATCC29213 : 완전한 용혈 표현형을 갖는 대조군 S. 아우 레 우스; SCHP : 동일한 기간에 임상 샘플에서 분리 된 완전한 용혈 표현형을 가진 S. aureus; SIHP : 불완전한 용혈 표현형을 가진 S. aureus.
SIHP의 약물 내성
약물 감수성 테스트 됨 microtiter broth dilutions를 사용하여 oxacillin과 cefoxitin의 MIC 값은 모두 60 개의 SIHP 염색에서 각각 > 2 및 > 8 μg / mL임을 입증했습니다. . CLSI M100-S24 지침에 따르면 60 개의 SIHP 균주는 모두 MRSA 균주로 분류됩니다. PCR은 또한 60 개 균주 모두에서 mecA 유전자를 검출했습니다.
tst 유전자 검사
tst 유전자는 S. aureus의 중요한 독성 인자입니다. PCR은 50 개의 SIHP 균주 모두가 tst 유전자를 가지고 있음을 보여주었습니다.
대 식세포에서 S. aureus SIHP 균주의 생존 능력은 tst Negative S. aureus의 생존 능력보다 큽니다.
우리는 비교했습니다. 대 식세포에서 SIHP 균주 및 tst 음성 SCHP 균주의 세포 내 생존 능력. 플레이트에서 회수 된 박테리아의 수를 세어 보면, 우리는 감염된 THP-1 유래 대 식세포 12 시간 또는 24 시간 후 SIHP 균주의 세포 내 생존 능력이 tst 음성 S. aureus 균주보다 훨씬 높음을 발견했습니다 (그림 4). 사전에 우리는 SIHP 균주가 잠재적으로 높은 독성을 가지고 있다고 추측했으며 SIHP는 병원에서 더 많은주의를 기울여야한다고 제안했습니다.
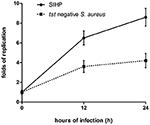
그림 4. THP-1 유래 대 식세포에서 SIHP 균주 및 tst 음성 S. aureus의 생존. 대 식세포를 박테리아에 의해 12 시간 및 24 시간 동안 감염시킨 후, 대 식세포를 용해시키고 세포 내 생존 박테리아를 LB 한천에 플레이 팅 하였다. 상기 LB 한천 플레이트상의 콜로니 수에 따라 세포 내 생존 균의 복제 배수를 계산 하였다.
The Secretion Differences S. aureus SIHP 균주 및 tst Negative S. aureus에 의해 감염된 대 식세포의 사이토 카인 및 케모카인 분석
SIHP 균주 및 tst 음성 S에 감염된 THP-1 유래 대 식세포에서 사이토 카인 및 케모카인의 분비 차이를 비교합니다.aureus 균주, 우리는 SIHP 균주 및 tst 음성 S. aureus 균주에 감염된 대 식세포의 배양 상청액에서 유세포 분석법에 의해 전 염증성 사이토 카인을 검출했습니다. 결과는 SIHP 균주에서 IL-2, IL-6 및 IL-17A의 유의하게 더 높은 유도를 보여 주었지만 tst 음성 S. aureus에 의한 것이 아니라 SIHP 균주가 대 식세포에서 사이토 카인 / 케모카인 반응을 유도함을 시사합니다 (그림 5). 대 식세포에 의해 분비되는 다른 사이토 카인 IL-4, IL-10, INF-γ 및 TNF는 SIHP 균주와 tst 음성 S. aureus 감염 그룹간에 명백한 차이가 없었습니다.
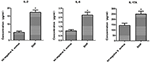
그림 5. S. aureus에 감염된 대 식세포에 의해 분비되는 사이토 카인 및 케모카인 검출. * P < 0.05.
다중 위치 시퀀스 입력
우리는 2013 년부터 2014 년까지 병원에 입원 한 환자로부터 수집 된 60 개의 SIHP 분리주의 다중 위치 유전자형을 결정했습니다. S. aureus MLST 데이터베이스에서 권장하는 7 개 위치 체계를 적용했습니다. MLST 분석에 따르면 모든 SIHP 균주는 ST5 클론으로 분류되었습니다.
토론
Hemolysin은 S. aureus의 가장 중요한 독성 인자 중 하나입니다 (Wiseman, 1975). 4 가지 종류의 hemolysin 각각의 결합 된 효과는 적혈구 막을 파괴하여 혈액 한천 플레이트에 완전한 투명한 용혈 고리를 형성합니다. 최근 수초 대학교 제 2 부속 병원 임상 샘플에서 SIHP가 발견됐다. 이 연구에서 우리는 이러한 균주를 식별하고 미생물학에서 그 특성을 연구하려고했습니다. 처음에, 우리는 균주를 분리, 배양 및 연속적으로 통과시키기 위해 다른 상업용 또는 자체 준비된 양 혈액 한천 플레이트를 사용했습니다. 우리는 장기간의 계대 배양 후에도 불완전한 용혈 표현형을 나타내고 유지하는 일부 균주가 있음을 보여주었습니다. 따라서이 표현형이 비 박테리아 인자에 의해 유도 될 가능성을 배제 할 수 있습니다. 우리의 연구는 SIHP가 독특한 S. aureus 균주의 하위 집합 일 수 있음을 시사합니다.
이전 연구는 토끼 적혈구가 α- 헤 몰리 신에 매우 민감하다고 제안했습니다 (Hildebrand et al., 1991). Berube et al. 적혈구 용해에 대한 α- 헤 몰리 신의 효과는 농도 의존적이라고보고했습니다 (Berube and Bubeck Wardenburg, 2013). γ- 헤 몰리 신은 인간과 동물의 적혈구를 손상시킬 수 있습니다 (Kaneko and Kamio, 2004). δ- 헤 몰리 신은 고농도에서만 적혈구를 손상 시키지만 세포막을 용해시키는 막 횡단 기공을 형성합니다 (Verdon et al., 2009). 이 연구에서 우리는 SIHP 균주와 SCHP 균주의 4 가지 헤 몰리 신의 발현이 전사 발현 프로파일이 상당히 다른 것을 보여 주었다. 적혈구를 직접 손상시킬 수있는 SIHP 균주에서 α-, γ-, δ-hemolysin의 발현은 SCHP 균주보다 훨씬 낮은 반면 β-hemolysin은 SCHP 균주에 비해 훨씬 더 높은 발현 수준을 보입니다. 또한, α- 헤 몰리 신의 단백질 발현 수준은 웨스턴 블롯에 의해 추가로 검증되었습니다. β- 헤 몰리 신은 세포가 저온에서 배양되지 않는 한, 세포를 직접 용해하는 대신 다른 독소에 대한 적혈구의 민감도를 주로 증가시키는 것으로보고되었습니다 (Vandenesch et al., 2012). 이 연구에서 β-hemolysin의 높은 발현은 SIHP 균주에서 검출되었지만 SIHP 균주에서는 4 ° C에서 배양해도 완전한 용혈 고리가 관찰되지 않았습니다. 이러한 결과는 SIHP 균주의 관찰 된 불완전한 표현형이 SCHP 균주와 비교하여 다른 방식으로 발현되는 모든 4 개의 헤 몰리 신의 효과 일 가능성이 가장 높다는 것을 시사한다. 이전 연구에 따르면 만성 발병 기간 동안 시프로플록사신과 트리 메토 프림을 포함한 항생제와 숙주 면역 반응으로 인한 선택적 압력의 결합 효과가 α- 헤 몰리 신의 발현을 증가시킬 수 있으며, 이는 S의 식민지화에 매우 중요합니다. . 특히 호흡기 감염에서 점막의 구균 (Goerke et al., 2006; Huseby et al., 2010). 이 연구에서 SIHP에 감염된 모든 환자는 광범위한 항생제의 장기 치료를 받았으며,이 선택적 압력이 약물 내성 유전자의 과발현을 유도하고 헤 몰리 신 유전자의 발현을 방해하는지 여부는 더 많은 가능성이 남아 있습니다.
SIHP의 미생물 학적 특성을 알아보기 위해 항균제 감수성 검사를 실시하고 S. aureus 병원성과 관련된 독성 유전자 tst를 선택했습니다. 우리는 60 개의 모든 SIHP 균주가 MRSA 균주로 분류 될 수 있고 mecA 유전자를 가지고 있음을 발견했습니다. 항균제 감수성 검사 결과,이 60 개의 SIHP 균주 중 10 개의 계대 후에도 SIHP 균주 3 개의 리네 졸리 드 및 테이 코 플라 닌의 MIC 값은 거의 변하지 않은 것으로 나타났습니다.그러나 이러한 MIC 값의 변화는 항균제 감수성 결과 평가에 영향을 미치지 않았습니다. 독성 유전자 tst는 독성 쇼크 증후군 독소 (TSST-1)를 암호화합니다 (Kreiswirth, 1989). 슈퍼 항원으로서 TSST-1은 내 독소에 의해 유도 된 충격 및 면역 억제 반응을 향상시킵니다 (Kulhankova et al., 2014). PCR 테스트는 모든 60 개의 SIHP 균주가 증가 된 독성을 암시하는 tst 유전자를 보유하고 있음을 발견했습니다. 최근 많은보고에 따르면 S. aureus는 인간 단핵구 유래 대 식세포에서 생존 할 수 있으며 이러한 S. aureus 균주는 더 독성이 강합니다 (Kubica et al., 2008; Tranchemontagne et al., 2015; Münzenmayer et al., 2016; Nandi 및 Bishayi, 2016). 따라서 우리는 대 식세포에서 tst 음성 S. aureus 인 SIHP 균주와 SCHP 균주의 세포 내 생존 능력을 비교 한 결과, SIHP 균주의 세포 내 생존 능력이 tst 음성 S. aureus 균주보다 훨씬 더 높은 것으로 나타났다. 또한 환자 데이터 분석에 따르면 SIHP 균주에 감염된 대부분의 환자에서 항 감염 요법의 효과가 SCHP 균주에 감염된 유사한 환자보다 더 나빴습니다 (데이터는 표시되지 않음). 우리의 연구는 SIHP 균주가 잠재적으로 높은 독성을 가지고 있다는 추측에 대한 예비 실험 증거를 제공합니다.
침습성 S. aureus의 감염 과정에서 병원체 관련 분자가 타고난 면역 체계를 시작하여 활성화 및 모집으로 이어집니다. 호중구 및 대 식세포와 염증성 사이토 카인, 특히 TNF-α, IL-1β 및 IL-6의 생성 (Bekeredjian-Ding et al., 2015; Giai et al., 2016; Zhao et al., 2016 ). 염증성 사이토 카인 IL-6의 분비는 S. aureus의 농도가 증가함에 따라 증가하는 것으로보고되었습니다 (Chen et al., 2016). 또한 초 항원 S. aureus는 IL-17 생산을 자극하는 데 특히 효율적입니다 (Islander et al., 2010). 이 연구에서, SIHP 균주는 tst 음성 SCHP 균주에 비해 대 식세포의 IL-2, IL-6 및 IL-17A의 유도가 유의하게 높았으며, 이는 SIHP 균주가 대 식세포의 살해 효과에 대해 더 많은 사이토 카인 분비를 유도 할 수 있음을 시사합니다. 또한 MLST 분석 결과 모든 SIHP 균주가 ST5 클론으로 분류 된 것으로 나타났습니다. 또한 이러한 SIHP 균주는 스파 유형 t2460 (데이터는 표시되지 않음)으로 그룹화되었습니다.
함께 살펴보면 SIHP는 잠재적으로 독성이 높은 MRSA의 새로운 하위 집합이 될 수 있으며 더 많은주의를 기울여야합니다. 병원에서 이러한 균주를 통제하고 치료합니다.
저자 기고
이해 상충 성명서
저자는이 연구가 광고가없는 상태에서 수행되었다고 선언합니다. 또는 잠재적 인 이해 상충으로 해석 될 수있는 재정적 관계.
감사 사항
이 연구는 중국 국립 자연 과학 재단 (81572032, 81401636), 자연 과학에 의해 지원되었습니다. 장쑤성 대학 및 대학 재단 (16KJB320006) 및 소주 과학 기술 프로그램 (SYSD2014094, SYS201551, SS201638).
임상 및 실험실 표준 연구소 (2014). 항균제 감수성 테스트를위한 M100-S24 성능 표준; 24 번째 정보 보충 자료. Wayne, PA : CLSI.
Nandi, A. 및 Bishayi, B. (2016). 식균 작용 후 세포 내에서 살아남은 황색 포도상 구균은 TLR-2를 가능한 표적으로 사용하는 신선한 쥐 복막 대 식세포에서 세포 독성을 유도하는 데 더 독성이 있습니다. Microb. Pathog. 97, 131–147. doi : 10.1016 / j.micpath.2016.06.007
PubMed 요약 | CrossRef 전체 텍스트 | Google 학술 검색
Wiseman, G. M. (1975). 황색 포도상 구균의 헤 몰리 신. Bacteriol. Rev. 39, 317–344.
PubMed 요약 | Google 학술 검색