Lösungen
Kolligative Eigenschaften
Dampfdruckabsenkung
Die physikalischen Eigenschaften können in zwei Kategorien unterteilt werden. Umfangreiche Eigenschaften (wie Masse und Volumen) hängen von der Größe der Probe ab. Intensive Eigenschaften (wie Dichte und Konzentration) sind charakteristische Eigenschaften der Substanz, sie hängen nicht von der Größe der untersuchten Probe ab. Dieser Abschnitt führt eine dritte Kategorie ein, die eine Teilmenge der intensiven Eigenschaften eines Systems ist. Diese dritte Kategorie, die als kolligative Eigenschaften bezeichnet wird, kann nur auf Lösungen angewendet werden. Per Definition ist eine der Eigenschaften einer Lösung eine kolligative Eigenschaft, wenn sie nur vom Verhältnis der Anzahl der gelösten Partikel und des Lösungsmittels in der Lösung abhängt, nicht von der Identität des gelösten Stoffes.
Nur sehr wenige physikalische Eigenschaften einer Lösung sind kolligative Eigenschaften. Als Beispiel für diesen begrenzten Satz physikalischer Eigenschaften betrachten wir, was mit dem Dampfdruck des Lösungsmittels passiert, wenn wir einen gelösten Stoff zur Bildung einer Lösung hinzufügen. Wir definieren Po als den Dampfdruck der reinen Flüssigkeit ![]() das Lösungsmittel
das Lösungsmittel ![]() und P als Dampfdruck des Lösungsmittels nach Zugabe eines gelösten Stoffes.
und P als Dampfdruck des Lösungsmittels nach Zugabe eines gelösten Stoffes.
Po = Dampfdruck der reinen Flüssigkeit oder des Lösungsmittels
P = Dampfdruck des Lösungsmittels in Lösung
Wenn die Temperatur einer Flüssigkeit unter ihrem Siedepunkt liegt Punkt, wir können annehmen, dass die einzigen Moleküle, die aus der Flüssigkeit entweichen können, um ein Gas zu bilden, diejenigen sind, die nahe der Oberfläche der Flüssigkeit liegen.
Wenn dem Lösungsmittel ein gelöster Stoff zugesetzt wird, nehmen einige der gelösten Moleküle den Raum nahe der Oberfläche der Flüssigkeit ein, wie in der folgenden Abbildung gezeigt. Wenn ein gelöster Stoff in einem Lösungsmittel gelöst wird, nimmt die Anzahl der Lösungsmittelmoleküle in der Nähe der Oberfläche ab und der Dampfdruck des Lösungsmittels nimmt ab.

Dies hat keinen Einfluss auf die Geschwindigkeit, mit der Lösungsmittelmoleküle in der Gasphase kondensieren, um eine Flüssigkeit zu bilden. Es nimmt jedoch ab, bei welcher Menge die Lösungsmittelmoleküle in der Flüssigkeit in die Gasphase entweichen können. Infolgedessen sollte der Dampfdruck des aus einer Lösung austretenden Lösungsmittels kleiner sein als der Dampfdruck des reinen Lösungsmittels.
| P | < | Po | ||
| Dampfdruck des Lösungsmittel über einer Lösung |
Dampfdruck des reinen Lösungsmittels |
Zwischen 1887 und 1888 zeigte Francois-Marie Raoult, dass der Dampfdruck einer Lösung gleich ist gleich dem Molenbruch des Lösungsmittels mal dem Dampfdruck der reinen Flüssigkeit.
| P | = | Csolvent Po | ||||
| Dampfdruck des Lösungsmittels über einer Lösung |
Dampfdruck des reinen Lösungsmittels |
Diese Gleichung, die als Raoultsches Gesetz bekannt ist, ist leicht zu verstehen. Wenn das Lösungsmittel rein ist und die Molenbruchfraktion des Lösungsmittels gleich 1 ist, ist P gleich Po. Da der Molenbruch des Lösungsmittels kleiner wird Der Dampfdruck des aus der Lösung austretenden Lösungsmittels wird ebenfalls geringer. Nehmen wir für den Moment an, dass das Lösungsmittel die einzige Komponente der Lösung ist, die flüchtig genug ist, um einen messbaren Dampfdruck zu haben. Wenn dies zutrifft, ist der Dampfdruck der Lösung gleich dem Dampfdruck des Lösungsmittels, das aus der Lösung austritt. Das Gesetz von Raoult legt nahe, dass der Unterschied zwischen dem Dampfdruck des reinen Lösungsmittels und der Lösung zunimmt, wenn der Molenbruch des Lösungsmittels abnimmt. Die Änderung des Dampfdrucks, die auftritt, wenn einem Lösungsmittel Asolute zugesetzt wird, beträgt daher eine kolligative Eigenschaft. Wenn es vom Molenbruch des gelösten Stoffes abhängt, muss es vom Verhältnis der Anzahl der Partikel des gelösten Stoffes zum Lösungsmittel in der Lösung abhängen, aber nicht von der Identität des gelösten Stoffes.
![]()
Siedepunkterhöhung und Gefrierpunkterniedrigung
Die folgende Abbildung zeigt die Folgen der Tatsache, dass gelöste Stoffe den Dampfdruck eines Lösungsmittels senken. Der Feststoff Die Verbindungspunkte B und C in diesem Phasendiagramm enthalten die Kombinationen von Temperatur und Druck, bei denen sich das reine Lösungsmittel und sein Dampf im Gleichgewicht befinden. Jeder Punkt in dieser Linie beschreibt daher den Dampfdruck des Reinlösungsmittels bei dieser Temperatur. Die gepunktete Linie in dieser Abbildung beschreibt die Eigenschaften einer Lösung, die durch Auflösen von Asolute in dem Lösungsmittel erhalten wird.Bei jeder gegebenen Temperatur ist der Dampfdruck des aus der Lösung austretenden Lösungsmittels kleiner als der Dampfdruck des reinen Lösungsmittels. Die gepunktete Linie liegt daher unterhalb der durchgezogenen Linie.
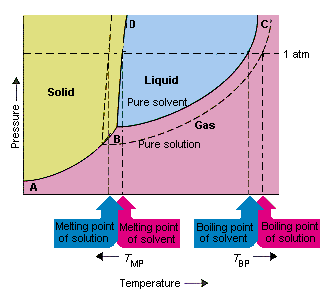
Die Abnahme in Der Dampfdruck des Lösungsmittels, der auftritt, wenn dem Lösungsmittel ein gelöster Stoff zugesetzt wird, bewirkt eine Erhöhung des Siedepunkts und eine Verringerung des Schmelzpunktes der Lösung.
Nach dieser Abbildung kann die Lösung bei der gleichen Temperatur nicht als reines Lösungsmittel kochen. Wenn der Dampfdruck von Das aus der Lösung austretende Lösungsmittel ist bei jeder gegebenen Temperatur kleiner als der Dampfdruck des reinen Lösungsmittels. Die Lösung muss vor dem Kochen auf eine höhere Temperatur erhitzt werden. Die Absenkung des Dampfdrucks des Lösungsmittels tritt auf, wenn es zur Bildung einer Lösung verwendet wird erhöht den Siedepunkt der Flüssigkeit.
Als Phasendiagramme eingeführt wurden, wurde der Tripelpunkt als die einzige Kombination von Temperatur und Druck definiert, bei der Gas, Flüssigkeit und Feststoff gleichzeitig existieren können. Die obige Abbildung zeigt dass der Tripelpunkt der Lösung bei einer niedrigeren Temperatur als der Tripelpunkt des reinen Lösungsmittels auftritt. An sich ist die Änderung des Tripelpunkts nicht wichtig. Aber dies führt zu einer Änderung der Temperatur, bei der die Lösung gefriert oder schmilzt warum, wir müssen aufpassen vollständig an der Linie, die die festen und flüssigen Bereiche im Phasediagramm trennt. Diese Linie ist fast vertikal, da der Schmelzpunkt einer Substanz nicht sehr druckempfindlich ist.
Das Hinzufügen eines gelösten Stoffes zu einem Lösungsmittel ändert nichts an der Art und Weise, in der der Schmelzpunkt vom Druck abhängt. Die Linie, die den festen und den flüssigen Bereich der Lösung trennt, verläuft daher parallel zu der Linie, die dieselbe Funktion für das reine Lösungsmittel erfüllt Diese Linie muss jedoch den Tripelpunkt für die Lösung durchlaufen. Die Abnahme des Tripelpunkts, die auftritt, wenn Asolute in einem Lösungsmittel gelöst wird, verringert daher den Schmelzpunkt der Lösung.
Die obige Abbildung zeigt, wie die Eine Änderung des Dampfdrucks, die auftritt, wenn sich ein gelöster Stoff in einem Lösungsmittel löst, führt auch zu Änderungen des Schmelzpunkts und des Siedepunkts des Lösungsmittels. Weil die Änderung des Dampfdrucks eine kolligative Eigenschaft ist, die nur von der relativen Anzahl von gelösten Stoffen und Lösungsmittelpartikeln abhängt Die Änderungen des Siedepunkts und des Schmelzpunkts des Lösungsmittels sind ebenfalls kolligative Eigenschaften.
![]()
Berechnungen der kolligativen Eigenschaften
Der beste Weg zu Dämonen Die Bedeutung kolligativer Eigenschaften besteht darin, die Konsequenzen des Gesetzes von Raoult zu untersuchen. Es wurde festgestellt, dass der Dampfdruck des Lösungsmittels, das aus der Lösung entweicht, proportional zum Molenbruch des Lösungsmittels ist.
P = CsolventPo
Der Dampfdruck eines Lösungsmittels ist jedoch keine kolligative Eigenschaft. Nur die Änderung des Dampfdrucks, die auftritt, wenn dem Lösungsmittel ein gelöster Stoff zugesetzt wird, kann unter den kolligativen Eigenschaften einer Lösung berücksichtigt werden.
Da Druck eine Zustandsfunktion ist, kann die Änderung des Dampfdrucks des Lösungsmittels, die auftritt, wenn dem Lösungsmittel ein gelöster Stoff zugesetzt wird, als Differenz zwischen dem Dampfdruck des reinen Lösungsmittels und dem Dampfdruck des Lösungsmittels definiert werden aus der Lösung entkommen.
P = Po – P
Das Einsetzen des Raoultschen Gesetzes in diese Gleichung ergibt das folgende Ergebnis.
P = Po – Csolvent Po = (1 – Csolvent) Po
Diese Gleichung kann vereinfacht werden, indem man sich an die Beziehung zwischen dem Molenbruch des gelösten Stoffes und der Molenbruchfraktion des Lösungsmittels erinnert.
Csolute + Csolvent = 1
Ersetzt dies Beziehung in die Gleichung, die Pgives eine andere Form von Raoults Gesetz definiert.
P = CsolutePo
Diese Gleichung erinnert uns daran, dass die Änderung des Dampfdrucks des Lösungsmittels, die auftritt, wenn dem Lösungsmittel ein gelöster Stoff zugesetzt wird, proportional zum Molenbruch des gelösten Stoffs ist. Wenn mehr Löslichkeit in dem Lösungsmittel gelöst wird, nimmt der Dampfdruck des Lösungsmittels ab und die Änderung des Dampfdrucks des Lösungsmittels nimmt zu.
Da Änderungen des Siedepunkts des Lösungsmittels (TBP), die auftreten, wenn einem Lösungsmittel ein gelöster Stoff zugesetzt wird, aus Änderungen des Dampfdrucks des Lösungsmittels resultieren, ist die Größe der Änderung des Siedepunkts ebenfalls proportional zur Molefraktion des gelösten Stoffes.
![]() TBP = kbsolute
TBP = kbsolute
In verdünnten Lösungen ist der Molenbruch des gelösten Stoffes proportional zur Molalität der Lösung, wie in gezeigt Die Abbildung unten.

Die Gleichung, die die Größe der Siedepunkterhöhung beschreibt, die auftritt, wenn ein gelöster Stoff einem Lösungsmittel zugesetzt wird, wird daher häufig wie folgt geschrieben.
![]() TBP = kbm
TBP = kbm
Hier ist ![]() TBP die Siedepunkterhöhung – Die Änderung des Siedepunkts, die auftritt, wenn sich ein gelöster Stoff in dem Lösungsmittel
TBP die Siedepunkterhöhung – Die Änderung des Siedepunkts, die auftritt, wenn sich ein gelöster Stoff in dem Lösungsmittel ![]() und kb löst, ist eine Proportionalitätskonstante, die als molare Siedepunkterhöhungskonstante für das Lösungsmittel bekannt ist.
und kb löst, ist eine Proportionalitätskonstante, die als molare Siedepunkterhöhungskonstante für das Lösungsmittel bekannt ist.
Eine ähnliche Gleichung kann geschrieben werden, um zu beschreiben, was mit dem Gefrierpunkt (oder Schmelzpunkt) eines Lösungsmittels passiert, wenn dem Lösungsmittel ein gelöster Stoff zugesetzt wird.
![]() TFP = -kfm
TFP = -kfm
In dieser Gleichung ist ![]() TFP der Gefrierpunkt Depression
TFP der Gefrierpunkt Depression ![]() die Änderung des Gefrierpunkts, die auftritt, wenn sich der gelöste Stoff im Lösungsmittel löst – und kf ist die molare Gefrierpunkterniedrigungskonstante für das Lösungsmittel. In dieser Gleichung wird ein negatives Vorzeichen verwendet, um anzuzeigen, dass der Gefrierpunkt des Lösungsmittels abnimmt, wenn ein gelöster Stoff hinzugefügt wird.
die Änderung des Gefrierpunkts, die auftritt, wenn sich der gelöste Stoff im Lösungsmittel löst – und kf ist die molare Gefrierpunkterniedrigungskonstante für das Lösungsmittel. In dieser Gleichung wird ein negatives Vorzeichen verwendet, um anzuzeigen, dass der Gefrierpunkt des Lösungsmittels abnimmt, wenn ein gelöster Stoff hinzugefügt wird.
Die Werte von kf und kbas sowie die Gefrierpunkte und Siedepunkte für eine Reihe reiner Lösungsmittel sind in den folgenden Tabellen angegeben.
Gefrierpunkt-Depressionskonstanten
Siedepunkt-Höhenkonstanten
Übungsaufgabe 6:
Berechnen Sie das Molekulargewicht von Schwefel, wenn sich 35,5 g Schwefel in 100,0 g CS2 lösen, um eine Lösung mit einem Siedepunkt von 49,48 ° C zu erhalten.
Klicken Sie hier, um Ihre Antwort auf Übungsaufgabe 6 zu überprüfen.
Klicken Sie hier, um eine Lösung für Übungsaufgabe 6 anzuzeigen.
Übungsaufgabe 7:
Bestimmen Sie das Molekulargewicht von Essigsäure, wenn eine Lösung 30,0 g Essigsäure pro enthält Kilogramm Wasser gefriert bei -0,93 ° C. Stimmen diese Ergebnisse mit der Annahme überein, dass Essigsäure die Formel CH3CO2H hat?
Klicken Sie hier, um Ihre Antwort auf Übungsaufgabe 7 zu überprüfen.
Klicken Sie hier, um eine Lösung für Übungsaufgabe 7 anzuzeigen.
Was würde bei der Berechnung in Übung passieren? Problem 7 wurde mit einer stärkeren Säure wie Salzsäure wiederholt?
Übungsaufgabe 8:
Erklären Sie, warum eine in Benzol gelöste 0,100 m HCl-Lösung eine Gefrierpunkterniedrigung von 0,512 ° C aufweist, während eine 0,100 m HCl-Lösung in Wasser eine Gefrierpunkterniedrigung von 0,352 ° C aufweist.
Klicken Sie hier, um Ihre Antwort auf Übungsaufgabe 8 zu überprüfen.
1884 Jacobus Henricus van „t Hoff führte einen weiteren Begriff in die Ausdrücke Gefrierpunkterniedrigung und Siedepunkterhöhung ein, um die kolligativen Eigenschaften von Lösungen von Verbindungen zu erklären, die dissoziieren, wenn sie sich in Wasser lösen.
![]() TFP = – kf (i) m
TFP = – kf (i) m
Einsetzen des experimentellen Wertes für die Gefrierpunkterniedrigung einer 0,100 m HCl-Lösung in diese Gleichung ergibt einen Wert für den i-Term von 1,89. Wenn HCl nicht in Wasser dissoziiert, wäre i 1. Wenn es vollständig dissoziiert, wäre ich 2. Der experimentelle Wert von 1,89 schlägt vor, dass mindestens 95% der HCl-Moleküle in dieser Lösung dissoziieren.
Übung Problem 9:
Erklären Sie, warum sich 0,60 g Essigsäure in 200 g Benzol lösen und eine Lösung bilden, die den Gefrierpunkt von Benzol auf 5,40 ° C senkt.
Klicken Sie hier, um Ihre Antwort zu überprüfen Übungsaufgabe 9
![]()
Osmotischer Druck
1784 entdeckte der französische Physiker und Geistliche Jean AntoineNollet, dass sich eine Schweineblase, die mit einer konzentrierten Lösung von Alkohol in Wasser gefüllt war, beim Eintauchen in Wasser ausdehnte. Die Blase fungierte als semipermeable Membran, die es Wassermolekülen ermöglichte, in die Lösung einzudringen, aber Alkoholmoleküle daran hinderte, sich in die andere Richtung zu bewegen. Die Bewegung einer Komponente einer Lösung durch eine Membran zum Verdünnen der Lösung wird als Osmose bezeichnet, und der erzeugte Druck wird als osmotischer Druck () bezeichnet. Der osmotische Druck kann mit der in der folgenden Abbildung gezeigten Vorrichtung demonstriert werden. Eine semipermeable Membran ist über das offene Ende eines Distelrohrs gebunden. Das Röhrchen wird dann teilweise mit einer Lösung von Zucker oder Alkohol in Wasser gefüllt und in einen Wasserbehälter getaucht. Wasser fließt in das Rohr, bis der Druck auf die Wassersäule aufgrund der Schwerkraft den kosmotischen Druck ausgleicht, der das Wasser durch die Membran treibt.

Wasser fließt durch Die semipermeable Membran verdünnt die Alkohollösung, bis die auf die Säule dieser Lösung herunterziehende Schwerkraft den osmotischen Druck ausgleicht, der das Wasser durch die Membran drückt.
Im selben Jahr entdeckte Raoult die Beziehung zwischen dem Dampfdruck einer Lösung und dem Dampfdruck eines Puresolvens, Jacobus Henricus van Hoff fand heraus, dass der osmotische Druck einer verdünnten Lösung () einer Gleichung entsprach, die der idealen Gasgleichung analog war.
| |
= | nRT | ||
| V |
Diese Gleichung legt nahe, dass der osmotische Druck ein weiteres Beispiel für eine kolligative Eigenschaft ist Der Druck hängt vom Verhältnis der Anzahl der gelösten Partikel zum Volumen der Lösung ab. ![]() n / V
n / V ![]() nicht von der Identität der gelösten Partikel erinnert uns auch an die Größe des osmotischen Drucks. Nach dieser Gleichung beträgt a 1,00 M s Die Lösung hat einen osmotischen Druck von 22,4 atm bei 0 ° C.
nicht von der Identität der gelösten Partikel erinnert uns auch an die Größe des osmotischen Drucks. Nach dieser Gleichung beträgt a 1,00 M s Die Lösung hat einen osmotischen Druck von 22,4 atm bei 0 ° C.

Dies bedeutet, dass eine 1,00-M-Lösung eine Wassersäule mit einer Höhe von 670 Zoll oder fast 56 Fuß tragen kann !
Biologen und Biochemiker nutzen häufig den osmotischen Druck, wenn sie die Bestandteile einer Zelle isolieren. Wenn eine Zelle zu einer wässrigen Lösung gegeben wird, die eine viel höhere Konzentration an Ionen als die Flüssigkeit in der Zelle enthält, verlässt Wasser die Zelle, indem es durch die Zellmembran fließt, bis die Zelle so stark schrumpft, dass die Membran bricht. Wenn eine Zelle in eine Lösung mit einer viel geringeren Ionenstärke gegeben wird, fließt alternativ Wasser in die Zelle und die Zelle dehnt sich aus, bis die Zellmembran platzt.
![]()