ATP-molekyl
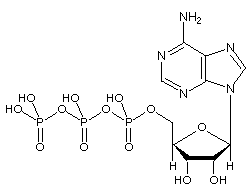
Adenosintrifosfat (ATP) -molekylet er det kjente nukleotidet i biokjemi som «molekylær valuta» for intracellulær energioverføring; det vil si at ATP er i stand til å lagre og transportere kjemisk energi i celler. ATP spiller også en viktig rolle i syntesen av nukleinsyrer.
For 3D-struktur av dette bildet ved hjelp av JsmolKlikk her
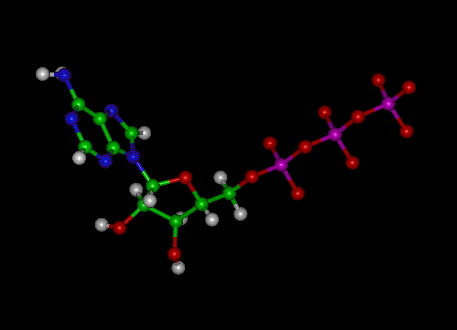
Bilde: Molekylær struktur av ATP
Energi frigjøres ved hydrolyse av den tredje fosfatgruppen. Etter at denne tredje fosfatgruppen er frigitt, kan det resulterende ADP (adenosindifosfat) absorbere energi og gjenvinne gruppen, og dermed regenerere et ATP-molekyl; dette gjør at ATP kan lagre energi som et oppladbart batteri.
Fosforylposisjoner
Fosforylgruppene som begynner med det på AMP blir referert til som alfa-, beta- og gammafosfater.
Fysiske og kjemiske egenskaper
ATP består av adenosin – sammensatt av en adeninring og et ribosesukker – og tre fosfatgrupper (trifosfat). Fosforylgruppene, startende med gruppen nærmest ribosen, blir referert til som alfa (α), beta (β) og gamma (γ) fosfater. Følgelig er det nært knyttet til adeninnukleotidet, en monomer av RNA. ATP er svært løselig i vann og er ganske stabil i oppløsninger mellom pH 6,8 og 7,4, men hydrolyseres raskt ved ekstrem pH. Derfor lagres ATP best som et vannfritt salt.
ATP er et ustabilt molekyl i ubufret vann, der det hydrolyserer til ADP og fosfat. Dette er fordi styrken på bindingene mellom fosfatgruppene i ATP er mindre enn styrken til hydrogenbindinger (hydratiseringsbindinger), mellom produktene (ADP og fosfat) og vann. Dermed, hvis ATP og ADP er i kjemisk likevekt i vann, vil nesten hele ATP til slutt konverteres til ADP. Et system som er langt fra likevekt inneholder Gibbs fri energi, og er i stand til å utføre arbeid. Levende celler opprettholder forholdet mellom ATP og ADP ved et punkt på ti størrelsesordener fra likevekt, med ATP-konsentrasjoner fem ganger høyere enn konsentrasjonen av ADP. Denne forskyvningen fra likevekt betyr at hydrolysen av ATP i cellen frigjør en stor mengde fri energi.
To fosfoanhydridbindinger (de som forbinder tilstøtende fosfater) i et ATP-molekyl er ansvarlig for det høye energiinnholdet i dette molekylet. I sammenheng med biokjemiske reaksjoner blir disse anhydridbindinger ofte – og noen ganger kontroversielt – referert til som høyenergibindinger (til tross for at det tar energi å bryte bindinger). Energi lagret i ATP kan frigjøres ved hydrolyse av anhydridbindinger. Den primære fosfatgruppen på ATP-molekylet som hydrolyseres når energi er nødvendig for å drive anabole reaksjoner er γ-fosfatgruppen. Ligger lengst fra ribosesukkeret, har den en høyere energi for hydrolyse enn enten α- eller β-fosfat. Bindingene dannet etter hydrolyse – eller fosforylering av en rest med ATP – har lavere energi enn fosfoanhydridbindinger av ATP. Under enzymkatalysert hydrolyse av ATP eller fosforylering av ATP, kan den tilgjengelige frie energien utnyttes av et levende system for å gjøre arbeid.
Ethvert ustabilt system av potensielt reaktive molekyler kan potensielt tjene som en måte å lagre gratis energi, hvis cellen opprettholdt konsentrasjonen langt fra likevektspunktet i reaksjonen. Imidlertid, som det er tilfellet med de fleste polymere biomolekyler, er nedbrytningen av RNA, DNA og ATP i enklere monomerer drevet av både hensyn til energiutgivelse og entropiøkning, i både standardkonsentrasjoner, og også de konsentrasjonene som oppstår i cellen.
Standard mengde energi frigjort fra hydrolyse av ATP kan beregnes ut fra endringene i energi under ikke-naturlige (standard) forhold, og deretter korrigeres til biologiske konsentrasjoner. Nettoendringen i varmeenergi (entalpi) ved standard temperatur og trykk for nedbrytningen av ATP til hydrert ADP og hydrert uorganisk fosfat er -30,5 kJ / mol, med en endring i fri energi på 3,4 kJ / mol. Energien som frigjøres ved spaltning av enten en fosfat (Pi) eller pyrofosfat (PPi) enhet fra ATP i standardtilstand på 1 M er:
ATP + H
2O → ADP + Pi ΔG ° = −30.5 kJ / mol (−7,3 kcal / mol)
ATP + H
2O → AMP + PPi ΔG ° = −45,6 kJ / mol (−10,9 kcal / mol)
Disse verdiene kan være brukes til å beregne endringen i energi under fysiologiske forhold og det cellulære ATP / ADP-forholdet. Imidlertid blir en mer representativ verdi (som tar AMP i betraktning) kalt Energy charge i økende grad benyttet. Verdiene gitt for Gibbs fri energi for denne reaksjonen er avhengige av en rekke faktorer, inkludert total ionestyrke og tilstedeværelsen av jordalkalimetallioner som Mg2 +
og Ca2 +
.Under typiske mobilforhold er ΔG omtrent -57 kJ / mol (-14 kcal / mol).
Syntese
ATP kan produseres ved forskjellige cellulære prosesser, mest i mitokondrier ved oksidativ fosforylering under katalytisk påvirkning av ATP-syntase eller i tilfeller av planter i kloroplaster ved fotosyntese.
De viktigste drivstoffene for ATP-syntese er glukose og fettsyrer. Opprinnelig brytes glukose ned i pyruvat i cytosolen. To molekyler av ATP genereres for hvert molekyl glukose. De terminale stadiene av ATP-syntese utføres i mitokondrionen og kan generere opptil 34 ATP.
ATP i menneskekroppen
Den totale mengden ATP i menneskekroppen er ca. 0,1 mol. Energien som brukes daglig av en voksen krever hydrolyse av 200 til 300 mol ATP. Dette betyr at hvert ATP-molekyl må resirkuleres 2000 til 3000 ganger i løpet av dagen. ATP kan ikke lagres, og syntesen må følges nøye med forbruket.
Andre trifosfater
Levende celler har også andre «høyenergi» nukleosidtrifosfater, for eksempel guanintrifosfat. Mellom dem og ATP kan energi lett overføres med reaksjoner som de som katalyseres av nukleosiddifosfokinase: Energi frigjøres når hydrolyse av fosfat-fosfatbindinger utføres. Denne energien kan brukes av en rekke enzymer, motoriske proteiner og transportproteiner for å utføre arbeidet i cellen. Hydrolysen gir også fritt uorganisk fosfat og adenosindifosfat, som kan brytes ned videre til et annet fosfation og adenosinmonofosfat. ATP kan også brytes ned til adenosinmonofosfat direkte, med dannelse av pyrofosfat. Denne siste reaksjonen har fordelen av å være en effektivt irreversibel prosess i vandig løsning.
Reaksjon av ADP med GTP
ADP + GTP > ATP + BNP