Fakta om Francium Element (Norsk)
Det kjemiske elementet francium er klassifisert som et alkalimetall. Det ble oppdaget i 1939 av Marguerite Perey.

Datasone
| Klassifisering: | Francium er et alkalimetall |
| Farge: | sølvgrå-metallisk (antatt) |
| Atomic vekt: | (223), ingen stabile isotoper |
| Tilstand: | solid |
| Smeltepunkt: | 27 oC, 300 K |
| Kokepunkt: | 677 oC, 950 K |
| Elektroner: | 87 |
| Protoner: | 87 |
| Nøytroner i mest isotop: | 136 |
| Elektronskall: | 2, 8,18,32,18,8,1 |
| Elektronkonfigurasjon: | 7s1 |
| Tetthet @ 20oC: | 1,873 g / cm3 |
Vis mer, inkludert: Heats, Energies, Oxidation,
Reaksjoner, forbindelser, radier, konduktiviteter
| Atomvolum: | 71,07 cm3 / mol |
| Struktur: | antas å være bcc: kroppssentrert kubikk |
| Hardhet: | – |
| Spesifikk varmekapasitet | – |
| Fusjonsvarme | 2 kJ mol-1 |
| Forstøvningsvarme | 73 kJ mol-1 |
| Fordampningsvarme | 64 kJ mol-1 |
| 1. ioniseringsenergi | 384 kJ mol-1 |
| 2. ioniseringsenergi | – |
| 3. ioniseringsenergi | – |
| Elektronaffinitet | – |
| Minimum oksidasjonsnummer | 0 |
| Min. vanlig oksidasjonsnr. | 0 |
| Maksimalt oksidasjonsnummer | 1 |
| Maks. vanlig oksidasjon nr. | 1 |
| Elektronegativitet (Pauling Scale) | 0.7 |
| Polariserbarhet volum | 48,7 Å3 |
| Reaksjon med luft | – |
| Reaksjon med 15 M HNO3 | – |
| Reaksjon med 6 M HCl | kraftig, ⇒ H2, FrCl |
| Reaksjon med 6 M NaOH | kraftig, ⇒ H2, FrOH |
| Oksid (er) | – |
| Hydrid (er) | – |
| Klorid (er) | – |
| Atomic radius | – |
| Ionic radius (1+ ion) | 194 pm |
| Ionic radius (2+ ion) | – |
| Ionic radius (3+ ion) | – |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3- ion) | – |
| Varmeledningsevne | 3,61 W m-1 K-1 |
| Elektrisk ledningsevne | – |
| Fryse- / smeltepunkt: | 27 oC, 300 K |

Denne uranmalmprøven inneholder omtrent 100 000 atomer francium-223 (3,3 x 10 -20 g). Francium er radioaktivt; mindre enn 30 g av det eksisterer på jorden til enhver tid. Bilde Ref. (1)
Discovery of Francium
Francium ble oppdaget av Marguerite Perey i 1939 da hun forsket på det radioaktive forfallet av actinium-227.
Oppdagelsen fant sted på Curie Institute i Paris. Elementet har fått navnet sitt fra oppdagelseslandet – Frankrike.
Oppdagelsen begynte i 1935, da Perey i en alder av 26 år, leste et forskningspapir som hevdet at amerikanske forskere hadde oppdaget betapartikler som slippes ut av actinium som hadde en høyere mengde energi enn normalt.
Perey var nysgjerrig på dette funnet, og allerede som ekspert på aktiniumrelatert arbeid bestemte hun seg for å utføre egne eksperimenter på aktinium. Hun produserte en ultrarent aktiniumprøve og studerte strålingen. Perey oppdaget at om lag 1% av actiniums radioaktivitet var forårsaket av at den sendte ut alfapartikler, ikke beta-partikler. sin egen kjerne. Datterkjernen som ble dannet var et tidligere uoppdaget element som hun valgte å kalle francium for å hedre hjemlandet Frankrike.
227Ac → 223Fr + 4He
Med 87 protoner hørte det nye elementet til i Gruppe 1 i det periodiske systemet, som forbinder de andre fem alkalimetallene: litium, natrium, kalium, rubidium og cesium.
Oppdagelsen av francium fullførte menneskehetens oppdagelser av naturlig forekommende grunnstoffer.
Alle grunnstoffene som ble oppdaget siden da har blitt oppdaget når elementet er produsert i laboratoriet.

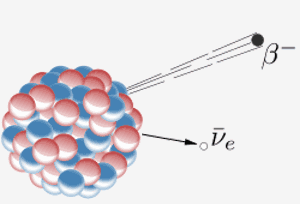
En kjerne avgir en beta-partikkel ( et elektron) og et antineutrino. Resultatet av dette er at et nøytron i kjernen blir til en proton. Når element 87 i det periodiske systemet (francium) gjør dette, betyr det ekstra protonet at det blir element 88 (radium).
Utseende og kjennetegn
Skadelige effekter:
Francium er sterkt radioaktivt.
Kjennetegn:
Francium er et tungt, ustabilt, radioaktivt metall med en maksimal halveringstid på bare 22 minutter. Den har et lavt smeltepunkt (27 oC, 81 oF), og hvis nok av det kunne akkumuleres, ville det være flytende i et varmt rom.
Francium er det nest sjeldneste elementet i jordskorpen, ved siden av astatin. Mindre enn tretti gram francium eksisterer på jorden til enhver tid.
Francium er det minste elektronegative av alle grunnstoffene, derfor bør det være det mest kjemisk reaktive alkalimetallet. Dessverre er den ikke tilgjengelig i tilstrekkelige mengder for å vise at den reagerer med vann – den er laget i små mengder i partikkelakseleratorer. I teorien vil reaksjonen med vann være mer voldsom enn cesium og veldig mye mer voldsom enn natrium.
Francium har nylig blitt studert ved Stony Brook University, New York. Forskere fanget der opptil ti tusen franciumatomer av gangen ved hjelp av laserstråler i et magnetfelt for å måle egenskapene deres.
Bruk av Francium
Kommersielt er det ingen bruksområder for francium på grunn av dets sjeldenhet og ustabilitet. Den brukes bare til forskningsformål.
Francium Decay
Franciums isotoper, med massetall fra 200 til 232, gjennomgår oftest alfa- eller beta-forfall.
Her er bare noen få eksempler på franciums forråtnelsesveier:
Francium-223 er elementets lengst levde isotop. Den har en halveringstid på 22 minutter. Den kan avgi en alfa-partikkel (en heliumkjerne) for å danne astatin-219 eller en beta-partikkel for å danne radium-223. (En beta-partikkel er et elektron som sendes ut fra en kjerne når et nøytron konverterer til et proton.)
Francium-221 har en halveringstid på 5 minutter. Den kan avgi en alfa-partikkel for å danne astatin-217 eller en beta-partikkel for å bli radium-221.
Francium-216 har en halveringstid på 0,7 mikrosekunder. Den kan avgi en alfa-partikkel for å danne astatin-212 eller en positron for å danne radon-216.
Francium-212 har en halveringstid på 19 minutter. Den kan avgi en alfapartikkel for å danne astatin-208 eller fange et orbitalelektron for å danne radon-212. (2) (Under orbitalelektronfangst fanger kjernen en av atommets egne elektroner og avgir en nøytrino.)
Overflod og isotoper
Rikelig jordskorpe: ~ 0 deler per million , ~ 0 deler per million
Overflod solsystem: ~ 0 deler per milliard vekt, ~ 0 deler per milliard etter mol
Kostnad, ren: $ per 100 g
Kostnad, bulk: $ per 100 g
Kilde: Francium forekommer naturlig som et resultat av alfa-radioaktivt forfall av aktinium.
Isotoper: Francium har 33 isotoper hvis halveringstid er kjent, med massetall 200 til 232. Ingen er stabile. 223Fr har den lengste halveringstiden på 21,8 minutter.

- Foto av Konrad Roeder
- EK Hyde, a. Ghiorso, G.T. Seaborg, Physical Review., 1950, 77, p765, utgave 6.
Sitat denne siden
Hvis du vil lenke på nettet, kan du kopiere og lime inn ett av følgende:
<a href="https://www.chemicool.com/elements/francium.html">Francium</a>
eller
<a href="https://www.chemicool.com/elements/francium.html">Francium Element Facts</a>
For å sitere denne siden i et akademisk dokument, bruk følgende MLA-kompatible sitering:
"Francium." Chemicool Periodic Table. Chemicool.com. 11 Jan. 2015. Web. <https://www.chemicool.com/elements/francium.html>.