Frontiers in Cellularand Infection Microbiology
Introduksjon
Staphylococcus aureus er et viktig menneskelig patogen isolert fra sykehusinnlagte pasienter over hele verden, noe som forårsaker både sykehusinfeksjoner og samfunnskjøpte infeksjoner ( Lowy, 1998). Dette patogenet er etiologisk middel for flere forskjellige systemiske infeksjoner, som påvirker hud og bløtvev, samt muskuloskeletale og sirkulasjonssystemer (Lowy, 1998; Changchien et al., 2016). Det ble rapportert at S. aureus kan overleve i humane monocytt-avledede makrofager (Kubica et al., 2008). Virulensen til S. aureus er nært forbundet med en rekke utskilte enzymer og giftstoffer produsert av bakteriene (Otto, 2014). Hemolysin, leukocidin (Panton – Valentine leukocidin, PVL) og toksisk sjokk syndrom toksin-1 (TSST-1), som letter for å skade den røde blodlegememembranen, skader fagocytisk funksjon av leukocytter, og induserer henholdsvis giftig sjokk syndrom, er kritiske for patogene prosesser av S. aureus (Löffler et al., 2010; Vandenesch et al., 2012; Berube og Bubeck Wardenburg, 2013; Andrey et al., 2015; Al Laham et al., 2015). Nyere studier har vist at hemolysin også deltar i dannelsen av S. aureus biofilm (den Reijer et al., 2016). Den økende forekomsten av multiresistente S. aureus-stammer i sykehus- og samfunnsmiljøer øker farene ved S. aureus ytterligere og utgjør en alvorlig utfordring for klinisk terapi (Voss og Doebbeling, 1995; Evangelista Sde og de Oliveira, 2015).
Nylig er det funnet et antall stammer som tilhører en klasse S. aureus med en ufullstendig hemolytisk fenotype (SIHP) på sykehuset vårt. Hemolyse forårsaket av disse SIHP-stammene er signifikant forskjellig fra den komplette hemolytiske ringen (β-hemolytisk fenotype) produsert i andre S. aureus-stammer. Imidlertid har disse SIHP-stammene ennå ikke blitt identifisert og karakterisert omfattende. For å utforske de mikrobiologiske egenskapene til disse SIHP-stammene, samlet vi 60 SIHP-stammer og studerte dem ved hjelp av flere kriterier, inkludert hemolytisk fenotype, ekspresjon av hemolysingenet, legemiddelresistensfunksjoner og virulens. Denne studien demonstrerer at SIHP er meticillinresistente stammer som høyt uttrykker β-hemolysin og har et høyt virulenspotensial.
Materialer og metoder
Bakteriestammer
Sixty SIHP stammer ble isolert fra pasienter innlagt på det andre tilknyttede sykehuset ved Soochow University mellom 2013 og 2015. Dupliserte prøver fra hver pasient ble tatt for analyse. Disse isolatene ble deretter dyrket på Columbia-saueblodagarplater (CHROMagar Company, Shanghai, Kina) ved 35 ° C i en atmosfære inneholdende 5% CO2 (volum / volum). Stammer identitet som S. aureus ble bekreftet ved hjelp av Phoenix-100 automatiserte mikrobiologiske system (Becton, Dickinson og Company, USA). Kontroll S. aureus-stammer, med fullstendig hemolytisk fenotype, ble isolert fra pasienter på sykehuset vårt i løpet av samme tidsperiode. Her ble S. aureus med den komplette hemolytiske fenotypen kalt SCHP-stammer. S. aureus ATCC25923 referansestamme (Shanghai Center for Clinical Laboratory, Kina) har den komplette hemolytiske fenotypen og fungerte også som kontrollstamme. Medisinsk etikkomité for det andre tilknyttede sykehuset ved Soochow University godkjente denne studien, og alle isolatene ble samlet med pasientens samtykke i denne studien.
Sammenlignende analyser av ufullstendig hemolytisk fenotype
S. aureus stammer ble dyrket på kommersielle blodagarplater fra forskjellige selskaper (CHROMagar, Autobio Diagnostics Co., Ltd., Kina og BioMérieux, Kina) samt selvtilberedte saueblodagarplater ved bruk av Columbia blodagarpulver (OXIDE, UK). Bakteriene ble dyrket ved 35 ° C i en atmosfære inneholdende 5% CO2 (volum / volum) i 24 timer og deretter gjennomgått seriepassasje. Det hemolytiske fenomenet ble deretter observert. Klinisk isolerte stammer med fullstendig hemolytisk fenotype og ATCC25923 referansestammen ble også observert som en kontroll for komparative analyser.
Bestemmelse av mRNA-nivåer av fire hemolysingener av S. aureus ved bruk av omvendt transkripsjon sanntids kvantitativ PCR (qPCR)
Total RNA-ekstraksjon fra SIHP og ATCC25923 referansestammen ble foretatt som tidligere beskrevet (Qin et al., 2014). Opprinnelig ble cellene lysert ved bruk av lysostaphin, lysozym og proteinase K. RNA ble deretter ekstrahert og renset ved bruk av RNeasy Mini Kit (Qiagen) i henhold til produsentens anbefalte protokoll. RNA-kvalitet og konsentrasjon ble evaluert ved bruk av NanoDrop1000. RNA ble deretter reversert -transskrevet til cDNA ved hjelp av et omvendt transkripsjonssett (Thermo Fisher Scientific Inc., USA) i henhold til produsentens instruksjoner.Kort qPCR ble utført som følger: pre-denaturering ved 94 ° C i 3 minutter, denaturering ved 94 ° C i 30 s, gløding ved 52 ° C i 30 s, forlengelse ved 72 ° C i 40 s, totalt 45 sykluser . Hver prøve hadde tre tekniske og tre biologiske gjentakelser. Transkripsjonsprofilen til hvert av de fire hemolysingenene og 16-tallet rRNA-genet ble bestemt ved hjelp av 2-ΔΔCt-metoden. Transkripsjonsnivået ble bestemt i forhold til ekspresjonen av 16s rRNA-genet. Sekvensene av fire hemolysingener (hla, hlb, hlgC og hld) ble hentet fra GenBank-databasen. Primer 5.0-programvare ble brukt til å designe primerne (tabell 1), og disse primerne ble syntetisert av Sangon Biotech Co., Ltd. (Shanghai, Kina).
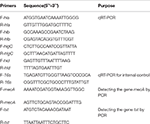
Tabell 1. Primere brukt i denne studien.
SPSS 17.0 ble brukt til dataanalyse. Måledata presenteres som x̄ ± s. T-test for to uavhengige prøver ble brukt til å sammenligne det relative uttrykket for hvert av de fire hemolysingenene. Statistisk signifikans ble definert som p < 0,05.
Påvisning av α-Hemolysin (Hla) -ekspresjon med Western Blot
Konsentrasjonen av SIHP og referansestammen S. aureus ATCC25923 ble justert til 5,0 McFarland ved bruk av en turbiditetsmåler. Totalt protein ble deretter ekstrahert fra hver prøve, justert til samme konsentrasjon og gjennomgått elektroforese på en SDS-PAGE-gel. Proteinene ble deretter overført til en nitrocellulosemembran og membranen ble blokkert med 5% skummet melk i 1 time. Geit anti-stafylokokk α-hemolysin polyklonale antistoffer (Abcam) ble tilsatt i en sluttkonsentrasjon på 2 μg / ml. Reaksjonsblandingen ble deretter inkubert ved 4 ° C over natten. Etter at membranen var vasket, ble 1: 1000 fortynnede HRP-merkede kanin-anti-geit-IgG-antistoffer tilsatt og inkubert ved 37 ° C i 2 timer. Til slutt ble kjemiluminescerende underlag tilsatt for fargeutvikling. Uttrykket av α-hemolysin ble til slutt observert under kameraet.
Antimikrobiell følsomhetstest av SIHP
Fortynningsmetoden for mikrotiterbuljong ble brukt til å utføre screening for antimikrobiell følsomhet. Prosedyren ble utført i henhold til bruksanvisningen til det automatiserte mikrobiologiske systemet Phoenix-100. Resultatene fra denne screening ble tolket ved hjelp av M100-S24 kriteriene introdusert av Clinical and Laboratory Standards Institute (CLSI; Clinical and Laboratory Standards Institute, 2014). Meticillinresistent S. aureus (MRSA) status ble bestemt ved bruk av MIC (minimum hemmende konsentrasjon) av to antibiotika. For SIHP-stammene ≥4 μg / ml var MIC for oxallicin, og ≥8 μg / mL var MIC for cefoxitin.
Påvisning av mecA- og tst-gener
Alle 60 SIHP stammer ble testet for legemiddelresistensgenet mecA og virulensgenet tst. Kokeekstraksjon av genomisk DNA ble utført etter cellulær lysis ved bruk av lysostaphin. MecA- og tst-genene ble deretter amplifisert fra det genomiske DNAet ved hjelp av DreamGreen Taq-settet. PCR-forhold var som følger: pre-denaturering ved 94 ° C i 3 minutter, denaturering ved 94 ° C i 30 s, gløding ved 50 ° C i 30 s, utvidelse ved 72 ° C i 1 min. PCR-produkter ble sekvensert og analysert av BLAST for å validere for å være de forventede produktene. Sekvensene av medikamentresistensgen mecA og virulensgen tst av S. aureus ble hentet fra GenBank-databasen. Primer 5.0-programvare ble brukt til å designe primerne (tabell 1), og disse primerne ble syntetisert av Sangon Biotech Co., Ltd. (Shanghai, Kina).
Påvisning av Survival of S. aureus SIHP Stammer i Makrofager
For å sammenligne overlevelsen av S. aureus SIHP-stammer i makrofager med den for tst-negative S. aureus SCHP-stammer, ble den humane monocyttcellelinjen THP-1 opprettholdt i RPMI-1640 inneholdende 10% (v / v) FBS ved 37 ° C i en atmosfære som inneholder 5% (v / v) CO2. For makrofaginfeksjon ble THP-1-celler sådd ved 5 × 105 celler per brønn i 24-brønns vevskulturskåler og indusert til å differensiere med 10-7 M phorbol 12-myristat 13-acetat (PMA) i 48 timer. Omtrent 3 × 108 kolonidannende enheter (CFU) av logaritmisk fase (OD600 0,5-0,6) bakterier ble pelletert ved sentrifugering, vasket to ganger med PBS og resuspendert i 1 ml RPMI-1640. Deretter ble bakterier tilsatt til cellemonolaget ved en MOI på 20: 1 og sentrifugert i 5 minutter ved 1000 rpm. Infiserte celler ble inkubert i 20 minutter ved 37 ° C, ble deretter vasket tre ganger med forvarmet PBS (pH 7,4) og inkubert i ytterligere 1 time i medium inneholdende 100 μg / ml gentamicin for å drepe ekstracellulære bakterier. Celler ble vasket og lysert for å kvantifisere den intracellulære bakterien som tid null-prøven (T0). Ytterligere celler ble samlet etter 12 eller 24 timers inkubasjon i nærvær av ferskt suppleret vevskulturmedium inneholdende 12 ug / ml gentamicin.Veksten av bakterier i THP-1-celler ble bestemt ved å dele antall intracellulære bakterier ved 12 timer eller 24 timer med tallet på tiden 0 (T12 / T0 eller T24 / T0). Eksperimentet ble gjentatt uavhengig tre ganger.
Påvisning av cytokinsekresjon av makrofager infisert av S. aureus SIHP-stammer
Kultursupernatantene av THP-1 makrofager infisert i 12 timer av bakterier var samlet. Cytokinnivåene ble målt ved FACSCalibur flowcytometri (BD) ved bruk av et CBA Human Thl / Th2 Cytokine Kit II (BD) i henhold til produsentens instruksjon.
Multilocus Sequence Typing and Analysis
Resultater
Hemolytisk fenotype av SIHP-stammer på saueagarblodplater
Som vist i figur 1A, B ble den komplette hemolytiske ringen (β-hemolytisk fenotype) observert i kontroll S aureus-stammer etter dyrking av stammer på blodagarplater i 24 timer. Imidlertid ble forskjellige hemolytiske fenotyper (kalt ufullstendig hemolytisk fenotype her) vist i SIHP-stammer. Videre kunne den ufullstendige hemolytiske fenotypen observeres i SIHP-stammene som vokste i forskjellige miljø forhold inkludert henholdsvis mikroaerofile, aerobe og anaerobe forhold (figur 1C – E). I tillegg ble denne ufullstendige hemolytiske fenotypen fortsatt opprettholdt etter 10 serielle passasjer (figur 1F).
Relativ mRNA-ekspresjonsnivåer av fire hemolysingener
Som vist i figur 2, viste ekspressjonsnivåene til de fire hemolysingenene hla, hlb, hlgC og hld i SCHP-stammer ingen statistisk signifikante forskjeller (p > 0,05) sammenlignet med kontrollstammer ATCC25923. Imidlertid ble ekspressjonsnivåene av hla, hlgC og hld i SIHP-stammer signifikant undertrykt av henholdsvis 50-, 16,7- og 8,3 ganger (p < 0,05) sammenlignet med kontrollstammer ATCC25923 og SCHP-stammer, mens ekspresjonen av hlb i SIHP-stammer var signifikant økt 7,7 ganger i forhold til kontrollene (p < 0,05).
Påvisning av α-hemolysin av Western Blot
α-hemolysin kodet av gen hla er et poredannende toksin utskilt av S. aureus og dets molekylvekt er 33 kDa (Andrey et al., 2015; Al Laham et al., 2015). Western blot-analyse viste at ekspresjonen av α-hemolysin i SIHP-stammer var 40 ganger lavere enn for SCHP- og kontrollstammene, noe som samsvarer med qRT-PCR-dataene (figur 3).

Figur 3. Western blot av α -hemolysin i S. aureus. ATCC29213: kontroll S. aureus med den komplette hemolytiske fenotypen; SCHP: S. aureus med den komplette hemolytiske fenotypen isolert fra kliniske prøver i samme periode; SIHP: S. aureus med en ufullstendig hemolytisk fenotype.
Medikamentresistens av SIHP
Testet medikamentfølsomhet ved bruk av mikrotiterbuljongfortynninger viste at MIC-verdiene for oksacillin og cefoksitin alle var > 2 og > henholdsvis 8 μg / ml i 60 SIHP-flekker . I henhold til CLSI M100-S24-retningslinjene er alle 60 SIHP-stammer klassifisert som MRSA-stammer. PCR oppdaget også mecA-genet i alle 60 stammer.
Testing for tst-genet
Tst-genet er en viktig virulensfaktor i S. aureus. PCR viste at alle 50 av SIHP-stammene bar tst-gener.
Overlevelsesevnen til S. aureus SIHP-stammer i makrofager er større enn den for tst Negative S. aureus
Vi sammenlignet de intracellulære overlevelsesevnene til SIHP-stammer og den første SCHP-stammen i makrofager. Ved å telle antall bakterier som ble utvunnet fra platene, fant vi at intracellulær overlevelsesevne for SIHP-stamme var mye høyere enn for tst-negativ S. aureus-stamme etter infiserte THP-1-avledede makrofager 12 eller 24 timer (figur 4). Innledningsvis spekulerte vi i at SIHP-stammer har en potensiell høy virulens, og det ble foreslått at SIHP skulle tas mer hensyn på sykehus.
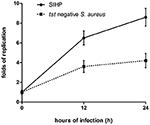
Figur 4. Overlevelse av SIHP-stammer og tst negativ S. aureus i THP-1-avledede makrofager. Etter at makrofagene ble infisert av bakterier i 12 og 24 timer, ble makrofager lysert og de intracellulære overlevende bakteriene ble belagt på LB-agar. Replikasjonsfoldene av intracellulære overlevende bakterier ble beregnet i henhold til antall kolonier på ovennevnte LB-agarplate.
The Secretion Differences av cytokiner og kjemokiner fra makrofager infisert av S. aureus SIHP-stammer og tst negativ S. aureusaureus-stamme, oppdaget vi proinflammatoriske cytokiner ved flowcytometri i kultursupernatanten av makrofager infisert av SIHP-stammer og tst negativ S. aureus-stamme. Resultatene viste signifikant høyere induksjon av IL-2, IL-6 og IL-17A i SIHP-stammer, men ikke av tst-negative S. aureus, noe som tyder på at SIHP-stammer induserer cytokin / kjemokinrespons i makrofager (figur 5). De andre cytokinene IL-4, IL-10, INF-y og TNF utskilt av makrofager var ingen åpenbare forskjeller mellom SIHP-stammer og tst-negative S. aureus-berørte grupper.
FIGUR 5
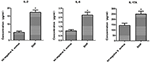
Figur 5. Påvisning av cytokiner og kjemokiner utskilt av makrofager infisert med S. aureus. * P < 0,05.
Multilocus Sequence Typing
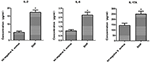
Figur 5. Påvisning av cytokiner og kjemokiner utskilt av makrofager infisert med S. aureus. * P < 0,05.
Vi bestemte multilokusgenotypen til 60 SIHP-isolater samlet fra pasienter innlagt på sykehuset vårt mellom 2013 og 2014. Syv-locus-ordningen som ble anbefalt i S. aureus MLST-databasen ble anvendt. MLST-analyse viste at alle SIHP-stammer ble klassifisert i ST5-klon.
Diskusjon
Hemolysin er en av de viktigste virulensfaktorene for S. aureus (Wiseman, 1975). De kombinerte effektene av hver av de fire typer hemolysin resulterer i ødeleggelse av den røde blodlegememembranen som fører til dannelsen av den fullstendige gjennomsiktige hemolytiske ringen på blodagarplater. De siste årene ble SIHP funnet i de kliniske prøvene fra det andre tilknyttede sykehuset ved Soochow University. I denne studien forsøkte vi å identifisere disse stammene og studere deres egenskaper i mikrobiologi. Opprinnelig brukte vi forskjellige kommersielle eller selvtilberedte saueblod-agarplater for å isolere, ruge og passere stammene serielt. Vi viste at det er noen stammer som viser og opprettholder en ufullstendig hemolytisk fenotype selv etter langvarig underkultur. Dermed kan muligheten for at denne fenotypen er indusert av ikke-bakterielle faktorer ekskluderes. Våre studier antyder at SIHP kan være en delmengde av unike S. aureus-stammer.
Tidligere studier antydet at røde blodlegemer fra kaniner er svært følsomme for α-hemolysin (Hildebrand et al., 1991). Berube et al. rapporterte at effekten av α-hemolysin på lysering av røde blodlegemer er konsentrasjonsavhengig (Berube og Bubeck Wardenburg, 2013). γ-hemolysin kan skade de røde blodcellene hos mennesker og dyr (Kaneko og Kamio, 2004). Mens δ-hemolysin skader røde blodlegemer, bare ved høye konsentrasjoner, danner det en trans-membranpore som lyserer cellemembranen (Verdon et al., 2009). I denne studien viste vi at uttrykket av fire hemolysiner av SIHP-stammer og SCHP-stammer har signifikant forskjellige transkripsjonsekspressjonsprofiler. Uttrykket av α-, γ-, δ-hemolysin i SIHP-stammene, som kan skade de røde blodcellene direkte, er mye lavere enn for SCHP-stammene, mens β-hemolysin har langt høyere ekspresjonsnivåer sammenlignet med SCHP-stammene. I tillegg ble proteinekspresjonsnivået til α-hemolysin ytterligere validert av Western blot. Det ble rapportert at β-hemolysin hovedsakelig øker følsomheten til røde blodlegemer for andre giftstoffer i stedet for å lysere cellene direkte, med mindre cellene dyrkes i lavere temperaturer (Vandenesch et al., 2012). I denne studien ble det høye ekspresjonen av β-hemolysin påvist i SIHP-stammer, men den komplette hemolytiske ringen ble aldri observert i SIHP-stammene selv når de ble inkubert ved 4 ° C. Disse resultatene antyder at den observerte ufullstendige fenotypen av SIHP-stammer mest sannsynlig er effekten av alle fire hemolysiner som uttrykkes på en annen måte sammenlignet med SCHP-stammene. Tidligere studier har vist at den kombinerte effekten av selektivt trykk som følge av antibiotika inkludert ciprofloxacin og trimetoprim, så vel som vertsimmunresponsen, under kronisk patogenese kan føre til økt ekspresjon av α-hemolysin, noe som er veldig viktig for koloniseringen av S aureus i slimhinne, spesielt i luftveisinfeksjoner (Goerke et al., 2006; Huseby et al., 2010). I denne studien fikk alle pasientene smittet med SIHP langvarig behandling av bredspektret antibiotika, enten dette selektive trykket induserte overekspresjon av medikamentresistente gener og forstyrret ekspresjonen av hemolysingenene er fortsatt en mulighet som trenger videre undersøkelse.
For å utforske de mikrobiologiske egenskapene til SIHP, gjennomførte vi antimikrobielle følsomhetstester og valgte virulensgenet tst som er assosiert med S. aureus patogenisitet. Vi fant at alle 60 SIHP-stammene kunne klassifiseres som MRSA-stammer og bar mecA-genet. Resultatene av antimikrobiell følsomhetstest viste at selv etter 10 passasjer, av disse 60 SIHP-stammene, har MIC-verdiene til linezolid og teicoplanin av bare tre SIHP-stammer ikke endret seg lite.Disse endringene av MIC-verdier påvirket imidlertid ikke vurderingen av resultatene av antimikrobiell følsomhet. Virulensgenet tst koder for toksisk sjokk syndrom toksin (TSST-1) (Kreiswirth, 1989). Som et superantigen forbedrer TSST-1 sjokk og immunsuppresjonsresponser indusert av endotoksiner (Kulhankova et al., 2014). PCR-testing fant at alle 60 SIHP-stammene hadde tst-genet som antydet økt virulens. Nylig viste mange rapporter at S. aureus kunne overleve i humane monocytt-avledede makrofager, og disse S. aureus-stammene er mer virulente (Kubica et al., 2008; Tranchemontagne et al., 2015; Münzenmayer et al., 2016; Nandi og Bishayi, 2016). Derfor sammenlignet vi de intracellulære overlevelsesevnene til SIHP-stammer og SCHP-stammer som er den første negative S. aureus i makrofager, og fant at den intracellulære overlevelsesevnen til SIHP-stammen var mye høyere enn den for den tst-negative S. aureus-stammen. I tillegg viste pasientdataanalyse at effekten av antiinfeksjonsbehandling hos de fleste av pasientene smittet med SIHP-stammer var dårligere enn hos de tilsvarende pasientene som var smittet med SCHP-stammer (data ikke vist). Studien vår gir foreløpig eksperimentell bevis for spekulasjonen om at SIHP-stammer har en potensiell høy virulens.
Under infeksjonsprosessen av invasiv S. aureus, starter patogenassosierte molekyler det medfødte immunforsvaret som fører til aktivering og rekruttering av nøytrofiler og makrofager og produksjon av proinflammatoriske cytokiner, spesielt TNF-α, IL-1β og IL-6 (Bekeredjian-Ding et al., 2015; Giai et al., 2016; Zhao et al., 2016 ). Det ble rapportert at utskillelsen av inflammatoriske cytokiner IL-6 økte med økende konsentrasjoner av S. aureus (Chen et al., 2016). I tillegg er superantigene S. aureus spesielt effektive i å stimulere IL-17 produksjon (Islander et al., 2010). I denne studien viste SIHP-stammer signifikant høyere induksjon av IL-2, IL-6 og IL-17A av makrofager sammenlignet med tst-negative SCHP-stammer, noe som antyder at SIHP-stammer kunne indusere mer sekresjon av cytokiner mot drapende effekt av makrofager. I tillegg viste MLST-analyse at alle SIHP-stammer ble klassifisert i ST5-klon. Videre ble disse SIHP-stammene gruppert i spa-typen t2460 (data ikke vist).
Til sammen kan SIHP være en ny delmengde av MRSA med potensiell høy virulens, og mer oppmerksomhet bør betales i kontroll og behandling av disse stammene på sykehus.
Forfatterens bidrag
Erklæring om interessekonflikter
Forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
Anerkjennelser
Denne studien ble støttet av National Natural Science Foundation of China (81572032, 81401636), Natural Science Foundation for Colleges and Universities in Jiangsu Province (16KJB320006), og Science and Technology Program of Suzhou (SYSD2014094, SYS201551, SS201638).
Clinical and Laboratory Standardinstituttet (2014). M100-S24 ytelsesstandarder for antimikrobiell følsomhetstesting; Tjuefjerde informasjons supplement. Wayne, PA: CLSI.
Nandi, A. og Bishayi, B. (2016). Intracellulært overlevd Staphylococcus aureus etter fagocytose er mer virulent når det gjelder å fremkalle cytotoksisitet i fersk murin peritoneal makrofager ved å bruke TLR-2 som et mulig mål. Mikrob. Pathog. 97, 131–147. doi: 10.1016 / j.micpath.2016.06.007
PubMed Abstract | CrossRef Fulltekst | Google Scholar
Wiseman, G. M. (1975). Hemolysiner av Staphylococcus aureus. Bakteriol. Rev. 39, 317–344.
PubMed Abstract | Google Scholar