Frontiers in Immunology (Norsk)
Innledning
Preeklampsi er en graviditetsspesifikk sykdom som rammer 3–5% av alle graviditeter (1, 2). Det manifesterer seg med nylig oppstått hypertensjon etter 20 ukers svangerskap og proteinuri. Morkaken er sentral i sykdoms patogenesen ved å koble moren til fosteret (3). Mødre-fostergrensesnittet er sonen der genetisk forskjellig vev av fosterets opprinnelse møter mors sirkulasjon, endotel og immunsystem. Ofte kalt teoriens sykdom, er en allment akseptert innsikt at svangerskapsforgiftning påvirker moderens endotel som forårsaker forstyrrelser i funksjonen av endotel, noe som fører til hypertensjon og proteinuri (2). I sin alvorlige form kan svangerskapsforgiftning føre til fosterveksthemming, for tidlig fødsel, og for moren kan det forårsake organsvikt i nyrer og lever samt eklampsi. Videre kan svangerskapsforgiftning ha langsiktige kardiovaskulære konsekvenser for mor og nyfødte (4). Utviklingen av morkaken anses å være utilstrekkelig spesifikt i prosessen med transformasjon av mors spiralarterie, der trofoblastcellene invaderer morssiden til decidua og transformerer arteriene til rør med lav motstand, og erstatter også maternal endotel (5-7). Vanligvis er denne ombyggingen av livmorarteriene fraværende eller ufullstendig, spesielt i alvorlig form for svangerskapsforgiftning. Høy motstand i de trange uterine arteriene forårsaker turbulent blodstrøm inn i morkakens mellomrom og forårsaker oksidativt stress og mekanisk skade på moderkreftens trær. Resulterende skade øker morkaken fra placenta av mikropartikler og inflammatoriske mediatorer som resulterer i generalisert endotelaktivering og dysfunksjon (8, 9). Disse sekvensielle hendelsene i moder-fostergrensesnittet fører til mors hypertensjon og andre symptomer som beskrevet ovenfor.
HELLP syndrom ble først karakterisert i 1982 av Weinstein som et eget syndrom, ofte representerende sammen med preeklampsi, men også sett alene (10, 11). HELLP syndrom er preget av hemolyse, forhøyede leverenzymer og lave blodplater. Det krever ofte observasjon av intensivnivå og symptomatisk behandling. Syndromets patogenese er fremdeles i skyggen. HELLP syndrom deler vanlige trekk med trombotiske mikroangiopatier (TMA) som trombotisk trombocytopenisk purpura (TTP) og hemolytisk uremisk syndrom (HUS). TMAs til stede i en rekke sykdomsgrupper med vanlige trekk ved mikroangiopatisk hemolyse, trombocytopeni og organskader som følge av mikrotrombi. I TTP, en genetisk mangel på, eller som i de aller fleste tilfeller, ervervet autoantistoffer mot et desintegrin og metalloproteinase med trombospondin type 1-motiv 13 (ADAMTS13), enzymet som spalter aktivert von Willebrand-faktor (vWF), forårsaker dannelse av uvanlig stor aktiverte vWF multimerer på endotelceller som fører til blodplatetromber i små kar og hemolyse. Typisk HUS er forårsaket av Shiga-toksin-produserende bakteriell infeksjon (spesielt Escherichia coli) mens atypisk HUS (aHUS) refererer til typen TMA, der genetiske mangler i regulatorene til den alternative veien for komplement-systemet ligger til grunn, som i nærvær av en utløser kan forårsake den kliniske sykdommen (12, 13). FDA-godkjent behandling for aHUS er infusjonen av komplement C5-antagonist eculizumab, som forhindrer dannelsen av membranangrepskomplekset (MAC) (figur 1). Klinisk deler HELLP de samme symptomene som klassiske TMA: hemolyse, trombocytopeni og organsykdom sett i leveren. Avhengig av TMA-klassifiseringen, blir HELLP-syndrom vanligvis kategorisert som en del av sekundære eller ervervede TMAer (tabell 1).
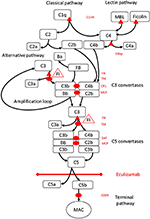
Figur 1. Eculizumab hemmer terminal vei for komplementaktivering. Komplementaktivering kan initieres via tre aktiveringsveier, som alle fører til dannelse av C5-konvertaser som har kapasitet til å aktivere terminalveien som fører til dannelse av MAC på måloverflaten. Denne skjematiske illustrasjonen av komplementsystemet viser de mest relevante aktivatorene (i svart skrift) og hemmere (i rødt). Aktivatorene kan være membranbundet (oval) eller løselig (trekant). Den alternative veien aktiveres spontant på alle overflater som ikke tillater hemming av den løselige regulatorfaktoren H (FH). FH fungerer som kofaktor for inaktivering av C3b til iC3b av faktor I (FI). Trombomodulin (TM) forbedrer FH-kofaktoraktivitet. Spaltet faktor B (FB) sammen med aktivatoren C3b danner den alternative veien konvertase, som har kapasitet til å spalte C3 i C3b og skaper en forsterkningssløyfe for alternativ veiaktivering.Klassisk bane for komplementaktivering kan initieres ved for eksempel binding av immunkomplekser til C1q, mens lektinveien aktiveres ved mannose-bindende lektin (MBL) eller fikoliner som bindes til for eksempel mønstre av karbohydrater på mikrober. Aktivering av lektinveien resulterer i mannose-assosiert serinproteaser 1 og 2 (MASP-1 og MASP-2, ikke avbildet) spalting av komplementkomponenter C4 og C2 for å danne den klassiske banen convertase C4bC2b. C1-hemmer (C1inh) og C4bp er de løselige regulatorene av den klassiske veien, mens membrankofaktorprotein (MCP) og komplementreseptor 1 (CR1) er membranbundne regulatorer av tidlige komplementveier. Dannelsen av C5-konvertaser initierer terminalveien for komplementaktivering og spaltning av C5 i fravær av overflatebundne regulatorer forfall av akselerasjonsfaktor (DAF) og MCP. Montering av MAC reguleres av overflatebundet regulator CD59 (protectin). Spaltning av C3 i de tidlige banene og C5 i terminalveien frigjør anafylatoksiner C3a og C5a og resulterer i betennelse. Eculizumab er et humanisert rekombinant antistoff mot komplementproteinet C5, som hemmer spalting av C5 av C5-konvertasene, og regulerer dermed den protrombotiske og proinflammatoriske effekten av komplementaktivering. Pasienten beskrevet i denne caserapporten ble testet for genetiske mutasjoner i gener som koder for faktor H (CFH), FHR5 og MCP, CFI, CFB, THBD og ADAMTS13 (ADAMTS13), en regulator av vWF-banen til koagulasjonskaskade (ikke vist). Resultatene av gentestingen var negative.

Tabell 1. HELLP og aHUS diagnostiske kriterier.
I denne casestudien rapporterer vi en pasient med en komplisert graviditetsindusert TMA og vellykket behandlingsforløp.
Sakspresentasjon
Tjueni år gammel primigravida ble henvist i svangerskapsalderen 34 + 2 til Helsingfors universitetssykehus poliklinikk med øvre magesmerter. Opprinnelig var blodtrykket hennes forhøyet (133/91 mmHg), og peilepinnen i urinen var positiv for protein. Den opprinnelig rapporterte smerter i øvre mage ble gradvis bedre. I ultralydskanningen hadde fosteret normal biofysisk profil (BPP), vektestimatet var ved −2 SD vekstkurve. Kardiotokografi (CTG) var normal. Blodhemoglobin (Hb) var 115 g / L, blodplater 158 E9 / L (normalt område 150–360 E9 / L), alaninaminotransferase (ALT) var normalt (23 U / L). Pipestokken i urinen var positiv for protein (+2) og beregnet proteinuria var 1,6 g / 24 timer. Det ble besluttet å sette i gang kortisonbehandling for å lette lungemodningen til babyen. Pasienten ble utskrevet med en plan om å komme tilbake neste dag for kontrollsjekk og andre dose kortison. Som planlagt kom hun for kontroll i svangerskapsuke 34 + 4. Blodtrykket var 147/87 mmHg, ALT 23, blodplater 177, CTG og fostrets BPP i ultralydskanningen var normal. Hun ble utskrevet, og en ny kontroll var planlagt. Om ettermiddagen samme dag kom smerter i øvre mage tilbake og forverret seg stadig mot kvelden. Hun kom tilbake til sykehuset klokka 02.20 Hun opplevde stramme smerter i øvre mage, rastløshet, og hun hadde kastet opp to ganger og følte skjelving. Blodtrykket var tydelig forhøyet ved 170/94 mmHg, urinprotein-peilepinnen var sterkt positiv, ALT ble forhøyet ved 159, Hb 122 og blodplater 172. Hun ble innlagt på prenatalavdelingen. Klokken 4 fikk hun hodepine. Antihypertensiv medisinering ble startet (Labetalol 100 mg tre ganger). Urinproteinutskillelsen toppet seg om natten på 13 g / 24 timer. Deretter begynte hun å kaste opp, hadde smerter i øvre mage, hodepine, og CTG-overvåking viste retardasjoner. Pasienten ble overført klokken 7.11 til fødeavdelingen, og da livmorhalsen var utvidet med tre centimeter, ble fostermembranene knust kunstig for induksjon av fødsel. Samtidig ble laboratorietestene fullført med Hb 122, blodplater 172. Laktatdehydrogenase (LD) var imidlertid tydelig forhøyet ved 1231 U / L på dette tidspunktet. I CTG fortsatte retardasjonene, og da bradykardi fortsatte, ble det utført et akutt keisersnitt. Mannlig spedbarn (1960 g, -2 SD) ble født klokka 7.25 med en pH-verdi på navlearterien på 7,05, BE −6,80, Apgar 1/6/8. Blodtap i operasjonen var 400 ml.
Klokka 9 etter keisersnittet var mors blodplater lave ved 49, med Hb på 102. På ettermiddagen hadde ALT steget til 1800, LD 3570 , var serumkreatininnivået 153 (μmol / L), mens blodplatene reduserte til 33. Det var forstyrrelse i koagulasjonen indikert av lavt nivå av fibrinogen (1,1 g / L, referanseverdier 2–4 g / L) og høyt nivå av D -dimer av fibrin (30,2 mg / L, < 0,5 mg / L). Det var noe blødning fra såret keisersnitt, der ytterligere suturer ble plassert.På dette tidspunktet ble åtte enheter blodplater administrert. Kaliumnivået steg fra 4,7 til 5,6 (mmol / L). Hemolyse ble tydelig observert. Coombs-testen var negativ. Urinutskillelsen var bare 10 ml / t. Laboratorietesten viste tydeligvis en alvorlig sykdom med tegn på skade på både nyrene og leveren. I tillegg var det forstyrrelser i koagulasjonssystemet som presenterte signifikant koagulering og markert fibrinolyse samtidig. Magnesiumsulfatinfusjon ble startet på grunn av hyperrefleksi, som regnes som et prediktivt tegn på kramper, en alvorlig komplikasjon av preeklampsi. Intravenøs deksametason 10 mg ble startet, og pasienten ble overført til intensivavdeling (ICU).
Videre ble laboratorietester utstedt for differensialdiagnostiske formål for andre medisinske kriser (tabell 2). Aktiviteten til ADAMTS13 var normal 62% (40-130%), som ekskluderer TTP. Serumkomplement C3 (0,52 g / L, 0,71-1,41 g / L) og C4 (0,07 g / L, 0,12-0,34 g / L) var lave. Nivået av løselig terminal kompleks av komplementet (C5b-9, 971 ng / ml, < 366 ng / ml) ble forhøyet den første dagen etter fødselen. Antifosfolipidantistoffer ble ikke påvist, infeksjonen serologi angående hepatitt B og C, og HIV var negativ. Fra avføringsprøven testet patogenene som forårsaket typisk HUS negativt.

Tabell 2. Tidslinje for sykdomsdiagnostikk og behandling.
Pasienten ble behandlet med plasmautvekslingsbehandling første og andre fødselsdag og ble hemodialysert totalt tre ganger i løpet av behandlingen (dag 2, 4 og 6 postpartum).
På den tredje dagen etter fødselen var pasienten stabil og overført til kvinners sykehusgjenoppretting. og symptomatisk behandling ble fortsatt. Hypertensjon ble behandlet med Amlodipin 10 mg to ganger daglig og Labetalol 200 mg tre ganger daglig. Den fjerde dagen etter fødselen fortsatte blodplatene å synke, og pasienten ble diagnostisert med aHUS. Ofte differensialdiagnosen med HELLP syndrom aHUS ligger i spontan restitusjon av HELLP-pasienter vanligvis på tredje fødselsdag. Behandling med eculizumab ble startet (900 mg IV). ent mottok en pneumokokk-vaksinasjon og profylaktisk antibiotika (penicillin) ble startet. Pasienten fikk tilsammen fire ukedoser av eculizumab (900 mg), og hun begynte å komme seg raskt. Hun krevde ikke ytterligere hemodialyse etter sin tredje hemodialyse den sjette dagen etter fødselen (figur 2). Nyrefunksjon korrigert gradvis, antall blodplater forhøyet og hemolyse løst. Fire uker etter fødselen ble plasmanivåene av C3 og C4 normalisert.
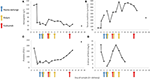
Figur 2. Utvalgte laboratorieverdier observert i de tidlige stadiene av sykdommen og tidspunktet for plasmautveksling, hemodialyse og administrering av eculizumab. I panel (A) er representert utviklingen av blodhemoglobinmålinger, i panel (B) serumkreatininnivået, i panel (C) antall blodplater, og i panel (D) D-dimer av fibrinverdier over 17 dager oppfølgingsperiode.
I genetisk testing ble ingen kjente genpolymorfier identifisert. Hun ble testet for mutasjoner i komplementregulatorer Factor H (CFH), Factor H-relatert protein 5 (FHR5) og membran co-factor protein (MCP), komplement alternativ pathway inactivator factor I (CFI), alternativ pathway activator factor B (CFB ), og følgende komponenter i koagulasjonskaskaden: ADAMTS13, trombomodulin (THBD) og et intracellulært enzym, diacylglycerolkinase E (DGKE), hvis mutasjoner er en kjent årsak til aHUS (14). Videre ble heller ikke antistoffer mot faktor H påvist. Ingen C4-mangel ble oppdaget.
Som et sammendrag hadde pasienten vår alvorlig svangerskapsforgiftning og oppfylte diagnostiske kriterier for HELLP-syndrom. Selv om genetisk testing for aHUS forble negativ, antydet det kliniske forløpet av sykdommen (spesielt alvorlig akutt nyreskade) og respons på behandlingen (spesielt eculizumab) at pasienten vår hadde graviditetsindusert aHUS.
Diskusjon
Primigravida beskrevet ovenfor ble diagnostisert med alvorlig svangerskapsforgiftning, HELLP syndrom og graviditetsindusert aHUS. Ingen kjente genmutasjoner, som kunne predisponere for aHUS, ble oppdaget. Differensialdiagnose mellom typer TMA, TTP, HUS / aHUS og sekundære TMA som HELLP syndrom er viktig. Spesielt TTP må identifiseres tidlig, ettersom sykdommen behandles med rask daglig plasmaveksling til remisjon (15).
For tiden er laboratorieanalysemetoder for testing av genetiske mutasjoner som potensielt forårsaker aHUS, i stand til å vise mutasjoner i bare opptil 40–60% av aHUS-tilfeller, noe som gir mulighet for falske negative tilfeller. Derfor utelukker ikke et negativt testresultat for mutasjoner en sann aHUS (16).Sjelden aHUS har blitt indusert etter graviditet og fødsel. I disse tilfellene utviklet ~ 50% i løpet av de følgende tre årene kronisk nyresykdom (CKD), noen til og med end-stage nyresykdom (ESKD). Når genetiske mutasjoner ble observert, kan opptil 85% utvikle CKD eller ESKD (17).
Det er generelt akseptert at ved hypertensive lidelser under graviditet, resulterer betennelse i placenta i endotel dysfunksjon. Hvis endotelets integritet forstyrres resulterer det i aktivering av komplement og koagulasjon (18). Forstyrret mors endotel er også blitt antatt å bidra til morens morbiditet senere i livet assosiert med alvorlig svangerskapsforgiftning og andre hypertensive graviditetsforstyrrelser (2, 19). Det er vist at skadet endotel fungerer unormalt selv år etter at de første diagnostiske symptomene avtar (20-23).
Hos opptil 46% av HELLP-pasientene er genmutasjoner beskrevet i regulatorene av den alternative veien. av komplementsystemet (24, 25). I de tidlige stadiene av svangerskapet, når morkaken utvikler seg, ses aktivering av komplementsystemet i forhøyede nivåer av Bb i serum hos pasienter som senere utviklet svangerskapsforgiftning (26). Aktivering av komplementsystemet er observert ved alvorlig svangerskapsforgiftning og HELLP-syndrom, og forhøyede nivåer av terminal kompleks (C5b-9) er blitt påvist i urinen hos pasienter med alvorlig svangerskapsforgiftning. Hos pasienter med HELLP-syndrom ble økt aktivering av komplementsystem vist ved funksjonstest og dessuten ved mangel på uttrykk i CD55 og CD59, noe som førte til redusert regulering og forverret aktivering av komplementsystemet (27–29).
Det er mange likheter som deles mellom HELLP syndrom og aHUS. Under begge forhold er endotelforstyrrelser tydelig involvert etterfulgt av komplement og koagulasjonsaktivering. Ved alvorlig svangerskapsforgiftning og HELLP-syndrom, ville eculizumab gitt ved de tidlige tegn på alvorlig sykdom og TMA være gunstig for beskyttelsen av nyrene og mors endotel (30). Bevaring av endotelintegritet kan potensielt beskytte pasienten mot langsiktige helserisiko som hjerte- og karsykdommer. Vanligvis, i svangerskapsrelaterte TMA, forsvinner kliniske funn av hemolyse og trombocytopeni på ~ 3 dager. Hvis sykdomsaktivitet varer lenger, skal differensialdiagnostikk fortsettes, og først da vurderes alternativ behandling (f.eks. Eculizumab). Å introdusere eculizumab-behandling tidligere vil være til nytte for kvinner ved å forhindre nyreskade og minimere turbulensen i endotel og systemisk betennelse. Eculizumab, gitt tidlig nok og så få som en eller to doser, kan muligens være tilstrekkelig til å stoppe turbulensen og være nok til å stoppe kaskaden av hendelser (31). På den ene siden er eculizumab en veldig kostbar medisin, men på den andre er kostnadene ved intensivbehandling, plasmautveksling, hemodialyse, mulig nyretransplantasjon, for ikke å nevne de følelsesmessige konsekvensene for mødrene og familiene uvurderlige.
Som en konklusjon var pasienten vår alvorlig syk og opplevde hemolyse, forstyrrelser i koagulasjonen, leverskade og nyresvikt som trengte innleggelse i ICU og hemodialyse. Det er mulig at eculizumab, hvis det ble initiert tidligere, ved de første tegnene på HELLP-syndrom, kan ha vært gunstig i løpet av det senere løpet av sykdommen, potensielt redusere nyreskade, og dermed forhindre behov for hemodialyse og senere CKD. I denne epoken med moderne immunologisk medisin, kunne vi derfor gjøre mer for mødrene og familiene enn å bare vente og håpe på det beste?
Etikkuttalelse
Etisk gjennomgang og godkjenning var ikke kreves for studien på menneskelige deltakere i samsvar med lokal lovgivning og institusjonelle krav. Pasientene / deltakerne ga sitt skriftlige informerte samtykke til å delta i denne studien.
Forfatterbidrag
AL og JH-E utviklet ideen til manuskriptet og skrev manuskriptet. JH-E og MH var involvert i diagnostisk og terapeutisk behandling av pasienten. Alle forfattere gjennomgikk og redigerte manuskriptet og godkjente den endelige versjonen for publisering.
Interessekonflikt
Forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
4. Hauspurg A, Ying W, Hubel CA, Michos ED, Ouyang P. Uønskede graviditetsutfall og fremtidig mors hjerte- og karsykdom. Clin Cardiol. (2018) 41: 239–46. doi: 10.1002 / clc.22887
PubMed Abstract | CrossRef Fulltekst | Google Scholar
5. Brosens I, Pijnenborg R, Vercruysse L, Romero R. The » store obstetriske syndromer «er assosiert med forstyrrelser av dyp placentasjon. Am J Obstet Gynecol. (2011) 204: 193–201. doi: 10.1016 / j.ajog.2010.08.009
PubMed Abstract | CrossRef Fulltekst | Google Scholar
8. Germain SJ, Sacks GP, Soorana SR, Sargent IL, Redman CW . Systemisk inflammatorisk priming ved normal graviditet og svangerskapsforgiftning: rollen som sirkulerende syncytiotrofoblastmikropartikler. J Immunol. (2007) 178: 5949–56. doi: 10.4049 / jimmunol.178.9.5949
PubMed Abstract | CrossRef Fulltekst | Google Scholar
9. Tannetta D, Masliukaite I, Vatish M, Redman C, Sargent I Oppdatering av syncytiotrophoblast avledet ekstracellulære vesikler i normal graviditet og preeklampsi. J Reprod Immunol. (2017) 119: 98–106. doi: 10.1016 / j.jri.2016.08.008
PubMed Abstract | CrossRef Fulltekst | Google Scholar
10. Weinstein L. Hemolysesyndrom, forhøyede leverenzymer og lave blodplater teller: en alvorlig konsekvens av hypertensjon i svangerskapet. Am J Obstet Gynecol. (1982) 142: 159–67. doi: 10.1016 / S0002-9378 (16) 32330-4
PubMed Abstract | CrossRef Fulltekst | Google Scholar
15. Pourrat O, Coudroy R, Pierre F. Differensiering mellom alvorlig HELLP-syndrom og trombotisk mikroangiopati, trombotisk trombocytopen purpura og andre imitatorer. Eur J Obstet Gynecol Reprod Biol. (2015) 189: 68–72. doi: 10.1016 / j.ejogrb.2015.03.017
PubMed Abstract | CrossRef Fulltekst | Google Scholar
20. Agatisa PK, Ness RB, Roberts JM, Costantino JP, Kuller LH , McLaughlin MK. Nedsatt endotelfunksjon hos kvinner med preeklampsi i anamnesen: en indikator på kardiovaskulær risiko. Am J Physiol Hør Circ Physiol. (2004) 286: 1–3. doi: 10.1152 / ajpheart.00298.2003
PubMed Abstract | CrossRef Fulltekst | Google Scholar
22. Kvehaugen AS, Dechend R, Ramstad HB, Troisi R, Fugelseth D , Staff AC. Endotelfunksjon og sirkulerende biomarkører forstyrres hos kvinner og barn etter svangerskapsforgiftning. Hypertensjon. (2011) 58: 63–9. doi: 10.1161 / HYPERTENSIONAHA.111.172387
PubMed Abstract | CrossRef Fulltekst | Google Scholar
23. Stanhewicz AE. Restvaskulær dysfunksjon hos kvinner med preeklampsi i anamnesen. Am J Physiol Regul Integr Comp Physiol. (2018) 315: R1062 – R71. doi: 10.1152 / ajpregu.00204.2018
PubMed Abstract | CrossRef Fulltekst | Google Scholar
25. Vaught AJ, Braunstein EM, Jasem J, Yuan X, Makhlin I , Eloundou S, et al. Germline mutasjoner i den alternative komplementveien disponerer for HELLP syndrom. JCI innsikt. (2018) 3: 0–13. doi: 10.1172 / jci.insight.99128
PubMed Abstract | CrossRef Fulltekst | Google Scholar
31. Elabd H, Elkholi M, Steinberg L, Acharya A. Eculizumab, en ny potensiell behandling for akutt nyreskade assosiert med svangerskapsforgiftning / HELLP syndrom. BMJ Sak Rep. (2019) 12: e228709. doi: 10.1136 / bcr-2018-228709
PubMed Abstract | CrossRef Fulltekst | Google Scholar