Frontiers in Physiology
Introduksjon
Arterielle baroreseptorer fungerer som frontlinjesensorer for å oppdage blodtrykksendringer i blodstrømmen. Endringer i blodtrykk stimulerer de mekanosensitive nerveendene som er lokalisert i arterieveggene. Den mekaniske kraften blir overført til elektriske signaler ved nerveterminalene, noe som resulterer i trykkavhengig handlingspotensial avfyringer i baroreseptorneuroner. Nervesignalene forplanter seg deretter til det kardiovaskulære kontrollsenteret i hjernestammen for barorefleksregulering av blodtrykk (Levy MN, 2007). I tillegg har supra-medullære strukturer, inkludert midbrain cuneiform nucleus og ventral medial prefrontal cortex, også en hemmende rolle i baroreflex regulering (Verberne et al., 1997).
Det er to arterielle baroreceptorer, nemlig, aorta baroreseptorer og carotis baroreseptorer, som ligger i adventitia laget av henholdsvis aortabuen og halspulsårene. Aorta baroreseptorene oppdager blodtrykk i aorta. Cellelegemene (soma) til aorta baroreseptorene er plassert ved nodose ganglion (NG) (figur 1). Nervesignalene fra aorta-baroreseptorens nerveterminaler overføres til nodose ganglion gjennom en sensorisk nerve som heter aorta depressor nerve (ADN) (figur 1). Karotisbaroreseptorer oppdager blodtrykket i halspulsåren, som tilfører blod til hjernen. Nerveterminalene til karotisbaroreseptorer er plassert bilateralt ved halspulsårens bifurkasjoner, nær den indre halspulsåren. Nervesignalene fra karotisbaroreseptorene beveger seg langs carotis sinus nerves (CSN) til deres soma lokalisert i petrosal ganglion (PG). Petrosal ganglion stikker utover jugular foramen (figur 1) (McDonald, 1983; Shoukas et al., 1991; Vander et al., 1998; Sato et al., 1999; Donnelly and Rigual, 2000; Weijnen et al., 2000) . Fordi aorta baroreseptorer registrerer blodtrykk i aorta, som tilfører blod til hele systemisk sirkulasjon, forventes disse baroreseptorene å spille en viktig funksjonell rolle i opprettholdelsen av det totale systemiske blodtrykket. På den annen side oppdager karotisbaroreseptorer blodtrykket som leveres til hjernen. Disse baroreseptorene kan være viktigere for å opprettholde et stabilt cerebralt blodtrykk og cerebral blodstrøm.
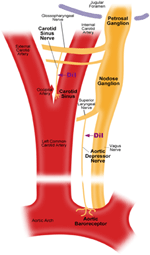
Figur 1. Skjematisk diagram av aorta- og halspulverbareseptorterminaler og nerver. Diagram som illustrerer de anatomiske posisjonene til aorta og carotis baroreseptorer nerveterminaler, deres nervefibre og somata regioner. Aorta baroreceptor terminaler ligger i aortabuen. Den afferente nerven fiber er aorta depressor nerve. Somaen er i nodose ganglion (NG). Karotisbaroreseptor er plassert i den indre halspulsåren ved siden av halspulsforgreningen. Den afferente nerven er carotis sinus nerve. Somaen ligger i petrosal ganglion (PG).
Det er motstridende rapporter om hvilke baroreseptorer, aorta-baroreseptorer eller halspulsår baroreseptorer, er mer følsomme for blodtrykksendring. Noen forskere rapporterte at karotisbaroreseptorene er mer følsomme for trykk (Donald og Edis, 1971; Fadel et al., 2003), mens andre mener at aorta baroreseptorer er mer følsomme for trykk (Glick og Covell, 1968; Pickering et al., 2008), og atter andre har rapportert ingen forskjell i trykkfølsomhet mellom disse to baroreseptorene (Hainswor et al., 1970; James og Daly, 1970). Imidlertid brukte nesten alle disse tidligere studiene bare barorefleksresponsene (som hjertefrekvens og nyresympatisk nerveaktivitet) som sluttpunkt for baroreseptorfølsomhetsanalyse. Det er fremdeles ingen studie som direkte registrerer og sammenligner trykkfølsomheten til aorta- og karotisbaroreseptorneuroner i seg selv.
Her har vi brukt en høyhastighets trykklemme for å endre det hydrostatiske trykket inne i baroreseptorneuronene og målt de tilsvarende elektrofysiologiske responsene til disse nevronene ved fastklemming av helcelleplaster. Vi brukte også et unaksisk strekkammer for å strekke baroreseptorneuronene og målte de tilsvarende endringene i cytosolisk Ca2 + i disse nevronene. I tillegg, for in vivo dyreforsøk, målte vi de trykkinduserte handlingspotensielle avfyringene i aorta depressor og carotis sinus nerves, som er sensoriske nerver til henholdsvis aorta og carotis baroreseptorer.
Materialer og metoder
Dyr
Alle dyreforsøk ble utført under myndighet av en lisens utstedt av regjeringen i Hong Kong SAR og godkjenning fra Animal Experimentation Ethics Committee, det kinesiske universitetet i Hong Kong.Sprague-Dawley (S / D) -rotter (180-200 g) ble levert av Laboratory Animal Services Center ved det kinesiske universitetet i Hong Kong.
Primærkultur
S / D rotter ble bedøvet med pentobarbitalnatrium (100 mg / kg). Det venstre livmorhalsområdet ble utsatt ved midtlinjesnitt under sterilisert tilstand. Som vist i figur 1 ble aorta depressor nerve eller carotis sinus nerve eksponert og 2-3 mm av nerven ble forsiktig løsrevet fra omkringliggende vev ved stump disseksjon. Fluorescerende lipofilt sporstoff 1,1-dioctadecyl-3,3,3 ‘, 3’-tetrametylindokarbocyanin (DiI) krystaller (Invitrogen) ble påført rundt nerven og dekket med Kwik-Sil (World Precision Instruments, USA). Snittet ble sydd etterpå. Rotter fikk komme seg i 5-7 dager for å tillate DiI-fargestoff å diffundere retrograd langs aorta depressor nerve eller carotis sinus nerve til somata lokalisert i henholdsvis nodose ganglion eller petrosal ganglion.
Nodose eller petrosal ganglion nevroner ble isolert fra DiI-merkede rotter og kuttet i biter i iskald EBSS. De ble utsatt for fordøyelse i 1 time ved 37 ° C med trypsin (1 mg / ml) og kollagenase IA (1 mg / ml). Enkeltneuroner ble spredt ved mild triturering av Glass Pasteur-pipette, etterfulgt av sentrifugering. Nevronene ble resuspendert og dyrket i DMEM / F-12 medier supplert med 5% FBS, 1% antibiotikum-antimykotisk og 7S NGF (100 ng / ml). Cytosine arabinofuranoside (Ara-C; 10 μM) ble inkludert i dyrkningsmediet for å hemme veksten av delende celler. Nevronene ble dyrket i minst 3 dager før eksperimenter. For handlingspotensialopptak ble nevronene nylig isolert og inkubert i F12 minst 30 minutter før eksperimenter. For alle eksperimenter ble cellene inkubert på glassplater pre-belagt med 0,1 mg / ml poly-L-lysin, med unntak av celletøyningseksperimenter der silikonkamrene ble forhåndsbelagt med 2% gelatin.
Patch Clamp
Hele-celle gjeldende clamp-opptak ble oppnådd med en EPC7 patch clamp forsterker (HEKA, Tyskland). Plasterpipetter med motstand 3–5 MΩ ble fylt med pipetteløsning (i mM): 130 K-glukonat, 10 KCl, 2 MgCl2, 2 Na2ATP, 0,4 Tris GTP, 1 EGTA, 10 HEPES, pH 7,25-7,3 av KOH. Celler ble badet i den kunstige cerebro-spinalvæsken (ACSF) (i mM): 120 NaCl, 2 KCl, 1,2 MgSO4. % CO2). I gjeldende klemmeopptak ble cellene holdt ved sitt hvilemembranpotensial. Et høytrykkstrykkklemmesystem (HSPC-1, ALA Scientific Instruments, USA) ble brukt for å gi positivt trykk til cellen gjennom mikropipette. Opptak ble samplet ved 50 kHz og filtrert ved 5 kHz. Data ble analysert med PulseFit (HEKA). Alle eksperimentene ble utført ved romtemperatur.
Calcium Imaging
Cytosolisk Ca2 + måling ble utført som beskrevet andre steder (Wong et al., 2010). Kort fortalt ble celler lastet med 5 uM Fluo-4 / AM i 40 minutter. Cytosolisk Ca2 + -måling ble utført med HEPES-bufret løsning (i mM): 140 NaCl, 2,5 KCl, 1 MgCl2, 1 CaCl2,10 HEPES, 10 glukose, pH 7,4 ved NaOH. Cytosolisk Ca2 + -endring som respons på uniaxial stretch ble utført med STREX Cell Stretching System (ST-150, B-Bridge International, Inc.). Cellene ble stimulert med 10, 20 eller 30% av ensrettet strekning i 1 s. Cytosolisk Ca2 + respons ble målt ved romtemperatur. Fluo-4 fluorescensen ble registrert og analysert av FV1000 laserskanning konfokalt bildesystem. Endring i cytosolisk Ca2 + fluorescensrespons ble uttrykt som et forhold (Fx / F0) av sanntidsfluorescens, der Fx er sanntids fluo-4 / AM signal og F0 er baseline fluo-4 / AM signal før strekk. / p>
Registrering av nerveaktivitet
Rotter ble bedøvet med 100 mg / kg pentobarbitalnatrium. Livmorhalsområdet ble utsatt for midtlinjesnitt. Den høyre halspulsåren ble isolert og kanylert av et kateter som var koblet til trykkgiveren (ML221, ADInstruments, USA) for blodtrykksregistrering. Den venstre lårvenen ble kanylert for fenylefrin og SNP-injeksjon. Venstre aorta depressor nerve eller carotis sinus nerve ble koblet til en bipolar sølvelektrode, etterfulgt av og en forsterker (Model 1700 Differential AC Amplifier, A-M Systems Inc., USA). Både blodtrykk og nerveaktivitet ble kontinuerlig registrert i figur 5.0 (AD-instrumenter). Nerveaktiviteten ble forsterket 10 000 ganger og filtrert ved båndpass på 100–5000 Hz. Verdier av gjennomsnittlig arterielt trykk, hjertefrekvens og piggfrekvens som respons på fenylefrin ble analysert ved hjelp av Chart 5.0-programvaren. Endring i piggfrekvens (piggfrekvens etter fenylefrin — piggfrekvens før fenylefrin) som respons på maksimal blodtrykksendring (gjennomsnittlig arterielt blodtrykk etter fenylefrin — gjennomsnittlig arterielt blodtrykk før fenylefrin) ved fenylefrininjeksjon ble beregnet (Lau et al., 2016) .
Statistisk analyse
Representative spor ble tegnet som tidsforløpsspor. Data fra alle eksperimenter ble oppsummert i søylediagram som ble uttrykt i gjennomsnitt ± sem av individuelle eksperimenter. Studentens t-test ble brukt til statistisk analyse. Parvis t-test ble brukt der det var hensiktsmessig.
Resultater
Egenskaper til aortadepressor-neuroner og karotis-sinusneuroner
Dil ble påført enten aortadepressornerven eller carotis sinusnerven. Derfor inkluderte Dil-merkede nevroner i nodose ganglion baroreseptorneuronene som innerverte aortabuen og kjemoreseptorneuronene som innerverte aortakroppen. På den annen side, Dil-merkede nevroner i petrosal ganglion inkluderte baroreseptorneuronene som innerverer halspulsbihule og kjemoreseptorneuronene som innerverer karotislegemet. Vi undersøkte først grunnleggende egenskaper til disse Dil-merkede nevronene. DiI-merkede nevroner i nodose og petrosal ganglion ble dyrket separat og utsatt for en depolariserende elektrisk strøm vist i figur 2. To typer responser ble registrert, den ene svarte med et enkelt handlingspotensial og den andre med kontinuerlige handlingspotensialer etter den depolariserende strømmen (figur 2) (Belmonte og Gallego, 1983). Disse nevronene ble deretter utsatt for en hydrostatisk trykkprotokoll for å teste deres følsomhet for endringer i hydrostatisk trykk. En positiv hydrostatisk trykkrampe ble påført intracellulært gjennom en glassmikropipette av høyhastighets trykklemmesystem (HSPC-1, ALA Scientific Instruments, USA) til handlingspotensialer ble fremkalt. Resultatene viste at 45% av aorta-baroreseptorneuroner avfyrte kontinuerlige handlingspotensialer som svar på den depolariserende elektriske strømmen (tabell 1A). Blant dem svarte 91% (41% / 45%) også på den hydrostatiske trykkendringen og viste trykkavhengig handlingspotensialskyting (tabell 1A). De resterende 55% av aorta-baroreseptorneuroner avfyrte bare et enkelt handlingspotensial som svar på den depolariserende strømmen (tabell 1A), og blant dem kunne 40% (22% / 55%) svare på trykkendringen (tabell 1A). For karotisbaroreseptorneuronene ga 45% av cellene kontinuerlig handlingspotensial når de ble stimulert av den depolariserende strømmen (tabell 1B). Blant dem var 82% (37% / 45%) også følsomme for trykkendringen (tabell 1B). I tillegg, blant karotis-baroreseptorneuronene som bare avfyrte et enkelt handlingspotensial som svar på den depolariserende strømmen, kunne 24% (13% / 55%) svare på trykkendringen (Tabell 1B).
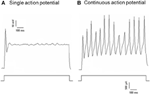
Figur 2. Handlingspotensialregistrering fra kultivert aortadepressor og carotis sinusneuroner. Vist er spor av handlingspotensialer som ble registrert fra to representative aorta depressor / carotis sinus neuroner på en depolariserende strøm. (A) En representativ nevron som bare utløser et enkelt handlingspotensial ved den nåværende stimuleringen; (B) En representant nevroner som bare skyter kontinuerlig handlingspotensial på den nåværende stimuleringen. Nedre panel: protokoll for nåværende injeksjon. Skaleringslinje, horisontal, 100 ms, vertikal, 10 mV (øvre spor) og 500 pA (nedre spor). n = 27 og n = 38 for henholdsvis aortadepressor og carotis sinusneuroner.

Tabell 1. Egenskaper til aorta depressor og carotis sinus neurons.
Uansett om de avfyrte en enkelt aksjonspotensial eller kontinuerlig handlingspotensial, ble 63% av Dil-merkede aorta-baroreseptorneuroner funnet å være følsomme for trykkendringen, mens bare 50% av Dil-merkede karotisbaroreseptorneuroner var følsomme for trykkendring (tabell 1).
Stretch Sensitivity of Aortic and Carotid Baroreceptor Neurons
Trykkterskelen for handlingspotensialutladningen ble analysert. Som vist i figur 3 hadde aorta-baroreseptorneuroner en lavere trykkterskel (24 ± 4 mmHg) enn karotis-baroreseptorneuronene (39 ± 4 mmHg).

Figur 3. Følsomheter av aorta- og karotisbaroreseptorneuroner for hydrostatisk trykk. (A, B) Øvre panel, representative tidsforløpsspor som illustrerer trykkavhengige handlingspotensielle avfyringer i aorta (A) og halspuls (B) baroreseptorneuroner. Trykkrampen (nedre panel) ble påført på innsiden av celler gjennom en mikropipette ved bruk av et høytrykkstrykkklemmesystem (HSPC). Skala bar vannrett, 1 s, vertikal, 20 mV og 20 mmHg. (C) Sammendrag som viser trykkterskelen som initierer handlingspotensielle avfyringer i aorta- og karotisbaroreseptorneuroner. n = 13 for aorta-baroreseptorneuroner og n = 15 for karotisbaroreseptorneuroner. *** p < 0,01, av Studentens t-test.
Stretch-induced Ca2 + Response in Baroreceptor Neurons
Kultivert aorta depressor eller carotis sinus neurons ble utsatt for 10, 20 eller 30% av uniaxial stretch ved STREX Cell Stretching System, og prøver å etterligne blodåren som strekker seg under blodtrykk. Resultatene viste at en unaksiell strekning på 20% induserte en markant økning i cytosolisk Ca2 + -fluorescens i aorta-baroreseptorneuroner, men ikke i karotis-baroreseptorneuroner (figur 4A – C). Videre økte størrelsen på Ca2 + fluorescens som respons på 30% uniaxial strekning mye høyere i aorta baroreceptor neuroner enn i carotis baroreceptor neuroner (figur 4A – C).
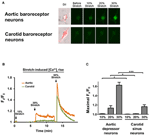
Figur 4. Følsomheter av aorta depressor og carotis sinus neurons til uniaxial stretch. Cellene ble fylt med Ca2 + -følsomme fluorescerende fargestoff Fluo-4 / AM. Vist er representative bilder (A) og tidsforløpsspor (B) av relative cytosoliske Ca2 + stiger som svar på enaksig strekning på 10, 20 og 30% av cellelengden i aortadepressor og carotis sinus neuroner. (C) Sammendrag av maksimal cytosolisk Ca2 + økning som svar på ulik grad av strekk. Endring i cytosolisk Ca2 + ble uttrykt som Fx / F0, der Fx er at sanntids fluo-4 / AM-signal og F0 er baseline fluo-4 / AM-signal før strekk. Gjennomsnitt ± s.e.m. (n = 5). * p < 0,05, *** p < 0,01 sammenlignet med den tilsvarende kontrollen, ved parvis t-test.
Baroreseptor nerveaktivitet in vivo
Nerveaktiviteten til de to baroreseptorene ble undersøkt in vivo. Fenylefrin ble injisert intravenøst. Endringene i blodtrykk ved påføring av fenylefrin er vist i øvre panel i figurene 5A, B. Påfølgende endringer i baroreseptorens nerveaktivitet er vist i nedre panel (figur 5A, B). Den trykkinduserte nerveaktiviteten var mye høyere i aorta depresjonsnerven enn i sinusnerven i halsen (figur 5A, B). Endringen i piggfrekvens per mmHg økning er oppsummert i figur 5C. Resultatet indikerte at aorta-baroreseptorene er mer følsomme for hydrostatisk trykk enn carotis-baroreseptorene in vivo.
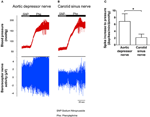
Figur 5. Baroreseptorens nerveaktivitet i rotte in vivo. (A, B) Representative spor som viser endring i aorta depressor nerve (A) og carotis sinus nerve (B) aktivitet ved forhøyet blodtrykk. I begge (A, B) var det øvre panelet endringen i blodtrykk før og etter Phe-påføring som indikert av de horisontale stolpene. Nedre panel var den tilsvarende endringen i nerveaktivitet. (C) Oppsummerte data som viser endringen i nerveaktivitet per enhet blodtrykksendring. Gjennomsnitt ± s.e.m. (n = 8). * p < 0,05 sammenlignet med kontrollen i aorta baroreseptorer, ved parvis t-test.
Uttrykk av TRP-kanaler
Flere TRP-kanaler er rapportert å være mekanosensitive, inkludert TRPC1, -C3, -C5, -C6, -V1, -V4, -P2 (O «Neil og Heller, 2005; Christensen og Corey, 2007; Pedersen og Nilius, 2007; Patel et al., 2010; Lau et al., 2016). Her undersøkte vi den mulige rollen til disse mekanosensitive TRP-kanalene i forhold til aorta og carotisbaroreseptorsensitivitet. mRNA-uttrykkene til disse kanalene i nodose og petrosal ganglion ble sammenlignet. Det ble funnet at uttrykkene for TRPV4 og TRPC6 var høyere i nodose ganglion sammenlignet med petrosal ganglion (figur 6). Det er mulig at den høyere uttrykk for mekanosensitive kanaler i nodose ganglion kan bidra til høyere følsomhet.
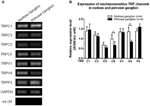
Figur 6. Uttrykk for mekanosensitive TRP-kanaler i nodose og petrosal ganglion. (A) Representative gelbilder som sammenligner mRNA-ekspressjonsnivået til mekanosensitive TRP-kanaler, (TRPC1, -C3, -C5, -C6, -V1, -V4, -P2) mellom nodose og petrosale ganglionneuroner. Semikvantitativ RT-PCR-analyse ble brukt til å sammenligne mRNA-ekspresjonsnivåene til flere TRP-kanaler i forhold til GAPDH mRNA-uttrykk. Resultatene av 9 eksperimenter ble oppsummert i (B). Verdiene var i gjennomsnitt ± sem. * p < 0,05, ved parvis t-test.
Diskusjon
I denne studien ble de mekanosensitive egenskapene til aorta og carotis baroreseptorer sammenlignet. Hele-celle patch klemstudier viste at, sammenlignet med carotis sinus neuroner, var en høyere prosentandel av aorta depressor neuroner strekkfølsomme. Videre ble trykkterskelen som kunne initiere handlingspotensielle avfyringer funnet å være lavere i aorta-baroreseptorneuronene enn i karotis-baroreseptorneuronene. Uniaxial strekningsindusert cytosolisk Ca2 + -stigning ble også sammenlignet mellom aortadepressoren og karotis sinusneuroner.Størrelsen på den cytosoliske Ca2 + -stigningen som respons på den enaksige strekningen var mye høyere i aorta-baroreseptorneuroner enn i karotis-baroreseptorneuroner. Aorta-baroreseptorneuroner viste også en lavere terskel for cytosoliske Ca2 + -responser på uniaxial stretch. I en annen serie eksperimenter fant vi at trykkindusert økning i handlingspotensielle avfyringer var høyere i aorta depressor nerve enn i carotis sinus nerve. Til sammen gir våre data sterke bevis for at aorta-baroreseptorene er mer følsomme for blodtrykk enn carotis-baroreseptorer.
Tidligere har det blitt gjort mye arbeid for å forstå forskjellen i følsomhet mellom de to baroreseptorene. Resultatene er imidlertid kontroversielle. Noen rapporter konkluderte med at aorta-baroreseptorene er mer følsomme for trykkendring (Glick og Covell, 1968; Fan et al., 1996; Pickering et al., 2008), mens andre uttalte at carotisbaroreseptorene er mer følsomme for trykkendring (Donald og Edis, 1971; Fadel et al., 2003). Imidlertid involverte nesten alle disse tidligere studiene svært kompliserte kirurgiske prosedyrer og til slutt brukte baroreflexresponser, som hjertefrekvens og nyresympatisk utgang, som sluttpunkt for baroreseptorfølsomhetsanalyse. Kompliserte kirurgiske prosedyrer er tilbøyelige til å innføre eksperimentelle feil, noe som kan resultere i kontroversielle konklusjoner. Videre er dyreartsavhengig variasjon i baroreseptorfølsomhet også mulig. Videre påvirkes barorefleksresponsen ikke bare av baroreseptorfølsomhet, men også av flere andre faktorer, inkludert nerveledning, sentral mediasjon, blodkarets kontraktilitet og hjertefunksjon. Derfor er bevisene fra tidligere studier indirekte og neppe ideelle. Inntil i dag mangler det direkte studier som sammenligner trykkfølsomheten til aorta vs. I denne studien ble mekanosensitiviteten studert direkte i baroreseptorneuroner. Dataene antyder sterkt at aorta baroreseptorer er mer følsomme for trykk enn carotis baroreseptorer. Denne informasjonen kan ha viktig fysiologisk relevans i blodtrykksreguleringen.
Det er uklart hvilke mekanismer som ligger til grunn for forskjellen i trykkfølsomhet mellom aorta og carotis baroreseptorer. Vi sammenlignet ekspresjonsnivået til flere mekanosensitive TRP-kanaler (Figur 6) (O «Neil og Heller, 2005; Christensen og Corey, 2007; Pedersen og Nilius, 2007; Patel et al., 2010). Resultatene våre viste at aorta-baroreseptorneuroner har et høyere uttrykk for flere mekanosensitive TRP-kanaler, inkludert TRPV4 og TRPC6. Det er mulig at høyere ekspresjon av TRPV4 og / eller TRPC6 kan bidra til høy trykkfølsomhet av aorta baroreseptorer. Ytterligere studier er nødvendige for å verifisere rollen til disse ionekanalene.
Det ble tidligere rapportert at nodose ganglion og petrosal ganglion inneholder to forskjellige typer nevroner (Belmonte og Gallego, 1983). Den ene av dem gir kontinuerlige handlingspotensialer ved elektrisk stimulering, mens den andre bare gir en enkelt handling potensial ved stimulering. Forfatterne tildelte førstnevnte som de trykkfølsomme nevronene, og tildelte sistnevnte som de kjemosensitive nevronene. Våre resultater indikerer at det kanskje ikke er appropria te å tilordne de trykkfølsomme nevronene og de trykkfølsomme nevronene bare basert på om de avfyrer et enkelt handlingspotensial eller kontinuerlige handlingspotensialer som svar på den depolariserende strømmen. Faktisk er en stor andel celler som avfyrer et enkelt handlingspotensial som svar på elektrisk stimulering også følsomme for trykk, og dermed tilhører de trykkfølsomme baroreseptorneuroner (figur 2 og tabell 1).
Oppsummert gir denne studien bevis for at aorta-baroreseptorene er mer følsomme for trykk enn carotis-baroreseptorene, og gir ny informasjon til forståelsen av den grunnleggende fysiologien.
Forfatterbidrag
EL og XY designe eksperimentene og utarbeide manuskriptet. EL, CL og YY utfører eksperimentene. XY, YH, AM og LJ reviderte manuskriptet. Alle forfattere godkjente den endelige versjonen av manuskriptet.
Finansiering
Dette arbeidet ble støttet av tilskudd fra Hong Kong Research Grant Committee CUHK478710, CUHK478413, AoE / M-05/12, TBRS / T13-706 / 11, China National Science Foundation Grant 31470912 og RGC-NSFC Joint Grant N_CUHK439 / 13.
Erklæring om interessekonflikt
Forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
James, JEA og Daly, MDB (1970). Sammenligning av refleks vasomotoriske responser til separat og kombinert stimulering av carotis sinus og aortabuen baroreseptorer ved pulserende og ikke-pulserende trykk hos hund. J. Physiol. 209, 257–293. doi: 10.1113 / jphysiol.1970.sp009165
PubMed Abstract | CrossRef Fulltekst | Google Scholar
Levy MN, P. A. (2007). Kardiovaskulær fysiologi. Philadelphia, PA: Mosby Elsevier.
Vander, A. J., Sherman, J. H. og Luciano, D. S. (1998). Human Physiology: the Mechanism of Body Function. Boston, MA: WCB McGraw-Hill.