Fysisk geologi (Norsk)
De aller fleste mineralene som utgjør bergarter av jordskorpen er silikatmineraler. Disse inkluderer mineraler som kvarts, feltspat, glimmer, amfibol, pyroksen, olivin og et stort utvalg av leirmineraler. Byggesteinen til alle disse mineralene er silika tetraeder, en kombinasjon av fire oksygenatomer og ett silisiumatom. Disse er ordnet slik at plan trukket gjennom oksygenatomene danner en tetraeder (figur 2.6). Siden silisiumionen har en ladning på +4 og hver av de fire oksygenionene har en ladning på –2, har silika-tetraeder en nettolading på –4.
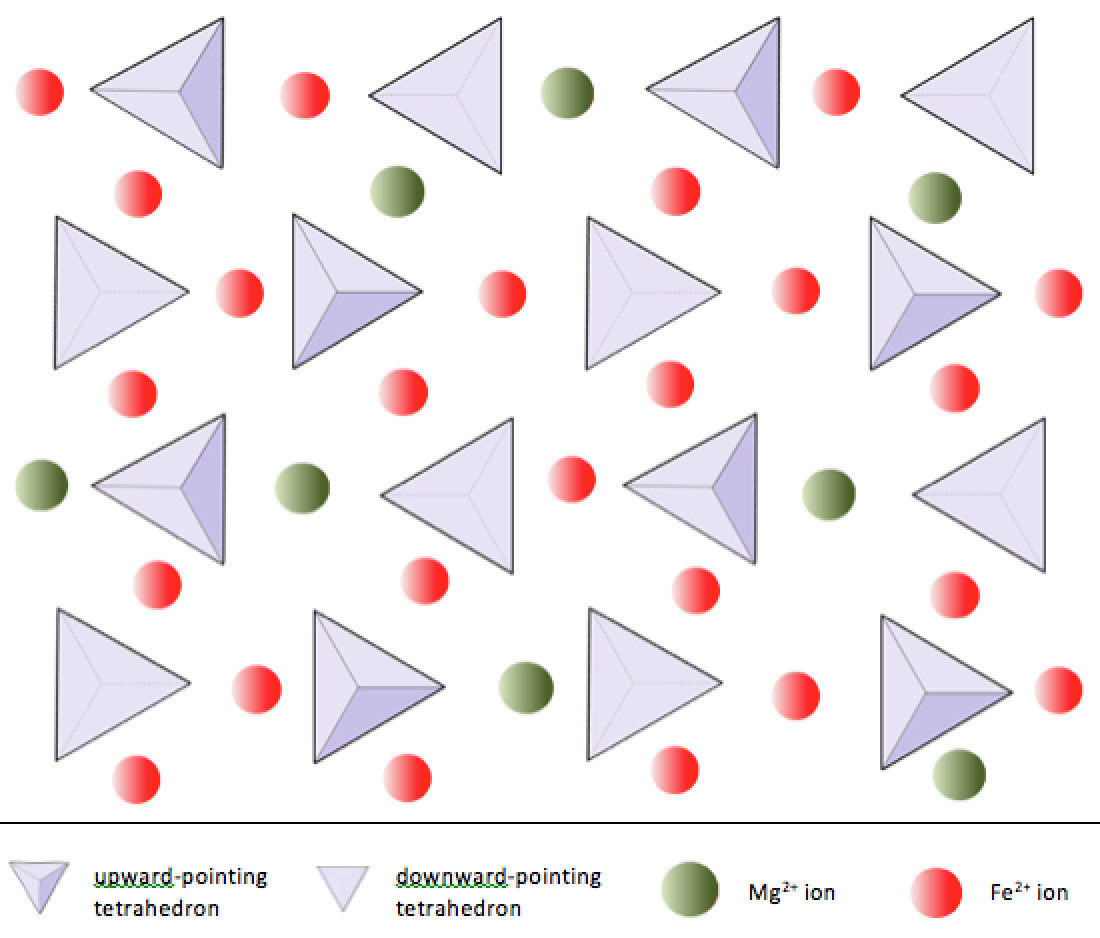
I silikatmineraler er disse tetraederne ordnet og koblet sammen på en rekke måter, fra enkeltenheter til komplekse rammer (figur 2.9). Den enkleste silikatstrukturen, mineralolivin, består av isolerte tetraeder bundet til jern- og / eller magnesiumioner. I olivin balanseres –4-ladningen av hvert silika tetraeder av to divalente (dvs. +2) jern- eller magnesiumkationer. Olivin kan være enten Mg2SiO4 eller Fe2SiO4, eller en kombinasjon av de to (Mg, Fe) 2SiO4. De toverdige kationene av magnesium og jern er ganske nær i radius (0,73 kontra 0,62 Ångstrøm). På grunn av denne størrelseslikheten, og fordi de begge er toverdige kationer (begge har en ladning på +2), kan jern og magnesium lett erstatte hverandre i olivin og i mange andre mineraler.
| Tetraederkonfigurasjon | Eksempel på mineraler | |
|---|---|---|
 |
Isolert (nesosilikater) | Olivin, granat, zirkon, kyanitt |
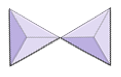 |
Par (sorosilikater) | Epidote, zoisite |
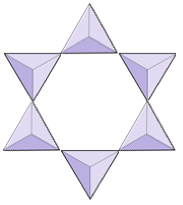 |
Ringer (syklosilikater) | Turmalin |
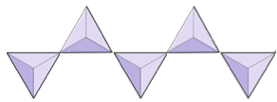 |
Enkeltkjeder (inosilikater) | Pyroxener, wollastonitt |
 |
Dobbeltkjeder (inosilikater) | Amfiboler |
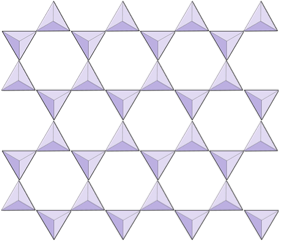 |
Ark (fyllosilikater) | Micas, leirmineraler, serpentin, kloritt |
| tredimensjonalt struktur | Rammeverk (tektosilikater) | Feltspat, kvarts, zeolit |
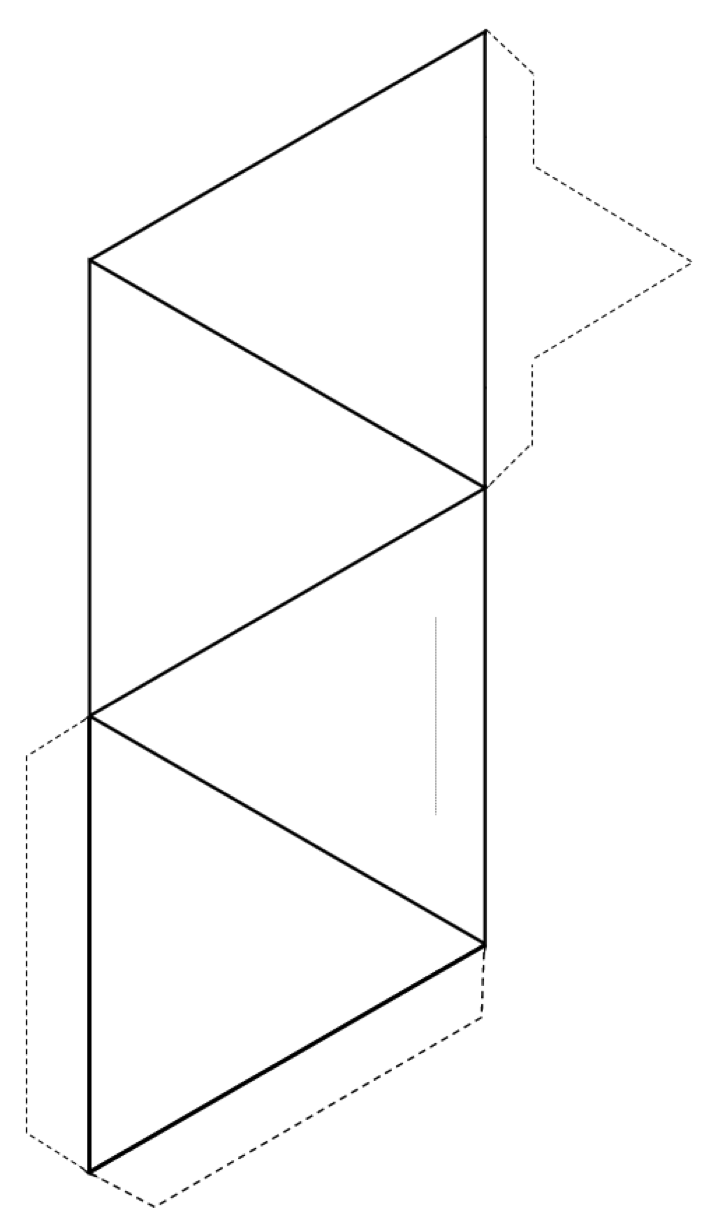
Oppgave 2.3 Lag et tetraeder
Skjær rundt utsiden av formen (solide linjer og stiplede linjer), og brett deretter langs de faste linjene for å danne et tetraeder.
Hvis du har lim eller tape, fest tapper til tetraederet for å holde det sammen. Hvis du ikke har lim eller teip, lager du et stykke langs den tynne grå linjen og setter den spisse tappen inn i spalten.
Hvis du gjør dette i et klasserom, kan du prøve å bli med tetraeder med andre i par, ringer, enkle og doble kjeder, ark og til og med tredimensjonale rammer.
I olivin, i motsetning til de fleste andre silikatmineraler, er ikke silika tetraeder bundet til hver annen. De er imidlertid bundet til jernet og / eller magnesiumet som vist på figur 2.10.
Som allerede nevnt, +2 ionene av jern og magnesium er like store (men ikke helt like). Dette gjør at de kan erstatte hverandre i noen silikatmineraler. Faktisk har de vanlige ionene i silikatmineraler et bredt spekter av størrelser, som vist i figur 2.11. Alle ionene som vises er kationer, bortsett fra oksygen. Merk at jern kan eksistere som både et +2-ion (hvis det mister to elektroner under ionisering) eller et +3-ion (hvis det mister tre). Fe2 + er kjent som jernholdig jern. Fe3 + er kjent som jern jern. Ioniske radier er kritiske for sammensetningen av silikatmineraler, så vi vil referere til dette diagrammet igjen.

Strukturen til enkeltkjeden silikatpyroksen er vist på figurene 2.12 og 2.13. I pyroksen er silika tetraeder koblet sammen i en enkelt kjede, hvor ett oksygenion fra hver tetraeder deles med tilstøtende tetraeder, derfor er det færre oksygener i strukturen.Resultatet er at oksygen-til-silisiumforholdet er lavere enn i olivin (3: 1 i stedet for 4: 1), og nettoladningen per silisiumatom er mindre (–2 i stedet for –4), siden færre kationer er nødvendige for å balansere den belastningen. Pyroksenblandinger er av typen MgSiO3, FeSiO3 og CaSiO3, eller en eller annen kombinasjon av disse. Pyroksen kan også skrives som (Mg, Fe, Ca) SiO3, der elementene i parentesene kan være tilstede i alle forhold. Med andre ord har pyroksen ett kation for hvert silika tetraeder (f.eks. MgSiO3) mens olivin har to (f.eks. Mg2SiO4). Fordi hvert silisiumion er +4 og hvert oksygenion er –2, gir de tre oksygene (–6) og det ene silisiumet (+4) en nettolading på –2 for den enkle kjeden av silika tetraeder. I pyroksen balanserer den ene divalente kationen (2+) per tetraeder den -2 ladningen. I olivin tar det to divalente kationer for å balansere –4 ladningen til et isolert tetraeder.
Strukturen til pyroksen er mer «tillatelig» enn den for olivin – noe som betyr at kationer med et bredere spekter av ioniske radier kan passe inn i det. Derfor kan pyroksener ha jern (radius 0,63 Å) eller magnesium (radius 0,72 Å) eller kalsium (radius 1,00 Å) kationer.
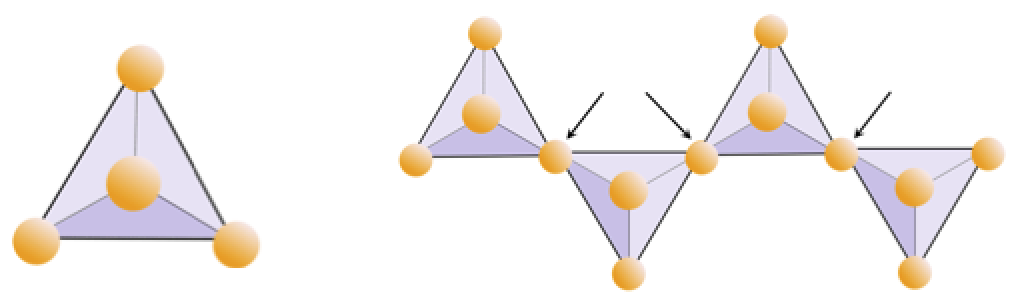
Oppgave 2.4 Oksygenmangel
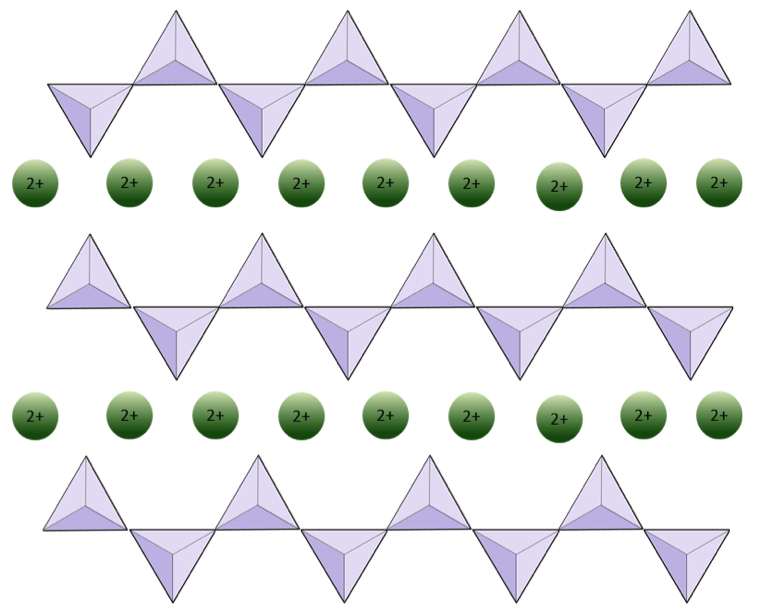
Diagrammet nedenfor representerer en enkelt kjede i et silikatmineral. Telle antall tetraeder mot antall oksygenioner (gule kuler). Hver tetraeder har ett silisiumion, så dette skal gi forholdet mellom Si og O i enkeltkjedede silikater (f.eks. Pyroksen).
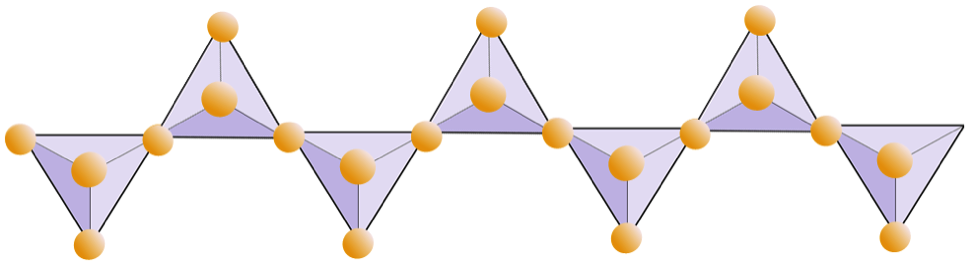
Diagrammet nedenfor representerer en dobbel kjede i et silikatmineral. Igjen, tell antall tetraeder mot antall oksygenioner. Dette skal gi deg forholdet mellom Si og O i dobbeltkjedede silikater (f.eks. Amfibol).
I amfibolstrukturer er silisiumtetrahedra bundet i en dobbel kjede som har et oksygen-til-silisiumforhold lavere enn pyroksen, og det er derfor enda færre kationer som er nødvendige for å balansere ladningen. Amfibol er enda mer tillatelig enn pyroksen, og sammensetningene kan være svært komplekse. Hornblende kan for eksempel inkludere natrium, kalium, kalsium, magnesium, jern, aluminium, silisium, oksygen, fluor og hydroksylionet (OH–).
I glimmerstrukturer er silika tetraeder er ordnet i kontinuerlige ark, hvor hver tetraeder deler tre oksygenanioner med tilstøtende tetraeder. Det er enda mer deling av oksygener mellom tilstøtende tetraeder, og det er derfor behov for færre ladningsbalanserende kationer for arksilikatmineraler. Limingen mellom ark er relativt svak, og dette tegner seg for den velutviklede enveis spaltingen (figur 2.14). Biotittglimmer kan ha jern og / eller magnesium i seg, og det gjør det til et ferromagnesisk silikatmineral (som olivin, pyroksen og amfibol). Kloritt er et annet lignende mineral som ofte inkluderer magnesium. I muskovittglimmer er de eneste kationene som er tilstede aluminium og kalium; derav er det et ikke-ferromagnesisk silikatmineral.

Bortsett fra muskovitt, biotitt og kloritt, er det mange andre ark-silikater (eller fyllosilikater), som eksisterer vanligvis som leirstørrelser (dvs. mindre enn 0,004 mm). Disse inkluderer leirmineralene kaolinitt, illitt og smektitt, og selv om de er vanskelige å studere på grunn av deres meget små størrelse, er de ekstremt viktige komponenter i bergarter og spesielt jord.
Alt ark silikat mineraler har også vann i sin struktur.
Silica tetrahedra er bundet i tredimensjonale rammer i både feltspatene og kvartset. Dette er ikke-ferromagnesiske mineraler – de inneholder ikke jern eller magnesium.I tillegg til silika tetraeder inkluderer feltspatene kationene aluminium, kalium, natrium og kalsium i forskjellige kombinasjoner. Kvarts inneholder bare silika tetraeder.
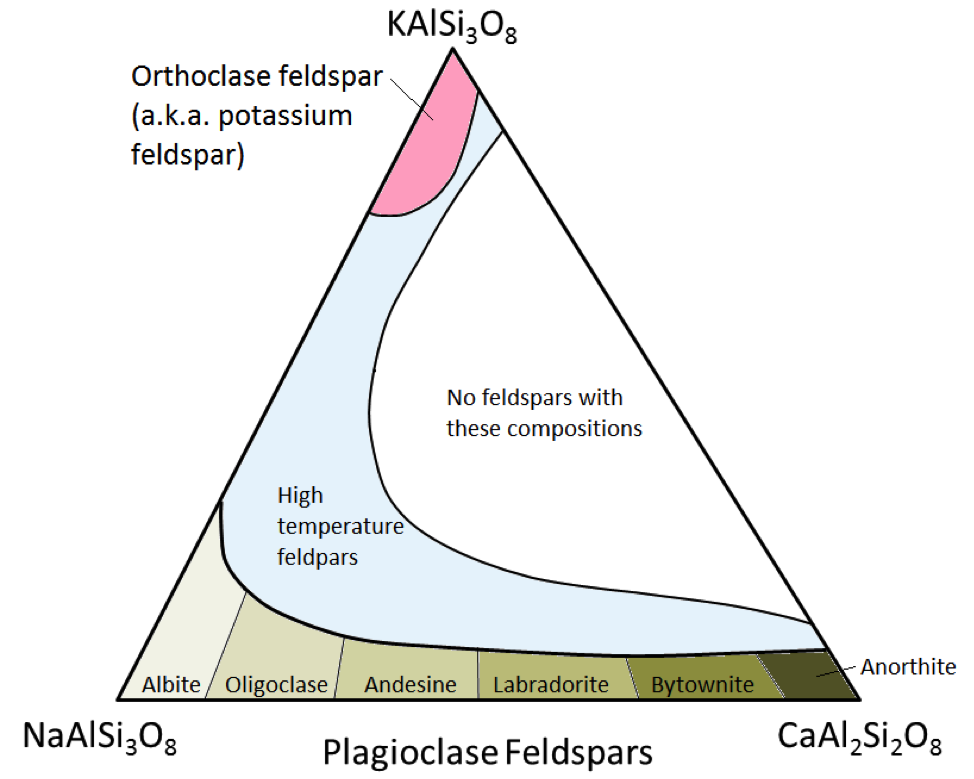
De tre viktigste feltspatmineralene er kaliumfeltspar, (aka K-feltspat eller K-spar) og to typer plagioklase feltspat: albitt (kun natrium) og anortitt (kun kalsium) . Som det er tilfelle for jern og magnesium i olivin, er det et kontinuerlig utvalg av sammensetninger (fast løsningsserie) mellom albitt og anortitt i plagioklase. Dette er fordi kalsium- og natriumionene er nesten identiske i størrelse (1,00 Å versus 0,99 Å). Eventuelle mellomposisjoner mellom CaAl2Si3O8 og NaAlSi3O8 kan eksistere (figur 2.15). Dette er litt overraskende fordi selv om de er veldig like i størrelse, har ikke kalsium- og natriumioner den samme ladningen (Ca2 + versus Na +). Dette problemet regnes med tilsvarende erstatning av Al3 + for Si4 +. Derfor er albitt NaAlSi3O8 (en Al og tre Si) mens anortitt er CaAl2Si2O8 (to Al og to Si), og plagioklase feltspat med mellomproduksjon har mellomproduksjoner av Al og Si. Dette kalles en «koblet-erstatning.»
Mellom-sammensetning plagioklase feltspatene er oligoklase (10% til 30% Ca), andesin (30% til 50% Ca), labradoritt (50% til 70 % Ca) og bytownite (70% til 90% Ca). K-feltspat (KAlSi3O8) har en litt annen struktur enn plagioklase på grunn av den større størrelsen på kaliumionen (1,37 Å) og på grunn av denne store størrelsen , kalium og natrium erstatter ikke lett hverandre, bortsett fra ved høye temperaturer. Disse høydetemperaturfeltspatene vil sannsynligvis bare bli funnet i vulkanske bergarter fordi påtrengende vulkanske bergarter avkjøles sakte til lave temperaturer for at feltspatene kan endre seg til et av former med lavere temperatur.
I kvarts (SiO2) er silika tetraedrene bundet i et «perfekt» tredimensjonalt rammeverk. Hver tetraeder er bundet til fire andre tetraeder (med et oksygen delt i hvert hjørne av hvert tetraeder), og som et resultat er forholdet mellom silisium og oksygen 1: 2. Siden det ene silisiumkationen har en +4 ladning og de to oksygenanionene har en -2 ladning, er ladningen balansert. Det er ikke behov for aluminium eller noen av de andre kationene som natrium eller kalium. Hardheten og mangelen på spaltning i kvarts skyldes de sterke kovalente / ioniske bindingene som er karakteristiske for silika tetraeder.
Oppgave 2.5 Ferromagnesiske silikater?
Silikatmineraler klassifiseres som ferromagnesiske eller ikke-ferromagnesiske, avhengig av om de har jern (Fe) og / eller magnesium (Mg) i formelen. En rekke mineraler og deres formler er listet opp nedenfor. For hver enkelt, angi om det er et ferromagnesisk silikat.
| Mineral | Formel | Ferromagnesisk silikat? |
|---|---|---|
| olivin | (Mg, Fe) 2SiO4 | |
| pyritt | FeS2 | |
| plagioclase | CaAl2Si2O8 | |
| pyroksen | MgSiO3 | |
| hematitt | Fe2O3 | |
| ortoklas | KAlSi3O8 | |
| kvarts | SiO2 |
| Mineral | Formel * | Ferromagnesisk silikat? |
|---|---|---|
| amfibole | Fe7Si8O22 (OH) 2 | |
| muscovite | K2Al4 Si6Al2O20 (OH) 4 | |
| magnetitt | Fe3O4 | |
| biotitt | K2Fe4Al2Si6Al4O20 (OH) 4 | |
| dolomitt | (Ca, Mg) CO3 | |
| granat | Fe2Al2Si3O12 | |
| serpentine | Mg3Si2O5 (OH) 4 |
* Noen av formlene, spesielt de mer kompliserte, er forenklet.
- En angstrom er den enheten som ofte brukes til uttrykk for atom -skala dimensjoner. Én angstrøm er 10–10 m eller 0.0000000001 m. Symbolet for en angstrøm er Å. ↵