Kadmiumelementfakta
Det kjemiske elementet kadmium er klassifisert som et overgangsmetall. Den ble oppdaget i 1817 av Friedrich Stromeyer.

Datasone
| Klassifisering: | Cadmium er et overgangsmetall |
| Farge: | blåhvitt |
| Atomvekt: | 112.41 |
| Tilstand: | solid |
| Smeltepunkt: | 321,1 oC, 594,3 K |
| Kokepunkt: | 765 oC, 1038 K |
| Elektroner: | 48 |
| Protoner: | 48 |
| Nøytroner i mest vanlig isotop: | 66 |
| Elektronskall: | 2,8,18,18,2 |
| Elektronkonfigurasjon: | 4d10 5s2 |
| Tetthet @ 20oC: | 8,65 g / cm3 |
Vis mer, inkludert: Heats, Energies, Oxidation, Reactions,
Compounds, Radii, Ledningsevne
| Atomvolum: | 13,1 cm3 / mol |
| Struktur: | hcp: sekskantet tettpakket |
| Hardhet: | 2.0 mohs |
| Spesifikk varmekapasitet | 0,23 J g-1 K-1 |
| Fusjonsvarme | 6.192 kJ mol-1 |
| Forstøvningsvarme | 112 kJ mol-1 |
| Fordampningsvarme | 99,87 kJ mol-1 |
| 1. ioniseringsenergi | 867,7 kJ mol-1 |
| 2. ioniseringsenergi | 1631,4 kJ mol-1 |
| 3. ioniseringsenergi | 3616,2 kJ mol-1 |
| Elektronaffinitet | – |
| Minimum oksidasjonsnummer | 0 |
| Min. vanlig oksidasjonsnummer | 0 |
| Maksimalt oksidasjonsnummer | 2 |
| Maks. vanlig oksidasjon nr. | 2 |
| Elektronegativitet (Pauling Scale) | 1,69 |
| Polariserbarhet volum | 7.2 Å3 |
| Reaksjon med luft | mild, w / ht ⇒ CdO |
| Reaksjon med 15 M HNO3 | mild ⇒ Cd (NO3) 2, NOx |
| Reaksjon med 6 M HCl | mild, ⇒ H2, CdCl2 |
| Reaksjon med 6 M NaOH | ingen |
| Oksid (s) | CdO, CdO2 |
| Hydride (s) | CdH2 |
| Klorid (er) | CdCl2 |
| Atomeradius | 151 pm |
| Ionic radius (1+ ion) | – |
| Ionic radius (2+ ion) | 109 pm |
| Ionic radius (3+ ion) | – |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionisk radius (3- ion) | – |
| The rmal ledningsevne | 96,6 W m-1 K-1 |
| Elektrisk ledningsevne | 14,7 x 106 S m-1 |
| Frysepunkt / smeltepunkt: | 321,1 oC, 594,3 K |

En liten kule av kadmiummetall, med en mynt for størrelsesreferanse.

Friedrich Stromeyer, som oppdaget kadmium i 1817.
Cadmium’s Periodic Table Neighborhood
| Group 11 |
Gruppe 12 | Gruppe 13 | |
| 4 | 29 Cu |
30 Zn |
31 Ga |
| 5 | 47 Ag |
48 Cd |
49 I |
| 6 | 79 Au |
80 Hg |
81 Tl |
Discovery of Cadmium
Kadmium ble oppdaget av den tyske kjemikeren Friedrich Stromeyer i 1817 som en urenhet i sinkoksid. (1)
Stromeyer gjorde oppdagelsen etter en anmodning fra regjeringen om å inspisere apotekene i byen Hildesheim, Tyskland.
I disse dager ble sinkoksid, som det fremdeles er, brukt til å behandle hudsykdommer. Av en eller annen grunn solgte Hildesheims apotek sinkkarbonat i stedet for det vanlige sinkoksydet.
Stromeyer var klar over at oppvarming av sinkarbonat til det var glødende ville omdanne det til oksidet. Han gjorde dette med prøver fra apotekene. Han fant at det strålende hvite karbonatet ble til et oksid som burde ha vært hvitt, men faktisk var gult / oransje.
Normalt antyder denne fargen forurensning av jern eller bly, men Stromeyer kunne ikke finne noe spor av disse elementene.
Han besøkte fabrikken i Salzgitter der apotekene hadde kjøpt sinkkarbonat. Han spurte hvorfor de solgte sinkkarbonat i stedet for det vanlige oksidet.
Lederen forklarte ham at sinkkarbonat var den forventede fargen – hvit – og at det var lett å selge.
Da de prøvde å omdanne karbonatet til oksidet ved oppvarming, det ble alltid gult. Siden sinkoksid burde være hvitt, kunne de ikke selge det. De hadde analysert det nøye for jernforurensning, men kunne ikke finne noe.
Stromeyer bestemte seg da for at han selv skulle analysere dette gule sinkoksidet. Han fant at den gule fargen var forårsaket av «tilstedeværelsen av et særegent metalloksid, som til nå ikke hadde blitt mistenkt.»
Han ekstraherte dette nye metalloksydet fra sinkoksidet og reduserte det for å isolere verdens første kadmiummetall noensinne. Han sammenlignet utseendet med platina og målte dens tetthet som 8,75 g / cm3 – veldig nær dagens akseptert verdi.
Han arbeidet videre og fant at andre sinkforbindelser også inneholdt hans nye metall. Han analyserte «rent» sinkmetall, og fant at hans nye metall var til stede selv i dette.
Han anslår at det nye metallet var tilstede på mellom 0,1% og 1% i sink og dets forbindelser, hvorfra han var i stand til å isolere 3 gram rent kadmiummetall.
Stromeyer foreslo navnet på kadmium. etter ‘cadmia’, det latinske navnet på calamine. Calamine er et gammelt navn for en sinkmalm.
Cadmium ble uavhengig oppdaget av den tyske kjemikeren Karl Hermann i 1818. Hermann hadde lagt merke til en uventet gul farge i sinksulfid. Det gule ble antatt å være fra arsenurens, men Hermann skjønte at det faktisk skyldtes en tidligere ukjent ele. mente. (2)


Kadmium tellurid brukes til å lage tynnfilms solceller, som kan absorbere mer enn 90% av synlig lys. Bilde: NREL
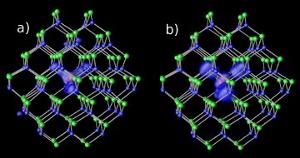
Magnesium urenheter i kadmium – selen nanokrystaller på to forskjellige gapnivåer : (a) resonans og (b) hybrid. Bilde: NERSC
Utseende og egenskaper
Skadelige effekter:
Kadmium og dets forbindelser er svært giftige.
Kjennetegn:
Kadmium er et mykt, formbart, duktilt, blåhvitt metall som enkelt kuttes med en kniv. Den er en utmerket elektrisk leder og viser god motstand mot korrosjon og angrep fra kjemikalier.
Den ligner på mange måter sink i sine kjemiske egenskaper.
Kadmium flekker i luft og er løselig i syrer, men ikke i baser.
Metallet brenner i luft for å danne brunt kadmiumoksid (CdO).
Bruk av kadmium
Kadmiums viktigste bruk er i batterier (spesielt oppladbart nikkel – kadmium, NiCad, batterier).
Som et resultat av den lave friksjonskoeffisienten og den høye utmattelsesmotstanden, brukes kadmium i legeringer for lagre. Kadmium brukes i lavtsmeltende legeringer og er en komponent i mange typer lodd. Det brukes også til galvanisering.
Forbindelser som inneholder kadmium brukes i svart-hvitt TV-fosfor, og i blå og grønn fosfor for fargefjernsyns-bilderør. Kadmiumsulfid brukes som et gult pigment, og kadmiumselenid brukes som et rødt pigment, ofte kalt kadmiumrødt.
Kadmium og tellur kan blandes til CdTe tynnfilms solcellemoduler hvis fysiske egenskaper er ideelle produksjon av solceller. De har relativt lave kostnader og har et nesten perfekt bånd for høsting av solenergi.
Overflod og isotoper
Overflod på jordskorpen: 150 vektdeler per milliard, 30 deler per milliard per mol
Rikelig solsystem: 6 vektdeler per milliard, 70 deler per billioner mol
Kostnad, ren: $ 46 per 100 g
Kostnad, bulk: $ 0,77 per 100 g
Kilde: Kadmium forekommer oftest i små mengder assosiert med sinkmalm, slik som sfaleritt (ZnS). Greenockite (CdS) er det eneste kadmiummineralet med noen konsekvens. Nesten alt kadmium oppnås som et biprodukt av raffinering av sink, kobber og blymalm.

- Friedrich Stromeyer, Annals of Philosophy, redigert av Thomas Thomson, bind XIII, 1819, Robert Baldwin, s108
- JW Mellor, A Comprehensive Treatise in Inorganic and Theoretical Chemistry, Volume IV, 1929, Longmans, Green and Co. Ltd., p404
Sitere denne siden
For online linking , kopier og lim inn ett av følgende:
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium</a>
eller
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium Element Facts</a>
Til sitere denne siden i et akademisk dokument, bruk følgende sitat som samsvarer med MLA:
"Cadmium." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cadmium.html>.