Solutions
ColligativeProperties
Damptrykksdepresjon
Fysiske egenskaper kan deles inn i to kategorier. Ekstensive egenskaper (som masse og volum) avhenger av størrelsen på prøven. Intensive egenskaper (som tetthet og konsentrasjon) er karakteristiske egenskaper for stoffet; de er ikke avhengig av størrelsen på prøven som studeres. Thissection introduserer en tredje kategori som er en delmengde av et systems intensive egenskaper. Denne tredje kategorien, kjent som kolligative egenskaper, kan bare brukes på løsninger. Bydefinisjon, en av egenskapene til en løsning, er en kolligativ egenskap hvis den bare avhenger av forholdet mellom antall partikler av løsemiddel og løsemiddel i løsningen, ikke identiteten til løsemidlet.
Svært få av de fysiske egenskapene til en løsning er kollektive egenskaper. Som et eksempel på dette begrensede settet med fysiske egenskaper, la oss se på hva som skjer med oppløsningsmidlets damptrykk når vi tilfører et løsemiddel for å danne en løsning. Vi definerer Po som damptrykket til den rene væsken ![]() løsningsmidlet
løsningsmidlet ![]() og P som damptrykk av løsningsmidlet etter at en oppløsningsmiddel er blitt tilsatt.
og P som damptrykk av løsningsmidlet etter at en oppløsningsmiddel er blitt tilsatt.
Po = damptrykk av den rene væsken, eller løsningsmidlet
P = damptrykket til løsningsmidlet i oppløsning
Når en væskes temperatur er under kokepunktet kan vi anta at de eneste molekylene som kan rømme fra væsken for å danne en gass, er de som ligger nær overflaten av væsken.
Når en oppløsningsmiddel tilsettes løsningsmidlet, opptar noen av oppløsningsmolekylene rommet nær væskeoverflaten, vist i figuren nedenfor. Når en oppløsningsmiddel er oppløst i løsemiddel, reduseres antall løsningsmiddelmolekyler nær overflaten, og damptrykket til løsningsmidlet reduseres.

Dette har ingen innvirkning på hastigheten hvormed løsningsmiddelmolekyler i gassfasen kondenserer for å danne en væske. Men det avtar hvorved løsningsmiddelmolekylene i væsken kan unnslippe i gassfasen. Som et resultat bør damptrykket til løsningsmidlet som kommer ut av en løsning være mindre enn damptrykket til det rene løsningsmidlet.
| P | < | Po | ||
| damptrykk av løsemiddel over en løsning |
damptrykk av det rene løsningsmidlet |
Mellom 1887 og 1888 viste Francois-Marie Raoult at damptrykket til en løsning er tilsvarer molfraksjonen av løsningsmidlet ganger damptrykket til den rene væsken.
| P | = | Csolvent Po | ||||
| damptrykk av løsningsmidlet over en løsning |
damptrykk til det rene løsningsmidlet |
Denne ligningen, som er kjent som Raoults lov, er lett å forstå. Når løsningsmidlet er rent og molfraksjonen av løsningsmidlet er lik 1, er P lik Po. Når molfraksjonen av løsningsmidlet blir mindre blir damptrykket til løsningsmidlet som rømmer fra løsningen også mindre.
La oss for øyeblikket anta at løsningsmidlet er den eneste komponenten i løsningen som er flyktig nok til å ha et målbart damptrykk. Hvis dette er sant, vil damptrykket til løsningen være lik damptrykket til løsningsmidlet som kommer ut av løsningen. Raoults lov antyder at forskjellen mellom damptrykket til det rene løsningsmidlet og løsningen øker når molfraksjonen av løsningsmidlet avtar.
Endringen i damptrykket som oppstår når løsemiddel tilsettes et løsemiddel er derfor en kolligativ egenskap. Hvis det avhenger av molfraksjonen av det oppløste stoffet, må det avhenge av forholdet mellom antall partikler av oppløst løsemiddel i løsningen, men ikke identiteten til det oppløste stoffet.
![]()
Kokepunkt Heving og frysepunktdepresjon
Figuren nedenfor viser konsekvensene av det faktum at oppløsninger senker damptrykket til et løsningsmiddel. linjekoblingspunkt B og C i dette fasediagrammet inneholder kombinasjonene av temperatur og trykk der det rene løsningsmidlet og dets damp er i likevekt. Hvert punkt på denne linjen beskriver derfor damptrykket til det oppløsningsmidlet ved den temperaturen. es av en løsning oppnådd ved å oppløse løselig i løsningsmidlet.Ved en gitt temperatur er damptrykket til løsningsmidlet som slipper ut av løsningen mindre enn damptrykket til det rene løsningsmidlet. Den prikkete linjen ligger derfor under den faste linjen.
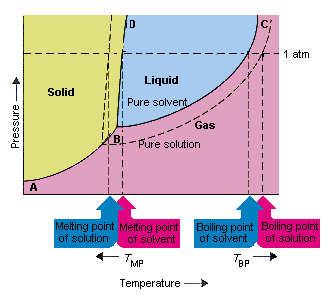
Nedgangen i damptrykket til løsningsmidlet som oppstår når en oppløsningsmiddel tilsettes løsningsmidlet forårsaker en økning i kokepunktet og en reduksjon i oppløsningenes smeltepunkt.
I følge denne figuren kan løsningen ikke koke ved samme temperatur som det rene løsningsmidlet. Hvis damptrykket på løsningsmidlet som rømmer fra løsningen er mindre enn damptrykket til det rene løsningsmidlet ved en gitt temperatur, må oppløsningen varmes opp til en høyere temperatur før det koker. Senking av damptrykket til løsningsmidlet som oppstår når det brukes til å danne en løsning øker væskens kokepunkt.
Når fasediagrammer ble introdusert, ble trippelpunktet definert som den eneste kombinasjonen av temperatur og trykk som gass, væske og fast stoff kan eksistere samtidig. Figuren ovenfor viser at trippelpunktet til løsningen oppstår ved en lavere temperatur enn trippelpunktet for det rene løsningsmidlet.I seg selv er ikke endringen i trippelpunktet viktig. Men det resulterer i en endring i temperaturen der løsningen fryser eller smelter. For å forstå hvorfor, vi må se omsorg helt på linjen som skiller de faste og flytende områdene i fasediagrammet. Denne linjen er nesten loddrett fordi smeltepunktet til et stoff ikke er veldig følsomt for trykk.
Tilsetning av et løsemiddel til et løsningsmiddel endrer ikke måten smeltepunktet avhenger av trykk. Linjen som skiller de faste og flytende områdene av løsningen er derfor parallell med linjen som har samme funksjon for det rene løsningsmidlet. Denne linjen må imidlertid passere gjennom trippelpunktet for løsningen. Reduksjonen i trippelpunktet som oppstår når løselig oppløses i et løsningsmiddel reduserer derfor smeltepunktet til løsningen.
Figuren over viser hvordan endring i damptrykk som oppstår når et oppløst stoff oppløses i et løsningsmiddel, fører til endringer i smeltepunktet og oppløsningsmidlets kokepunkt også. Fordi endringen i damptrykk er en kolligativ egenskap, som bare avhenger av det relative antall løsemiddel og løsemiddelpartikler endringene i kokepunktet og smeltepunktet til løsningsmidlet er også kolligative egenskaper.
![]()
ColligativeProperties Calculations
Den beste måten å gjøre demoner på at viktigheten av kolligative eiendommer er å undersøke konsekvensene av Raoults lov. Det ble funnet ut at damptrykket til løsningsmidlet som rømmer fra oppløsningen er proporsjonalt med molfraksjonen av løsningsmidlet.
P = CsolventPo
Men damptrykket til et løsningsmiddel er ikke en kolligativ eiendom. Bare endringen i damptrykk som oppstår når en oppløsningsmiddel tilsettes løsningsmidlet, kan inkluderes blant de løsningsmessige egenskapene til en løsning.
Fordi trykk er en tilstandsfunksjon, kan endringen i damptrykket til løsningsmidlet som oppstår når et løsemiddel tilsettes løsningsmidlet defineres som forskjellen mellom damptrykket til det rene løsningsmidlet og damptrykket i løsningsmidlet. rømmer fra løsningen.
P = Po – P
Å erstatte Raoults lov i denne ligningen gir følgende resultat.
P = Po – Csolvent Po = (1 – Csolvent) Po
Denne ligningen kan forenkles ved å huske forholdet mellom molfraksjonen av løsemidlet og molfraksjonen av løsningsmidlet.
Csolute + Csolvent = 1
Erstatter dette forhold til ligningen som definerer Pgives en annen form for Raoults lov.
P = CsolutePo
Denne ligningen minner oss om at endringen i damptrykket til løsningsmidlet som oppstår når en løsemiddel tilsettes løsningsmidlet er proporsjonal med molfraksjonen av løsemidlet. Etter hvert som merløselig er oppløst i løsningsmidlet, reduseres damptrykket til løsningsmidlet, og endringen i damptrykket til løsningsmidlet øker.
Fordi endringer i oppløsningsmidlets kokepunkt (TBP) som oppstår når en oppløsningsmiddel tilsettes et løsemiddel, skyldes endringer i løsemiddels damptrykk, er størrelsen på endringen i kokepunktet også proporsjonal til molefraksjonsløsningen.
![]() TBP = kbsolute
TBP = kbsolute
I fortynnede løsninger er molfraksjonen av løsemidlet proporsjonalt med molaliteten til løsningen, som vist i figuren nedenfor.

Ligningen som beskriver størrelsen på kokepunkteffekten som oppstår når en oppløsningsmiddel tilsettes et løsningsmiddel, blir derfor ofte skrevet som følger.
![]() TBP = kbm
TBP = kbm
Her, ![]() TBPis kokepunktet – endringen i kokepunktet som oppstår når et løsemiddel oppløses i løsningsmidlet
TBPis kokepunktet – endringen i kokepunktet som oppstår når et løsemiddel oppløses i løsningsmidlet ![]() og kb er en proporsjonalitetskonstant kjent som molalkokepunktets høyde konstant for løsningsmidlet.
og kb er en proporsjonalitetskonstant kjent som molalkokepunktets høyde konstant for løsningsmidlet.
En lignende ligning kan skrives for å beskrive hva som skjer med et løsningsmiddels frysepunkt (eller smeltepunkt) når en løsemiddel tilsettes løsningsmidlet.
![]() TFP = -kfm
TFP = -kfm
I denne ligningen er ![]() TFP frysepunktet depresjon
TFP frysepunktet depresjon ![]() endringen i frysepunktet som skjer når det oppløste stoffet oppløses i løsningsmidlet – og kfis molalt frysepunktet depresjonskonstant for løsningsmidlet. Et negativt tegn brukes i denne ligningen for å indikere at oppløsningsmiddelets frysepunkt avtar når en løsemiddel tilsettes.
endringen i frysepunktet som skjer når det oppløste stoffet oppløses i løsningsmidlet – og kfis molalt frysepunktet depresjonskonstant for løsningsmidlet. Et negativt tegn brukes i denne ligningen for å indikere at oppløsningsmiddelets frysepunkt avtar når en løsemiddel tilsettes.
Verdier av kf og kbas samt frysepunktene og kokepunktene for et antall rene løsningsmidler er gitt i tabellene nedenfor.
Frysepunkt Depresjonskonstanter
Kokepunkt Elevasjonskonstanter
Øvingsoppgave 6:
Beregn molekylvekten av svovel hvis 35,5 gram svovel oppløses i 100,0 gram CS2 for å produsere en løsning som har et kokepunkt på 49,48oC.
Klikk her for å sjekke svaret ditt på Øvingsoppgave 6
Klikk her for å se en løsning på Øvingsoppgave 6
Praksis Oppgave 7:
Bestem molekylvekten til eddiksyre hvis en løsning som inneholder 30,0 gram eddiksyre pr. kilo vann fryser ved -0,93oC. Stemmer disse resultatene med antagelsen om at eddiksyre har formelen CH3CO2H?
Klikk her for å sjekke svaret ditt på Practice Problem 7
Klikk her for å se en løsning på Practice 7
Hva ville skje i beregningen i Practice Oppgave 7 ble gjentatt med en sterkere syre, for eksempel saltsyre?
Øv oppgave 8:
Forklar hvorfor en 0,100 m løsning av HCl oppløst i benzen har et frysepunktdepresjon på 0,512oC, mens en 0,100 m løsning av HC1 i vann har et frysepunktdepresjon på 0,352oC.
Klikk her for å sjekke svaret ditt på Øvingsoppgave 8
I 1884 Jacobus Henricus van «t Hoff introduserte et nytt uttrykk for frysepunktet depresjon og kokepunktet høydeuttrykk for å forklare de kolligative egenskapene til løsninger av forbindelser som dissosierer når de oppløses i vann.
![]() TFP = – kf (i) m
TFP = – kf (i) m
Å erstatte den eksperimentelle verdien for frysepunktdepresjonen av en 0,100 m HCl-løsning i denne ligningen gir en verdi for i-termen 1,89. Hvis HCl ikke dissosierte i vann, ville jeg være 1. Hvis den dissosierer helt, ville jeg være 2. Den eksperimentelle verdien av 1,89 foreslår minst 95% av HCl-molekylene dissosierer i denne løsningen.
Øv Oppgave 9:
Forklar hvorfor 0,60 gram eddiksyre oppløses i 200 gram benzen for å danne en løsning som senker frysepunktet for benzen til 5,40oC.
Klikk her for å sjekke svaret ditt på Øv oppgave 9
![]()
Osmotisk trykk
I 1784 oppdaget den franske fysikeren og presten Jean AntoineNollet at en griseblære fylt med en konsentrert oppløsning av alkohol i vann utvidet seg når den ble nedsenket i vann. Blæren fungerte som en semipermeabel membran, som tillot vannmolekyler å komme inn i løsningen, men holdt alkoholmolekyler i å bevege seg i den andre retningen. Bevegelse av en komponent av en løsning gjennom en membran for å fortynne oppløsningen kalles osmose, og trykket som produseres kalles det osmotiske trykket ().
Osmotisk trykk kan demonstreres med apparatet vist i figuren nedenfor. En semipermeabel membran er bundet over den åpne enden av et tistelrør. Røret fylles deretter delvis med en løsning av sukker eller alkohol i vann og senkes ned i litt vann. Vann vil strømme inn i røret til trykket på vannsøylen på grunn av tyngdekraften balanserer det kosmotiske trykket som driver vann gjennom membranen.

Vann renner gjennom den semipermeable membranen for å fortynne alkoholløsningen til tyngdekraften som trekker ned på kolonnen til denne løsningen, balanserer det osmotiske trykket som skyver vannet gjennom membranen.
Samme år som Raoult oppdaget forholdet mellom damptrykket til en løsning og damptrykket til et rent løsemiddel, Jacobus Henricus van «t Hoff fant at osmotisk trykk av en fortynnet oppløsning () overholdt en ligning analog med den ideelle gassligningen.
| |
= | nRT | ||
| V |
Denne ligningen antyder at osmotisk trykk er et annet eksempel på en kolligativ egenskap, fordi dette trykkavhengig av forholdet mellom antall oppløste partikler og volumet av løsningen ![]() n / V
n / V ![]() ikke identiteten til løsepartiklene. minner oss også om størrelsen på osmotisk trykk. I henhold til denne ligningen er en 1,00 M s olusjon har et osmotisk trykk på 22,4 atm ved 0oC.
ikke identiteten til løsepartiklene. minner oss også om størrelsen på osmotisk trykk. I henhold til denne ligningen er en 1,00 M s olusjon har et osmotisk trykk på 22,4 atm ved 0oC.

Dette betyr at en 1,00 M-løsning skal kunne støtte en søyle med vann 670 tommer eller nesten 56 fot høy !
Biologer og biokjemikere utnytter ofte osmotisk trykk når de isolerer komponentene i en celle. Når en celle tilsettes i en vandig løsning som inneholder mye høyere konsentrasjon av ioner enn væsken i cellen, forlater den cellen ved å strømme gjennom cellemembranen til cellene krymper så mye at membranen bryter. Alternativt, når en celle plasseres i en løsning som har en mye mindre ionisk styrke, strømmer det vann inn i cellen, og cellen utvides til cellemembranen sprekker.
![]()