Sykloheksanmolekyl
Sykloheksan er en cykloalkan med molekylformelen C6H12. Sykloheksan brukes som et ikke-polært løsningsmiddel for den kjemiske industrien, og også som et råmateriale for industriell produksjon av adipinsyre og kaprolaktam, som begge er mellomprodukter som brukes i produksjonen av nylon. I industriell skala produseres cykloheksan ved å reagere benzen med hydrogen. På grunn av sine unike kjemiske og konformasjonsegenskaper blir sykloheksan også brukt i laboratorier i analyse og som standard.
Sykloheksanmolekyl ved bruk av Jsmol se – For 3D-strukturer
Sykloheksanstruktur Molekyl
Den 6 toppede ringen samsvarer ikke med formen til en perfekt sekskant. Konformasjonen av en flat 2D plan sekskant har betydelig vinkelspenning på grunn av at bindingen ikke er 109,5 grader; torsjonsbelastningen vil også være betydelig på grunn av alle formørkede obligasjoner. Derfor, for å redusere torsjonsbelastning, vedtar cykloheksan en tredimensjonal struktur kjent som stolkonformasjonen. Den nye konformasjonen setter karbonene i en vinkel på 109,5 °. Halvparten av hydrogenene er i planet av ringen (ekvatorial) mens den andre halvparten er vinkelrett på planet (aksial). Denne konformasjonen muliggjør den mest stabile strukturen av cykloheksan. En annen konformasjon av cykloheksan eksisterer, kjent som båtkonformasjon, men den konverterer til den litt mer stabile stolformasjonen. Hvis cykloheksan er monosubstituert med en stor substituent, vil substituenten mest sannsynlig bli funnet festet i en ekvatorial stilling, da dette er den litt mer stabile konformasjonen.
Cykloheksan har den laveste vinkelen og torsjonsstammen av som et resultat har cyclohexane blitt ansett som 0 i total ringstamme, en kombinasjon av vinkel og torsjonsstamme. Dette gjør også cykloheksan til det mest stabile av cykloalkanene og vil derfor produsere minst mulig varme når det brennes sammenlignet med de andre cykloalkanene.
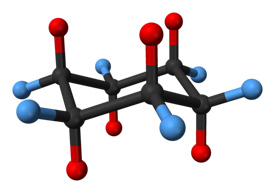
Et cykloheksanmolekyl i stolkonformasjon. Hydrogenatomer i aksiale posisjoner er vist i rødt, mens de i ekvatoriale posisjoner er i blått.
Reaksjoner med cykloheksan
Ren cykloheksan i seg selv er ganske ureaktiv, fordi den er en ikke-polær, hydrofob hydrokarbon. Den kan reagere med veldig sterke syrer som supersyre-systemet HF + SbF5 som vil forårsake tvunget protonering og «hydrokarbonsprengning». Substituerte cykloheksaner kan imidlertid være reaktive under en rekke betingelser, hvorav mange er viktige for organisk kjemi. Sykloheksan er svært brannfarlig.
Sykloheksanderivater
Den spesifikke ordningen av funksjonelle grupper i cykloheksanderivater, og faktisk i de fleste cykloalkanmolekyler, er ekstremt viktig i kjemiske reaksjoner, spesielt reaksjoner som involverer nukleofiler. Substituenter på ringen må være i aksial formasjon for å reagere med andre molekyler. For eksempel vil reaksjonen av bromsykloheksan og en vanlig nukleofil, et hydroksidanion, resultere i cykloheksen.
Denne reaksjonen, kjent som en eliminasjonsreaksjon eller dehalogenering (spesifikt E2), krever at bromsubstituenten er i den aksiale formasjonen, imot et annet aksialt H-atom for å reagere. Forutsatt at bromsykloheksan var i passende formasjon for å reagere, ville E2-reaksjonen starte som sådan:
- Elektronparbinding mellom C-Br beveger seg til Br, danner Br∠‘og setter den fri fra cykloheksan
- Nukleofilen (-OH) gir et elektronpar til den tilstøtende aksiale H, setter H fri og binder til den for å skape H2O
- Elektronparbinding mellom den tilstøtende aksial H beveger seg til bindingen mellom de to CC, noe som gjør den C = C
Merk: Alle tre trinnene skjer samtidig, karakteristisk for alle E2-reaksjoner.
Reaksjonen over vil generere mest E2-reaksjoner, og som et resultat vil produktet være mest (~ 70%) cykloheksen. Prosentandelen varierer imidlertid med forholdene, og generelt konkurrerer to forskjellige reaksjoner (E2 og Sn2). I den ovennevnte reaksjonen ville en Sn2-reaksjon erstatte brom med en hydroksyl (OH-) gruppe i stedet, men nok en gang må Br være i aksial for å reagere. Når SN2-substitusjonen er fullført, vil den nylig substituerte OH-gruppen raskt vende tilbake til den mer stabile ekvatoriale posisjonen (~ 1 millisekund). Bruk
Kommersielt blir det meste av produsert cykloheksan omdannet til cykloheksanon-cykloheksanolblanding ved katalytisk oksidasjon. KA-olje blir deretter brukt som råstoff for adipinsyre og kaprolaktam. Praktisk talt, hvis innholdet av cykloheksanol i KA-olje er høyere enn cykloheksanon, er det mer sannsynlig (økonomisk) å bli omdannet til adipinsyre, og omvendt er produksjon av kaprolaktam mer sannsynlig. Slike forhold i KA-olje kan kontrolleres ved å velge egnede oksidasjonskatalysatorer. Noe av cykloheksan brukes som et organisk løsningsmiddel.
Sykloheksan i forskning
Selv om mye allerede er kjent om dette sykliske hydrokarbonet, forskes det fortsatt på cykloheksan- og benzenblandinger og fastfase cykloheksan for å bestemme hydrogenutbyttet av blandingen når den bestråles ved 195 ° C.
Historie
I motsetning til forbindelser som benzen, kan ikke cykloheksan lett oppnås fra naturressurser som kull. Mot slutten av det nittende århundre måtte tidlige kjemiske etterforskere være avhengige av organisk syntese. Det tok dem 30 år å utarbeide detaljene. I 1867 reduserte Marcellin Berthelot benzen med saltsyre ved forhøyede temperaturer. Han identifiserte reaksjonsproduktet feilaktig som n-heksan, ikke bare på grunn av den passende matchen i kokepunktet (69 ° C), men også fordi han ikke trodde at benzen var et syklisk molekyl (som hans samtidige August Kekule), men heller en slags tilknytning av acetylen. I 1870 gjentok en av hans skeptikere Adolf von Baeyer reaksjonen og uttalte det samme reaksjonsproduktet heksahydrobenzen, og i 1890 mente Vladimir Markovnikov at han var i stand til å destillere den samme forbindelsen fra Kaukasus-petroleum og kalte sin sammensetning heksanaften
I 1894 Baeyer syntetisert cykloheksan startende med en Dieckmann-kondens av pimelsyre etterfulgt av flere reduksjoner. og samme år E. Haworth og W.H. Perkin Jr. (1860 – 1929) gjorde det samme i en Wurtz-reaksjon av 1,6-dibromheksan. Overraskende nok kokte deres cykloheksaner høyere med 10 ° C enn enten heksahydrobenzen eller heksanaften, men denne gåten ble løst i 1895 av Markovnikov, NM Kishner og Nikolay. Zelinsky da de re-diagnostiserte heksahydrobenzen og heksanaften som metylsyklopentan, resultatet av en uventet omorganiseringsreaksjon.