ATP-molecuul
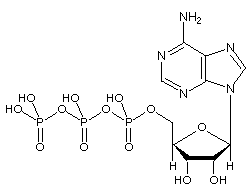
Het adenosinetrifosfaat (ATP) -molecuul is het bekende nucleotide in de biochemie als de “moleculaire valuta” van intracellulaire energieoverdracht; dat wil zeggen, ATP is in staat om chemische energie in cellen op te slaan en te transporteren. ATP speelt ook een belangrijke rol bij de synthese van nucleïnezuren.
Voor 3D-structuur van deze afbeelding met Jsmol Klik hier
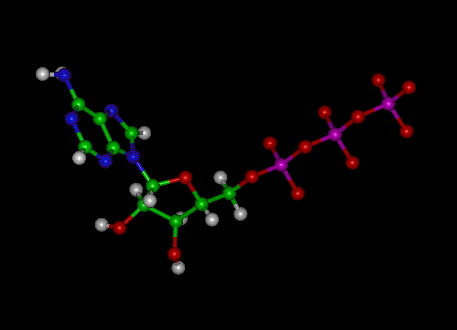
Afbeelding: Moleculaire structuur van ATP
Energie komt vrij door hydrolyse van de derde fosfaatgroep. Nadat deze derde fosfaatgroep is vrijgegeven, kan het resulterende ADP (adenosinedifosfaat) energie absorberen en de groep herwinnen, waardoor een ATP-molecuul wordt geregenereerd; hierdoor kan ATP energie opslaan als een oplaadbare batterij.
Fosforylposities
De fosforylgroepen die beginnen met die op AMP worden de alfa-, bèta- en gammafosfaten genoemd.
Fysische en chemische eigenschappen
ATP bestaat uit adenosine – samengesteld uit een adeninering en een ribosesuiker – en drie fosfaatgroepen (trifosfaat). De fosforylgroepen, beginnend met de groep die het dichtst bij de ribose ligt, worden de alfa- (α), bèta- (β) en gamma (γ) -fosfaten genoemd. Bijgevolg is het nauw verwant aan het adeninenucleotide, een monomeer van RNA. ATP is zeer oplosbaar in water en vrij stabiel in oplossingen tussen pH 6,8 en 7,4, maar wordt snel gehydrolyseerd bij extreme pH. ATP kan daarom het beste worden opgeslagen als een watervrij zout.
ATP is een onstabiel molecuul in ongebufferd water, waarin het hydrolyseert tot ADP en fosfaat. Dit komt omdat de sterkte van de bindingen tussen de fosfaatgroepen in ATP minder is dan de sterkte van de waterstofbindingen (hydratatiebindingen), tussen zijn producten (ADP en fosfaat) en water. Dus als ATP en ADP in chemisch evenwicht zijn in water, zal bijna al het ATP uiteindelijk worden omgezet in ADP. Een systeem dat verre van evenwicht is, bevat Gibbs-vrije energie en is in staat om werk te doen. Levende cellen handhaven de verhouding van ATP tot ADP op een punt tien ordes van grootte van evenwicht, met ATP-concentraties vijf keer hoger dan de concentratie van ADP. Deze verplaatsing uit evenwicht betekent dat de hydrolyse van ATP in de cel een grote hoeveelheid vrije energie vrijgeeft.
Twee fosfoanhydride-bindingen (die aangrenzende fosfaten verbinden) in een ATP-molecuul zijn verantwoordelijk voor de hoge energie-inhoud van dit molecuul. In de context van biochemische reacties worden deze anhydridebindingen vaak – en soms controversieel – hoogenergetische bindingen genoemd (ondanks het feit dat het energie kost om bindingen te verbreken). Energie die is opgeslagen in ATP kan vrijkomen bij hydrolyse van de anhydridebindingen. De primaire fosfaatgroep op het ATP-molecuul die wordt gehydrolyseerd wanneer energie nodig is om anabole reacties op gang te brengen, is de γ-fosfaatgroep. Het bevindt zich het verst van de ribosesuiker en heeft een hogere hydrolyse-energie dan het α- of β-fosfaat. De bindingen gevormd na hydrolyse – of de fosforylering van een residu door ATP – zijn lager in energie dan de fosfoanhydride bindingen van ATP. Tijdens enzymgekatalyseerde hydrolyse van ATP of fosforylering door ATP, kan de beschikbare vrije energie worden benut door een levend systeem om werk te doen.
Elk onstabiel systeem van potentieel reactieve moleculen kan mogelijk dienen als een manier om vrije energie op te slaan. energie, als de cel zijn concentratie ver van het evenwichtspunt van de reactie behield. Echter, zoals het geval is met de meeste polymere biomoleculen, wordt de afbraak van RNA, DNA en ATP in eenvoudigere monomeren gedreven door overwegingen van zowel energie-afgifte als entropie-toename, in zowel standaardconcentraties als de concentraties die in de cel voorkomen.
De standaard hoeveelheid energie die vrijkomt bij hydrolyse van ATP kan worden berekend uit de veranderingen in energie onder niet-natuurlijke (standaard) omstandigheden, en vervolgens gecorrigeerd naar biologische concentraties. De netto verandering in warmte-energie (enthalpie) bij standaardtemperatuur en druk van de ontleding van ATP in gehydrateerd ADP en gehydrateerd anorganisch fosfaat is -30,5 kJ / mol, met een verandering in vrije energie van 3,4 kJ / mol. De energie die vrijkomt bij het splitsen van een fosfaat (Pi) of pyrofosfaat (PPi) eenheid van ATP bij standaardtoestand van 1 M is:
ATP + H
2O → ADP + Pi ΔG ° = -30.5 kJ / mol (−7,3 kcal / mol)
ATP + H
2O → AMP + PPi ΔG ° = −45,6 kJ / mol (−10,9 kcal / mol)
Deze waarden kunnen gebruikt om de verandering in energie onder fysiologische omstandigheden en de cellulaire ATP / ADP-verhouding te berekenen. Er wordt echter steeds meer een meer representatieve waarde (die rekening houdt met AMP), de energielading genoemd. De waarden die voor de Gibbs-vrije energie voor deze reactie worden gegeven, zijn afhankelijk van een aantal factoren, waaronder de algehele ionsterkte en de aanwezigheid van aardalkalimetaalionen zoals Mg2 +
en Ca2 +
.Onder typische cellulaire omstandigheden is ΔG ongeveer -57 kJ / mol (−14 kcal / mol).
Synthese
ATP kan worden geproduceerd door verschillende cellulaire processen, meestal in mitochondriën door oxidatieve fosforylering onder de katalytische invloed van ATP-synthase of in het geval van planten in chloroplasten door fotosynthese.
De belangrijkste brandstoffen voor ATP-synthese zijn glucose en vetzuren. In eerste instantie wordt glucose in het cytosol afgebroken tot pyruvaat. Voor elk glucosemolecuul worden twee ATP-moleculen gegenereerd. De terminale stadia van ATP-synthese worden uitgevoerd in het mitochondrium en kunnen tot 34 ATP genereren.
ATP in het menselijk lichaam
De totale hoeveelheid ATP in het menselijk lichaam is ongeveer 0,1 mol. De energie die een volwassene dagelijks gebruikt, vraagt om hydrolyse van 200 tot 300 mol ATP. Dit betekent dat elk ATP-molecuul gedurende de dag 2000 tot 3000 keer moet worden gerecycled. ATP kan niet worden opgeslagen en daarom moet de synthese het verbruik nauwlettend volgen.
Andere trifosfaten
Levende cellen hebben ook andere “hoogenergetische” nucleosidetrifosfaten, zoals guaninetrifosfaat. Tussen hen en ATP kan energie gemakkelijk worden overgedragen met reacties zoals die worden gekatalyseerd door nucleosidedifosfokinase: energie komt vrij wanneer hydrolyse van de fosfaat-fosfaatbindingen wordt uitgevoerd. Deze energie kan worden gebruikt door een verscheidenheid aan enzymen, motoreiwitten en transporteiwitten om het werk van de cel uit te voeren. Ook levert de hydrolyse vrij anorganisch fosfaat en adenosinedifosfaat op, die verder kunnen worden afgebroken tot een ander fosfaationen en adenosinemonofosfaat. ATP kan ook direct worden afgebroken tot adenosinemonofosfaat, waarbij pyrofosfaat wordt gevormd. Deze laatste reactie heeft het voordeel dat het een effectief onomkeerbaar proces is in waterige oplossing.
Reactie van ADP met GTP
ADP + GTP > ATP + GDP