Cadmium Element Feiten
Het chemische element cadmium wordt geclassificeerd als een overgangsmetaal. Het werd in 1817 ontdekt door Friedrich Stromeyer.

Data Zone
| Classificatie: | Cadmium is een overgangsmetaal |
| Kleur: | blauwachtig-wit |
| Atoomgewicht: | 112,41 |
| Staat: | vast |
| Smeltpunt: | 321,1 oC, 594,3 K |
| Kookpunt: | 765 oC, 1038 K |
| Elektronen: | 48 |
| Protonen: | 48 |
| neutronen in de meest voorkomende isotoop: | 66 |
| Elektronenschalen: | 2,8,18,18,2 |
| Elektronenconfiguratie: | 4d10 5s2 |
| Dichtheid bij 20oC: | 8,65 g / cm3 |
Meer weergeven, waaronder: Heats, Energies, Oxidation, Reacties,
Compounds, Radii, Geleidbaarheden
| Atoomvolume: | 13,1 cm3 / mol |
| Structuur: | hcp: hexagonaal dicht opeengepakt |
| Hardheid: | 2,0 mohs |
| Specifieke warmtecapaciteit | 0,23 J g-1 K-1 |
| Smeltwarmte | 6,192 kJ mol-1 |
| Vernevelingswarmte | 112 kJ mol-1 |
| Verdampingswarmte | 99,87 kJ mol-1 |
| 1e ionisatie-energie | 867,7 kJ mol-1 |
| 2e ionisatie-energie | 1631,4 kJ mol-1 |
| 3e ionisatie-energie | 3616,2 kJ mol-1 |
| Elektronenaffiniteit | – |
| Minimum oxidatiegetal | 0 |
| Min. gemeenschappelijk oxidatienummer | 0 |
| Maximaal oxidatiegetal | 2 |
| Max. gemeenschappelijke oxidatie nr. | 2 |
| Elektronegativiteit (Pauling-schaal) | 1,69 |
| Polariseerbaarheid volume | 7,2 Å3 |
| Reactie met lucht | mild, w / ht ⇒ CdO |
| Reactie met 15 M HNO3 | mild ⇒ Cd (NO3) 2, NOx |
| Reactie met 6 M HCl | mild, ⇒ H2, CdCl2 |
| Reactie met 6 M NaOH | geen |
| Oxide (s) | CdO, CdO2 |
| Hydride (s) | CdH2 |
| Chloride (n) | CdCl2 |
| Atoomradius | 151 uur |
| Ionische straal (1+ ion) | – |
| Ionische straal (2+ ion) | 109 uur |
| Ionische straal (3+ ion) | – |
| Ionische straal (1- ion) | – |
| Ionische straal (2-ion) | – |
| Ionische straal (3- ion) | – |
| Het gemiddelde geleidbaarheid | 96,6 W m-1 K-1 |
| Elektrische geleidbaarheid | 14,7 x 106 S m-1 |
| Vries- / smeltpunt: | 321,1 oC, 594,3 K |

Een klein balletje cadmiummetaal, met een munt als referentie voor de maat.

Friedrich Stromeyer, die cadmium ontdekte in 1817.
Cadmium’s periodieke systeemomgeving
| Groep 11 |
Groep 12 | Groep 13 | |
| 4 | 29 Cu |
30 Zn |
31 Ga |
| 5 | 47 Ag |
48 Cd |
49 In |
| 6 | 79 Au |
80 Hg |
81 Tl |
Ontdekking van cadmium
Cadmium werd in 1817 ontdekt door de Duitse chemicus Friedrich Stromeyer als een onzuiverheid in zinkoxide. (1)
Stromeyer deed zijn ontdekking na een verzoek van de overheid om de apotheken in de stad Hildesheim, Duitsland, te inspecteren.
In die tijd werd zinkoxide gebruikt, zoals het nog steeds is, om huidaandoeningen te behandelen. Om de een of andere reden verkochten de apotheken van Hildesheim zinkcarbonaat in plaats van het gebruikelijke zinkoxide.
Stromeyer was zich ervan bewust dat het verwarmen van zinkcarbonaat tot het roodgloeiend was, het in het oxide zou veranderen. Dit deed hij met stalen uit de apotheek. Hij ontdekte dat het schitterende witte carbonaat veranderde in een oxide dat wit had moeten zijn, maar in feite geel / oranje was.
Normaal gesproken suggereert deze kleur ijzer- of loodverontreiniging, maar Stromeyer kon geen spoor vinden van deze elementen.
Hij bezocht de fabriek in Salzgitter waar de apotheken het zinkcarbonaat hadden gekocht. Hij vroeg waarom ze zinkcarbonaat verkochten in plaats van het gebruikelijke oxide.
De manager legde hem uit dat hun zinkcarbonaat de verwachte kleur had – wit – en dat het gemakkelijk te verkopen was.
Toen ze probeerden het carbonaat door verhitting in het oxide om te zetten, het werd altijd geel. Omdat zinkoxide wit moest zijn, konden ze het niet verkopen. Ze hadden het zorgvuldig geanalyseerd op ijzerverontreiniging, maar konden er geen vinden.
Stromeyer besloot toen dat hij dit gele zinkoxide zelf zorgvuldig zou analyseren. Hij ontdekte dat de gele kleur werd veroorzaakt door ‘de aanwezigheid van een eigenaardig metaaloxide, waarvan het bestaan tot dusverre niet werd vermoed’.
Hij extraheerde dit nieuwe metaaloxide uit het zinkoxide en reduceerde het vervolgens om ’s werelds eerste cadmiummetaal ooit te isoleren. Hij vergeleek het uiterlijk met dat van platina en mat de dichtheid van 8,75 g / cm3 – heel dicht bij het huidige aanvaarde waarde.
Hij deed verder werk en ontdekte dat andere zinkverbindingen ook zijn nieuwe metaal bevatten. Hij analyseerde ‘puur’ zinkmetaal en ontdekte dat zijn nieuwe metaal zelfs hierin aanwezig was.
Hij schatte dat het nieuwe metaal tussen 0,1% en 1% aanwezig was in zink en zijn verbindingen, waaruit hij 3 gram puur cadmiummetaal kon isoleren.
Stromeyer suggereerde de naam cadmium na ‘cadmia’, de Latijnse naam voor calamine. Calamine is een oude naam voor een zinkerts.
Cadmium werd onafhankelijk ontdekt door de Duitse chemicus Karl Hermann in 1818. Hermann had een onverwachte gele kleur opgemerkt in zinksulfide Aangenomen werd dat het geel afkomstig was van arseenverontreinigingen, maar Hermann realiseerde zich dat het eigenlijk te wijten was aan een voorheen onbekend element. ment. (2)


Cadmiumtelluride wordt gebruikt om dunne film zonnecellen te maken, absorberen meer dan 90% van het zichtbare licht. Afbeelding: NREL
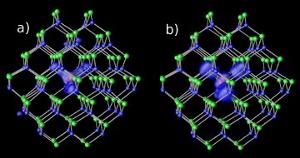
Magnesiumverontreinigingen in cadmium-selenium-nanokristallen op twee verschillende gap-niveaus : (a) resonant en (b) hybride. Afbeelding: NERSC
Uiterlijk en kenmerken
Schadelijke effecten:
Cadmium en zijn verbindingen zijn zeer giftig.
Kenmerken:
Cadmium is een zacht, kneedbaar, taai, blauwachtig wit metaal dat gemakkelijk met een mes kan worden gesneden. Het is een uitstekende elektrische geleider en vertoont een goede weerstand tegen corrosie en aantasting door chemicaliën.
Het is in veel opzichten vergelijkbaar met zink in zijn chemische eigenschappen.
Cadmium tast in lucht aan en is oplosbaar in zuren maar niet in basen.
Het metaal verbrandt in de lucht en vormt bruin cadmiumoxide (CdO).
Toepassingen van cadmium
Het belangrijkste gebruik van cadmium is in batterijen (vooral oplaadbare nikkel-cadmium, NiCad, batterijen).
Vanwege de lage wrijvingscoëfficiënt en de hoge weerstand tegen vermoeidheid, wordt cadmium gebruikt in legeringen voor lagers. Cadmium wordt gebruikt in legeringen met een laag smeltpunt en is een onderdeel van vele soorten soldeer. Het wordt ook gebruikt bij galvaniseren.
Cadmiumhoudende verbindingen worden gebruikt in zwart-wittelevisiefosforen en in blauw- en groenfosforen voor kleurentelevisiebeeldbuizen. Cadmiumsulfide wordt gebruikt als een geel pigment en cadmiumselenide wordt gebruikt als een rood pigment, vaak cadmiumrood genoemd.
Cadmium en tellurium kunnen worden gecompoundeerd tot CdTe dunne-film fotovoltaïsche modules waarvan de fysische eigenschappen ideaal zijn voor zonnecel productie. Ze zijn relatief goedkoop en hebben een bijna perfecte bandkloof voor het oogsten van zonne-energie.
Overvloed en isotopen
Overvloed aardkorst: 150 delen per miljard in gewicht, 30 delen per miljard in mol
Overvloed zonnestelsel: 6 gewichtsdelen per miljard, 70 delen per biljoen per mol
Kosten, puur: $ 46 per 100 g
Kosten, bulk: $ 0,77 per 100 g
Bron: Cadmium komt het vaakst voor in kleine hoeveelheden geassocieerd met zinkertsen, zoals sfaleriet (ZnS). Greenockite (CdS) is het enige cadmiummineraal van welke betekenis dan ook. Bijna alle cadmium wordt verkregen als bijproduct van de raffinage van zink, koper en looderts.

- Friedrich Stromeyer, Annals of Philosophy, uitgegeven door Thomas Thomson, Volume XIII, 1819, Robert Baldwin, p108
- JW Mellor, A Comprehensive Treatise in Anorganic and Theorhetic Chemistry, Volume IV, 1929, Longmans, Green and Co. Ltd., p404
Citeer deze pagina
Voor online linken , kopieer en plak een van de volgende:
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium</a>
of
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium Element Facts</a>
Aan citeer deze pagina in een academisch document, gebruik de volgende MLA-compatibele bronvermelding:
"Cadmium." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cadmium.html>.